Церебральная гипоперфузия это
1. Сокращения:
• Синдром гиперперфузии головного мозга (СГГМ)
2. Синонимы:
• Гиперперфузия после каротидной эндартерэктомии
• Богатая перфузия
3. Определение:
• Редкое (1-3%) нарушение, наиболее часто развивающееся как осложнение реваскуляризации артерий головного мозга:
о Умеренное ↑ CBF, часто развивающееся после каротидной эндартерэктомии (КЭА), и обычно протекающее бессимптомно
о СГГМ определяется как >100% увеличение rCBF по сравнению с предоперационными значениями
• Значительное увеличение ипсилатерального мозгового кровотока (CBF) сверх нормальных метаболических потребностей:
о Обычно развивается после процедуры реваскуляризации сонной артерии
о Может развиваться на фоне других состояний (например, эпилептический статус, синдром MELAS)
1. Общие характеристики синдрома гиперперфузии головного мозга (СГГМ):
• Лучший диагностический критерий
о Ипсилатеральный отек извилин, стушеванность борозд у пациентов после каротидной эндартерэктомии
о ↑ CBF, CBV при перфузионной МРТ (пМРТ), перфузионной КТ (пКТ)
• Размеры:
о Вариабельны
• Морфология:
о Соответствует области кровоснабжения сосудов
2. Рекомендации по визуализации:
• Лучший инструмент визуализации о МРТ с ДВИ, ПВИ
о ОФЭКТ
• Советы по протоколу исследования:
о Добавьте к исследованию последовательность Т2* (GRE или SWI) для поиска кровоизлияния
3. КТ при синдроме гиперпефузии головного мозга (СГГМ):
• Бесконтрастная КТ:
о Отек извилин
о Стушеванность рельефа коры
о ± гиподенсность (может наблюдаться в отсутствие изменений плотности ткани)
о Явное кровоизлияние развивается в 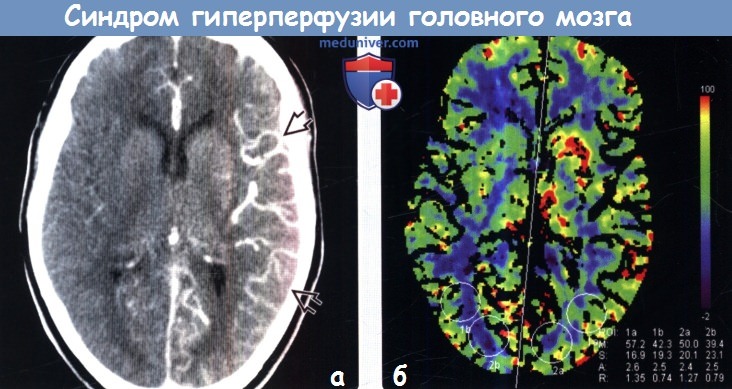 (а) Мужчина 56 лет со стенозом > 70% проксимального отдела шейной части левой ВСА перенес каротидную эндартерэктомию. Через несколько часов после операции у пациента остро возникли спутанность сознания и правосторонняя мышечная слабость. Исходное перфузионное изображение: отмечается заметное усиление кровотока по сосудам левого полушария.
(а) Мужчина 56 лет со стенозом > 70% проксимального отдела шейной части левой ВСА перенес каротидную эндартерэктомию. Через несколько часов после операции у пациента остро возникли спутанность сознания и правосторонняя мышечная слабость. Исходное перфузионное изображение: отмечается заметное усиление кровотока по сосудам левого полушария.
(б) КТ перфузионное исследование, проведенное у того же пациента: картина относительно нормальна, но значения CBF в области левого полушария повышены по сравнению с таковыми справа (ROI, обозначенные 2а и 2b).
4. МРТ при синдроме гиперпефузии головного мозга (СГГМ):
• Т1-ВИ:
о Кортикальный отек
о ± легкая гипоинтенсивность
о Стушеванность борозд
• Т2-ВИ:
о Отек извилин, гиперинтенсивный сигнал
• FLAIR:
о Гиперинтенсивный сигнал от коры
о Гиперинтенсивные включения в субарахноидальных пространствах на постконтрастных FLAIR наблюдаются при нарушении целостности ГЭБ
• Т2* GRE:
о Явное кровоизлияние развивается в 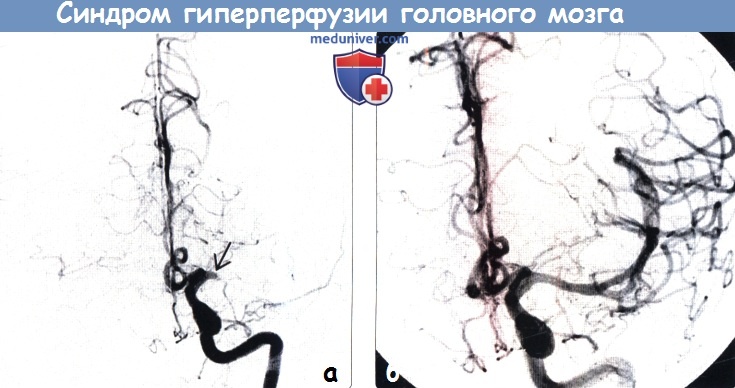 (а) После восстановления нормального кровотока в окклюзированной до этого СМА развилось ухудшение состояния пациента в виде усиления правосторонней мышечной слабости и появления пульсирующей головной боли. МР-перфузия, аксиальный срез: определяется повышение (зона, залитая красным цветом), а не снижение, CBF в левых височной и теменной долях.
(а) После восстановления нормального кровотока в окклюзированной до этого СМА развилось ухудшение состояния пациента в виде усиления правосторонней мышечной слабости и появления пульсирующей головной боли. МР-перфузия, аксиальный срез: определяется повышение (зона, залитая красным цветом), а не снижение, CBF в левых височной и теменной долях.
(б) МР-перфузия, аксиальный срез: у этого же пациента определяется увеличение объема мозгового кровотока.
в) Дифференциальная диагностика:
1. Острая ишемия-инфаркт головного мозга:
• Удлинение времени до пика/среднего времени циркуляции (укорочение отсутствует)
• Как правило, наблюдается ограничение диффузии на ДВИ (при СГГМ такого часто не происходит)
2. Эпилептический статус:
• Метаболическая гиперперфузия в пораженной ткани мозга
• Судороги в анамнезе полезны для постановки диагноза, но информация о них может быть не получена
3. Острая гипертензивная энцефалопатия, СЗОЭ:
• Ошибка ауторегуляции → гиперперфузия → эндотелиальное повреждение/вазогенный отек
• Характерно развитие изменений в области задней циркуляции
• Заметное повышенное артериального давления (множество причин):
о Эклампсия, преэклампсия
о Химиотерапия
о Почечная недостаточность
о Гемолитический уремический синдром/тромботическая тромбоцитопеническая пурпура
о Прием наркотических средств (особенно кокаина)
4. Синдром MELAS:
• Острый дефект окислительного фосфорилирования
• Инсультоподобные эпизоды, связанные с развитием вазогенного отека, гиперперфузии, повреждением нейронов
• Гиперинтенсивный сигнал от коры, кортикальное контрастирование
• Выполните МР-спектроскопию непораженной области, обратите внимание на пик лактата
5. Гиперкапния:
• Углекислый газ является мощным стимулятором CBF
• Сосудорасширяющий эффект на сосуды головного мозга
г) Патология. Общие характеристики синдрома гиперперфузии головного мозга (СГГМ):
• Этиология:
о Когнитивные нарушения после проведения КЭА/стентирования могут возникать вследствие:
– Эмболизации мозговых артерий во время диссекции, стентирования
– Глобальная гипоперфузия головного мозга во время пережатия сонной артерии
– Синдром гиперперфузии головного мозга
о СГГМ, вероятно, развивается вследствие неадекватной авторегуляции, изменения церебральной гемодинамики:
– «Резкий скачок перфузионного давления»:
Хроническая ишемия → нарушение ауторегуляции
Потеря нормальной способности к вазоконстрикции
«Сопротивляющиеся» сосуды становятся хронически дилатированными
Быстрое восстановление нормальной перфузии вследствие реваскуляризации → гиперперфузия в ранее не перфузируемой ткани мозга
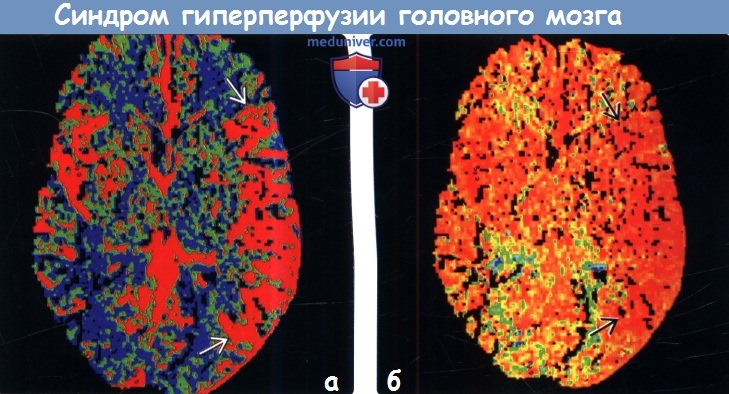 (а) После восстановления нормального кровотока в окклюзированной до этого СМА развилось ухудшение состояния пациента в виде усиления правосторонней мышечной слабости и появления пульсирующей головной боли. МР-перфузия, аксиальный срез: определяется повышение (зона, залитая красным цветом), а не снижение, CBF в левых височной и теменной долях.
(а) После восстановления нормального кровотока в окклюзированной до этого СМА развилось ухудшение состояния пациента в виде усиления правосторонней мышечной слабости и появления пульсирующей головной боли. МР-перфузия, аксиальный срез: определяется повышение (зона, залитая красным цветом), а не снижение, CBF в левых височной и теменной долях.
(б) МР-перфузия, аксиальный срез: у этого же пациента определяется увеличение объема мозгового кровотока. 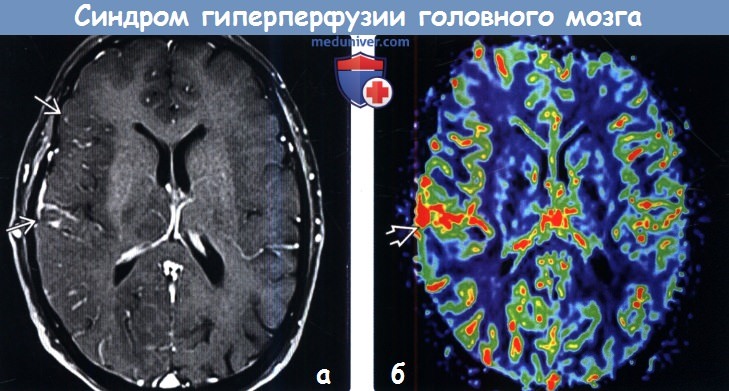 (а) Состояние гиперперфузии головного мозга при эпилептическом статусе, развившееся у женщины 52 лет с мышечной слабостью в левой половине тела после продолжительного судорожного приступа, представлено на постконтрастном Т1-ВИ в режиме подавления сигнала от жира. Обратите внимание на более высокую интенсивность контрастного усиления сосудистых структур, области борозд правой височной доли по сравнению с таковым в левом полушарии.
(а) Состояние гиперперфузии головного мозга при эпилептическом статусе, развившееся у женщины 52 лет с мышечной слабостью в левой половине тела после продолжительного судорожного приступа, представлено на постконтрастном Т1-ВИ в режиме подавления сигнала от жира. Обратите внимание на более высокую интенсивность контрастного усиления сосудистых структур, области борозд правой височной доли по сравнению с таковым в левом полушарии.
(б) Перфузионная МРТ: у этой же пациентки определяется увеличение CBF в области правой височной доли, соответствующее повышению интенсивности контрастирования сосудистых структур, выявленное на постконтрастных Т1-ВИ.
д) Клиническая картина:
1. Проявления синдрома гиперперфузии головного мозга (СГГМ):
• Классическая триада: односторонняя головная боль, неврологический дефицит и судороги
• Другие признаки/симптомы:
о Вариабельные когнитивные нарушения о Боль в области лица, глазная боль
2. Демография:
• Возраст:
о При постэндартерэктомическом СГГМ, как правило, пожилой возраст
о При другой этиологии (например, судороги, синдром MELAS) возраст может быть любым
• Эпидемиология:
о У 3% пациентов после каротидной эндартерэктомии развивается легкий СГГМ
о Ковариация клинических факторов риска:
– Возраст
– Артериальная гипертензия (особенно послеоперационная)
– Диабет
– Двусторонние поражения
– Степень стеноза ВСА:
Высокая > низкая степень
– Наличие окклюзии или высокой степени стеноза контрлатеральной сонной артерии
– Длительность пережатия
– Пониженный каротидный резерв
– Плохой коллатеральный кровоток
– Снижение реактивности сосудов головного мозга в ответ на ацеталозамид
3. Течение и прогноз:
• Неотложное неврологическое состояние:
о При отсутствии своевременного/адекватного лечения возможен летальный исход или развитие тяжелой инвалидности
• При отсутствии внутричерепного кровоизлияния:
о Изменения обычно обратимы
о Значительного разрушения мозговой ткани не происходит
о Возможен исход в виде стойких легких когнитивных нарушений
• У 1 % пациентов с СГГМ развивается внутричерепное кровоизлияние:
о Неблагоприятный прогноз
4. Лечение:
• Предотвращение:
о Минимизация интраоперационной ишемии головного мозга
о Рассмотрите вопрос о продолжении анестезии/седации в послеоперационном периоде
о Строгий контроль артериального давления в послеоперационном периоде
е) Диагностическая памятка. Обратите внимание:
• У пациентов с неврологическим дефицитом, развившимся после КЭА/стентирования сонной артерии, необходимо проводить дифференциальный диагноз между инсультом/ТИА и СГГМ
ж) Список литературы:
- Cano EJ et al: Asymmetric brain edema after cardiac transplantation: cerebroautoregulatory failure and relative hyperperfusion. Transplant Proc. 47(1): 194-7, 2015
- Fujimura M et al: Quantitative analysis of early postoperative cerebral blood flow contributes to the prediction and diagnosis of cerebral hyperperfusion syndrome after revascularization surgery for moyamoya disease. Neurol Res. 37(2): 131-8, 2015
- Horie N et al: De novo ivy sign indicates postoperative hyperperfusion in moyamoya disease. Stroke. 45(5): 1488-91, 2014
- Rafiq MK et al: Cerebral hyperperfusion syndrome. Pract Neurol. 14(1):64-6, 2014
- Brantley HP et al: Hyperperfusion syndrome following carotid artery stenting: the largest single-operator series to date. J Invasive Cardiol. 21(1):27-30, 2009
- Grunwald IQ et al: Hyperperfusion syndrome after carotid stent angioplasty. Neuroradiology. 51(3)469-74, 2009
- Kuroda H et al: Prediction of cerebral hyperperfusion after carotid endarterectomy using middle cerebral artery signal intensity in preoperative single-slab 3-dimensional time-of-flight magnetic resonance angiography. Neurosurgery. 64(6): 1065-71; discussion 1071-2, 2009
- Medel R et al: Hyperperfusion syndrome following endovascular cerebral revascularization. Neurosurg Focus. 26(3): E4, 2009
- Moulakakis KG et al: Hyperperfusion syndrome after carotid revascularization. J VascSurg. 49(4)4060-8, 2009
- Tseng YC et al: Prediction of cerebral hyperperfusion syndrome after carotid stenting: a cerebral perfusion computed tomography study. J Comput Assist Tomogr. 33(4):540-5, 2009
- Hirooka R et al: Magnetic resonance imaging in patients with cerebral hyperperfusion and cognitive impairment after carotid endarterectomy. J Neurosurg. 108(6)4 178-83, 2008
- Fukuda T et al: Prediction of cerebral hyperperfusion after carotid endarterectomy using cerebral blood volume measured by perfusion-weighted MR imaging compared with single-photon emission CT. AJNR Am J Neuroradiol. 28(4):737—42, 2007
- Park KY et al: Cortical sulcal effacement on brain CT associated with cerebral hyperperfusion after carotid artery stenting. J Neurol Sci. 260(1—2):83—6, 2007
Редактор: Искандер Милевски. Дата публикации: 22.3.2019
Гиперперфузия и гипоперфузия головного мозга



- На здоровье!
- >
- Темы портала
- >
- Оздоровление
- >
- Заболевания
- >
- Гиперперфузия и гипоперфузия головного мозга
Гиперперфузия головного мозга
Редкое, но опасное осложнение —гиперперфузия головного мозга. Она возникает, когда в результате анатомических вариантов отхождения или случайной канюляции общей сонной артерии значительная часть крови, поступающей из артериальной канюли, направляется непосредственно в головной мозг.
Наиболее серьезное следствие такого осложнения — резкое повышение мозгового кровотока с развитием внутричерепной гипертензии, отека и разрыва капилляров мозга. При этом возможно развитие односторонних отореи, ринореи, отека лица, петехий, отека конъюнктивы.
Если гиперперфузия мозга вовремя не обнаружена и не начата активная терапия внутричерепной гипертензии, то это осложнение может привести больного к смерти (Оркин Ф. К. , 1985).
Гипоперфузия головного мозга
Уменьшение перфузионного давления до уровня ниже порога ауторегуляции (около 50 мм рт. ст. ) ассоциируется с низким мозговым кровотоком. Гипоперфузия играет важную роль не только в развитии фатальной диффузной энцефалопатии, основу которой составляют преимущественно некротические процессы в головном мозге, но и в формировании различных редуцированных форм энцефалопатии.
Клинически она проявляются от развития невыраженных послеоперационных расстройств в центральной и периферической нервных системах в виде изменения поведения, интеллектуальной дисфункции, эпилептических припадков, офтальмологических и других расстройств, до глобального церебрального повреждения с персистирующим вегетативным состоянием, неокортикальной смертью мозга, тотальной церебральной и стволовой смертью (Show P. J. , 1993).
Определение понятия “острая ишемия” пересмотрено.
Раньше острой ишемией считали лишь ухудшение доставки в орган артериальной крови при сохранении венозного оттока из органа.
В настоящее время (Биленко М. В. , 1989) под острой ишемией понимают резкое ухудшение (неполную ишемию) или полное прекращение (полную, тотальную ишемию) всех трех основных функций локального кровообращения:
- доставки в ткань кислорода,
- доставки в ткань субстратов окисления,
- удаления из ткани продуктов тканевого метаболизма.
Лишь нарушение всех процессов обусловливает тяжелый симптомокомплекс, приводящий к резкому повреждению морфофункциональных элементов органа, крайней степенью которого является их гибель.
Состояние гипоперфузии мозга также может быть связано с эмболическими процессами.
Пример. Больная У. , 40 лет, оперирована по поводу ревматического порока (рестеноза) митрального клапана, пристеночного тромба в левом предсердии. С техническими трудностями проведено протезирование митрального клапана дисковым протезом и удаление тромба из левого предсердия. Операция продолжалась 6 ч (длительность ЭКК — 313 мин, пережатия аорты — 122 мин). После операции больная — на ИВЛ. В послеоперационном периоде, кроме выраженных признаков тотальной сердечной недостаточности (АД — 70 — 90/40 — 60 мм рт. ст. , тахикардия до 140 в 1 мин, желудочковые экстрасистолы), развились признаки постишемической энцефалопатии (кома, периодические тонико-клонические судороги) и олигоурия. Через 4 ч после операции выявлен острый инфаркт миокарда заднебоковой стенки левого желудочка сердца. Спустя 25 ч после окончания операции, несмотря на вазопрессорную и кардиостимулирующую терапию, возникла гипотензия — до 30/0 мм рт. ст. с последующей остановкой сердца. Реанимационные мероприятия с 5-кратной дефибрилляцией успеха не имели.
На вскрытии: головной мозг массой 1400 г, извилины уплощены, борозды сглажены, на основании мозжечка — борозда от вклинения в большое затылочное отверстие. На разрезе ткань мозга влажная. В правом полушарии в области подкорковых ядер — киста размерами 1 х 0,5 х 0,2 см с серозным содержимым. Обнаружены двусторонний гидроторакс (слева — 450 мл, справа — 400 мл) и асцит (400 мл), выраженная гипертрофия всех отделов сердца (масса сердца 480 г, толщина миокарда стенки левого желудочка — 1,8 см, правого — 0,5 см, желудочковый индекс — 0,32), дилатация полостей сердца и признаки диффузного миокардитического кардиосклероза. В заднебоковой стенке левого желудочка — острый обширный (4 х 2 х 2 см) инфаркт миокарда с геморрагическим венчиком (давностью около 1 сут. ). Гистологически подтверждено наличие выраженного отека ствола головного мозга, венозного и капиллярного полнокровия, ишемических (вплоть до некротических) повреждений нейронов коры больших полушарий. Физико-химически — выраженная гипергидратация миокарда всех отделов сердца, скелетных мышц, легких, печени, таламуса и продолговатого мозга. В генезе инфарцирования миокарда у данной больной кроме атеросклеротического поражения венечных артерий имели значение длительные периоды оперативного вмешательства в целом и отдельных его этапов.
Хроническая ишемия мозга
Кафедра фундаментальной и клинической неврологии (зав. – член-корр. РАМН, проф. В.И.Скворцова) РГМУ, Москва
Х роническая ишемия мозга (ХИМ) – это медленно прогрессирующая недостаточность кровоснабжения мозга, приводящая к постепенному нарушению его функционирования. Исследователи, занимающиеся этой проблемой, наряду с ХИМ широко используют другие термины, определяя схожие состояния как: “хроническая недостаточность мозгового кровообращения”, “медленно прогрессирующая недостаточность мозгового кровообращения”, “ишемическая болезнь мозга”, “цереброваскулярная недостаточность” и т.п. В 1957 г. Г.А.Максудовым был предложен термин “дисциркуляторная энцефалопатия” (ДЭ), позже были описаны клинические стадии этого синдрома (Е.В.Шмидтом и соавт., 1976). Несмотря на отсутствие данного термина в МКБ-10, в отечественной неврологии наиболее часто используется именно эта формулировка для обозначения диффузной или многоочаговой дисфункции мозга, обусловленной хронической гипоперфузией церебральных структур (Н.Н.Яхно, И.В.Дамулин, В.В.Захаров, С.В.Котов, В.Я.Неретин и др.).
Как правило, данный процесс не является отражением изолированного поражения только церебральных сосудов. Имеется большое количество экстрацеребральных причин, приводящих к патологии мозгового кровообращения. Прежде всего это заболевания, сопровождающиеся расстройством системной гемодинамики, приводящие к хроническому недополучению мозгом адекватного кровоснабжения – хронической гипоперфузии мозга. Первые три позиции среди причин, приводящих к хронической гипоперфузии мозга, занимают: артериальная гипертония (АГ), атеросклеротическое поражение сосудов, заболевания сердца, сопровождающиеся хронической сердечной недостаточностью.
Связи между нарушением функции мозга и сердца двусторонние. Снижение сердечного выброса, нарушение сократительной функции сердца вызывают ухудшение церебрального кровотока, способствуя формированию или утяжелению проявлений ХИМ. С другой стороны, гипоксия и ишемия мозга приводят к нарушению центральных вегетативных механизмов регуляции кровообращения, что усугубляет течение сердечной патологии (Л.О.Бадалян, 1975; О.А.Амелина и соавт., 2006; В.Г.Помников и соавт., 2006).
Для адекватной работы мозга необходим высокий уровень перфузии. Головной мозг, масса которого составляет 2–2,5% от массы тела, потребляет 15–20% циркулирующей в организме крови. Основным показателем перфузии мозга является уровень кровотока на 100 г вещества мозга в 1 мин. Среднее значение полушарного мозгового кровотока (МК) приблизительно 50 мл/100 г/мин, но имеются существенные различия в кровоснабжении отдельных структур мозга. Величина МК в сером веществе в 3–4 раза выше, чем в белом (W.Powers, 1992). При этом в передних отделах полушарий кровоток выше, чем в остальных областях мозга. С возрастом величина МК снижается, исчезает и фронтальная гиперперфузия, что объясняют диффузными атеросклеротическими изменениями (Н.В. Верещагин и соавт., 1993). Известно, что при ХИМ в большей степени страдают субкортикальное белое вещество и лобные структуры, что, возможно, объясняется указанными особенностями кровоснабжения мозга.
МК зависит от перфузионного давления (ПД) в магистральных артериях головы (МАГ) и сопротивления мозговых сосудов. ПД – это разница между артериальным давлением (АД), обеспечивающим продвижение крови, и венозным давлением, осуществляющим ее отток. Таким образом, МК может страдать не только при поражении МАГ, но и при нарушениях системной гемодинамики, которая в свою очередь определяется состоянием сердца и экстракраниальных сосудов.
Регуляция МК, обеспечивающая метаболические потребности мозга, при отсутствии препятствий кровотоку в питающих мозг артериях и достаточном минутном объеме сердца осуществляется за счет изменения просвета внутримозговых сосудов. При небольшом снижении ПД происходит компенсаторное расширение сосудов мозга и кровоток поддерживается посредством уменьшения сопротивления мозговых сосудов, как крупных, так и мелких (J.Miller, B.Bell, 1987). Дальнейшее падение перфузии приводит к снижению МК.
В условиях хронической гипоперфузии мозга, которая является основным патогенетическим звеном ХИМ, механизмы компенсации могут истощаться, энергетическое обеспечение мозга становится недостаточным, в результате сначала развиваются функциональные расстройства, а затем и необратимое морфологическое повреждение. При хронической гипоперфузии мозга выявляют: замедление МК, уменьшение содержания кислорода и глюкозы в крови, сдвиг метаболизма глюкозы в сторону анаэробного гликолиза, лактат-ацидоз, гиперосмолярность, капиллярный стаз, склонность к тромбообразованию, деполяризация клеток и клеточных мембран, активация микроглии, которая начинает вырабатывать нейротоксины, что наряду с другими патофизиологическими процессами приводит к гибели клеток (Ш.Хорват 2004; W.Powers, 1992). В то же время авторы отмечает, что улучшение МК, ликвидация гипоксии, оптимизация метаболизма могут уменьшить выраженность нарушения функций и способствовать сохранению мозговой ткани. В связи с этим весьма актуальным является своевременная диагностика ХИМ и адекватное лечение.
МК и АГ
Для осуществления ауторегуляции мозгового кровообращения необходимо поддержание определенных значений АД в МАГ. В среднем систолическое АД (САД) в магистральных артериях головы должно находиться в пределах от 60 до 150 мм рт. ст. При длительно существующей АГ эти пределы несколько смещаются вверх, поэтому достаточно долго не наступает нарушение ауторегуляции и МК остается на нормальном уровне. Адекватная перфузия мозга поддерживается при этом повышением сосудистого сопротивления, что в свою очередь приводит к нарастанию нагрузки на сердце. Показано, что по мере утяжеления гипертонии отмечается увеличение числа пациентов с нарушением диастолической функции левого желудочка, что сопровождается ухудшением мозгового кровообращения (В.В.Машин и соавт., 2006).
Предполагается, что адекватный уровень МК возможен до тех пор, пока не наступят выраженные изменения мелких внутримозговых сосудов, с формированием лакунарного состояния, свойственного гипертонии (Н.В.Верещагин и соавт., 1993). Следовательно, существует определенный запас времени, когда своевременное лечение АГ может предотвратить образование необратимых изменений в сосудах и мозге или уменьшить степень их выраженности. Изменения стенок артерий сопровождаются развитием микроаневризм, которые могут разрываться в момент гипертонического криза, приводя к тяжелейшему осложнению АГ – геморрагическому инсульту (Н.В.Верещагин и соавт., 1997). Если в основе ХИМ лежит только АГ, то правомерно употребление термина “гипертоническая энцефалопатия”. Большое значение в ее формировании имеют изменения венозной системы головного мозга, которые подтверждаются морфологическими и ультразвуковыми методами исследования (Л.А.Белова, В.В.Машин, 2006) и определяют особенности клинических проявлений. Авторы указывают на такие симптомы, свидетельствующие о нарушении венозного оттока, как утренние головные боли, отечность век, пастозность лица. Кроме того, тяжелые гипертонические кризы – это всегда срыв ауторегуляции с развитием острой гипертонической энцефалопатии, которая всякий раз усугубляет явления ХИМ.
МК и атеросклеротическое поражение сосудов
Атеросклеротическое (АС) поражение сосудов мозга бывает, как правило, множественным, локализуясь в экстра- и интракраниальных отделах сонных и позвоночных артерий, а также в артериях, формирующих виллизиев круг, и в их ветвях. АС-стенозы развиваются обычно в начальных отрезках внутренней сонной артерии и в области бифуркации общей сонной артерии. Данная локализация стенозов позволяет услышать систолический шум при аускультации сосудов шеи.
Стенозы делят на гемодинамически значимые и незначимые. Если дистальнее АС-процесса возникает снижение ПД, то это свидетельствует о критическом или гемодинамически значимом сужении сосуда. Многочисленными исследованиями показано, что гемодинамически значимые стенозы развиваются при сужении просвета сосуда на 70–75%. Но МК зависит не только от выраженности стеноза, а также в не меньшей степени от механизмов, предотвращающих развитие ишемии: состояния коллатерального кровообращения, способности мозговых сосудов к расширению. Указанные гемодинамические резервы мозга позволяют существовать “асимптомным” стенозам без наличия жалоб и клинических проявлений. Однако обязательное развитие при стенозе хронической гипоперфузии мозга приводит к ХИМ, которая выявляется при магнитно-резонансной томографии (МРТ). На МРТ визуализируются перивентрикулярный лейкоареоз, отражающий ишемию белого вещества мозга; внутренняя и наружная гидроцефалия, обусловленная атрофией мозговой ткани; могут выявляться кисты как последствия перенесенных инфарктов мозга, в том числе и клинически “немых”. Считается, что ХИМ имеется у 80% пациентов со стенозирующим поражением МАГ. Очевидно, этот показатель может достигнуть и абсолютной величины, если для выявления ХИМ проводить по предложению Е.С.Кипарисова и В.А.Кузьменко (2006 г.) массовое скрининг-обследование с применением нейровизуализации (МРТ) и нейропсихологического тестирования. Для АС-сосудов головного мозга характерны не только локальные изменения в виде бляшек, но и гемодинамическая перестройка артерий на участке дистальнее атеросклеротических стенозов и окклюзий – эшелонированное АС-поражение мозга. Все это будет приводить к тому, что “асимптомные” стенозы становятся клинически значимыми.
Большое значение имеет и структура бляшек. Так называемые нестабильные бляшки приводят к развитию артерио-артериальных эмболий и острых нарушений мозгового кровообращения, чаще по типу преходящих. При кровоизлиянии в такую бляшку быстро увеличивается ее объем с нарастанием степени стеноза и усугублением признаков ХИМ. При наличии подобных бляшек гемодинамически значимым будет перекрытие просвета сосуда менее чем на 70%. Пациенты с гемодинамически значимыми стенозами, выявляемыми ультразвуковыми методами исследования, должны направляться на консультацию к ангиохирургу для решения вопроса об оперативном восстановлении кровотока по МАГ.
При наличии поражения МАГ МК становится очень зависимым от системных гемодинамических процессов. Особенно чувствительны такие пациенты к артериальной гипотонии, которая может возникнуть при переходе в вертикальное положение (ортостатическая гипотония), при нарушениях сердечного ритма, приводящих к кратковременному снижению сердечного выброса. У больных с окклюзией внутренней сонной артерии даже такое небольшое изменение может привести к падениию ПД и нарастанию ишемических расстройств в головном мозге.
В клинической практике часто встречается сочетание сосудистого поражения мозга, сердца, аорты и других сосудов. Н.М.Поташова и соавт. (2006 г.) выявили каротидный АС почти у половины (47,8%) пациентов с доказанным коронарным АС. При этом гемодинамически значимые стенозы и/или окклюзии имели место у каждого шестого пациента этой группы. В.В.Ахметов и соавт. (2006 г.) при обследовании брахиоцефальных артерий у пациентов, находившихся на лечении по поводу ишемии ног и не предъявлявших “церебральных” жалоб, выявили гомогенные бляшки со стенозом более 75%.
В литературе имеется указание на большое количество заболеваний сердца, приводящих или сочетающихся с ХИМ: ИБС, стенокардия напряжения, инфаркт миокарда, постинфарктный кардиосклероз, стеноз коронарных артерий, фибрилляции предсердий, мерцательная аритмия и другие нарушения ритма, врожденные и приобретенные пороки сердца, хроническая сердечная недостаточность. По данным О.А.Амелиной и соавт. (2006 г.), у больных с сердечной недостаточностью признаки нарушения кровоснабжения головного мозга обусловлены снижением сократительной функции миокарда, что приводит к снижению МК.
Клинические проявления ХИМ
Основными клиническими проявлениями ХИМ являются нарушения в эмоциональной сфере, двигательные расстройства, ухудшение памяти и способности к обучению, постепенно приводящие к дезадаптации больных (Н.Н.Яхно, 2004; Ш.Хорват, 2004; В.В.Захаров, 2005; И.А.Челышева, Н.С.Нагорный, 2005; И.В.Дамулин и соавт., 2006).
В настоящее время считается необоснованным выделение такого синдрома, как “начальные проявления недостаточности кровоснабжения мозга”, учитывая неспецифичность предъявляемых жалоб астенического круга: головная боль, головокружение (несистемного характера), снижение памяти, нарушение сна, шум в голове, звон в ушах, нечеткость зрения, общая слабость, повышенная утомляемость, снижение работоспособности, эмоциональная лабильность – и частую гипердиагностику сосудистого генеза указанных нарушений. При подтверждении же сосудистого генеза астенического синдрома с помощью дополнительных методов исследования (УЗИ сосудов мозга, РЭГ, ЭКГ, офтальмоскопии, изучения реологических свойств и липидного спектра крови, МРТ) следует устанавливать 1-ю стадию ДЭ (И.В.Дамулин).
В последнее время большое внимание уделяется нейропсихологическому тестированию пациентов с ДЭ. Уже на 1-й стадии ДЭ выявляются легкие когнитивные расстройства в виде замедления и инертности
интеллектуальной деятельности, уменьшения объема оперативной памяти. При исследовании неврологического статуса может выявляться диффузная микроочаговая симптоматика: сухожильная анизорефлексия, недостаточность конвергенции, негрубые рефлексы орального автоматизма, легкие изменения походки и неуверенность при выполнении координаторных проб.
ДЭ 2-й стадии характеризуется нарастанием неврологической симптоматики с формированием негрубо выраженного одного или нескольких синдромов. Отмечаются умеренные когнитивные расстройства, отдельные экстрапирамидные нарушения, неполный псевдобульбарный синдром, атаксические проявления. На этой стадии могут обнаруживаться признаки снижения профессиональной и социальной адаптации. Жалобы, отражающие субъективный дискомфорт, становятся менее выраженными или неактуальными для больного.
ДЭ 3-й стадии определяется наличием одного или нескольких неврологических синдромов, снижением критики к своему состоянию, нарастанием дезадаптации, не только социальной и профессиональной, но и в повседневной жизни. Наиболее часто при ДЭ наблюдаются вестибуломозжечковый, пирамидный, амиостатический, псевдобульбарный, психоорганический синдромы, а также их сочетания.
При вестибуломозжечковом синдроме субъективные жалобы на головокружение и неустойчивость при ходьбе сочетаются с нистагмом и координаторными нарушениями. Расстройства могут быть обусловлены как мозжечково-стволовой дисфункцией вследствие недостаточности кровообращения в вертебрально-базилярной системе, так и разобщением лобно-стволовых путей при диффузном поражении белого вещества больших полушарий мозга из-за нарушения МК в системе внутренней сонной артерии.
Пирамидный синдром при ДЭ характеризуется высокими сухожильными и положительными патологическими рефлексами, нередко асимметричными. Парезы нерезко выражены либо отсутствуют, наличие их указывает на перенесенный ранее инсульт.
Амиостатический или паркинсонический синдром в рамках ДЭ представлен замедленными движениями, гипомимией, сложностью начала движений, негрубой мышечной ригидностью, чаще в ногах, с феноменом “противодействия”, когда сопротивление мышц непроизвольно нарастает при совершении пассивных движений. Тремор, как правило, отсутствует. Возникновение этого синдрома при ХИМ обусловлено не поражением подкорковых ганглиев, а корково-стриарных и корково-стволовых связей. В связи с этим лечение препаратами леводопы не приносит существенного улучшения данному контингенту больных.
Нарушения движений при ХИМ обусловлены сочетанием пирамидной, экстрапирамидной, мозжечковой недостаточности и нарушениями центрального механизма управления двигательными актами. Выраженные расстройства ходьбы и равновесия лобно-подкоркового типа, с частыми эпизодами внезапного падения, обусловлены нарушениями взаимодействия относительно сохранных структур мозга, ответственных за движения и равновесие при ходьбе. На начальных стадиях ДЭ, когда страдают не все системы, обеспечивающие двигательную активность, развиваются компенсаторные и адаптивные изменения походки. По мере прогрессирования ХИМ эффективность компенсаторных механизмов становится недостаточной (И.В.Дамулин и соавт., 2005). Все это определяет необходимость своевременного и адекватного лечения ХИМ.
Псевдобульбарный синдром, морфологической основой которого является двустороннее поражение корково-нуклеарных путей, часто наблюдается при ХИМ. В данный симптомокомплекс входят дизартрия, дисфагия, дисфония, эпизоды насильственного плача или смеха и рефлексы орального автоматизма.
Психоорганический синдром проявляется выраженными когнитивными расстройствами, вплоть до развития сосудистой деменции. Если ХИМ сформировалась на фоне длительно не контролируемой АГ, то в патогенезе деменции принимают участие вторичные нейродегенеративные изменения по типу болезни Альцгеймера, что значительно усугубляет расстройства памяти. В таких случаях диагностируется смешанная сосудисто-дегенеративная деменция.
Память является самой уязвимой психической функцией и страдает при всех стадиях ДЭ. Вначале нарушается произвольное воспроизведение – снижение возможности удержания материала в памяти. На ранних стадиях пациенты способны осознавать ухудшение памяти и включать механизмы компенсации – перестраивая свою повседневную деятельность. При прогрессировании ХИМ изменения памяти становятся более явными, но менее осознанными больным (обратная зависимость между жалобами и объективными расстройствами памяти). При распаде интеллектуальных навыков, свойственных деменции, возникают затруднения в понимании инструкций, решении новых задач (И.А.Челышева, Н.С.Нагорный, 2005).
Основные принципы лечения больных с ХИМ
Основные направления в лечении ХИМ вытекают из этиопатогенетических механизмов, приведших к данному процессу. Первоосновой является восстановление или улучшение перфузии мозга, что напрямую связано с лечением основного заболевания: АГ, атеросклероза, заболеваний сердца с устранением сердечной недостаточности. При окклюзионно-стенозирующем поражении МАГ целесообразным является постановка вопроса о хирургическом устранении нарушения проходимости сосудов.
Антиагрегантные препараты
Известно, что ишемические нарушения сопровождаются активацией тромбоцитарно-сосудистого звена гемостаза, что определяет обязательный прием антиагрегантных препаратов. В настоящее время наиболее хорошо изучена и доказана эффективность аспирина (ацетилсалициловая кислота). Применяются преимущественно кишечно-растворимые формы (тромбо АСС и др.) в дозе 75–100 мг (1 мг/кг) ежедневно. При необходимости к лечению добавляют другие антиагреганты (дипиридамол, клопидогрел). Назначение препаратов данной группы снижает на 20–25% риск развития таких острых состояний, как инфаркт миокарда, ишемический инсульт, тромбозы периферических сосудов (В.В.Захаров, 2005).
NSICU.RU neurosurgical intensive care unit
сайт отделения реанимации НИИ им Н.Н. Бурденко
Курсы повышения квалификации

Асинхронии и графика ИВЛ

Водно-электролитные
нарушения
в нейрореанимации

Книга «Основы ИВЛ»

Рекомендации
по интенсивной терапии
у пациентов
с нейрохирургической патологией
Статьи → Мониторинг церебрального перфузионного давления в интенсивной терапии
НИИ Нейрохирургии Бурденко, РАМН, Москва
Введение
Общеизвестно, что церебральное перфузионное давление (ЦПД) определяется как разница между средним артериальным (САД) и средним внутричерепным давлениями (ВЧД): ЦПД = САД – ВЧД и измеряется в миллиметрах ртутного столба (мм рт.ст.).
Очень часто клиницисты путают понятия ЦПД и перфузия головного мозга. Что же такое перфузия и почему давление называется перфузионным?
Перфузия – это процесс прохождение крови через ткань или орган. Перфузию оценивают как отношение потока жидкости сквозь ткань к массе этой ткани. В нашем случае перфузия – это отношение объемного мозгового кровотока к массе мозгового вещества. Она измеряется в миллилитрах крови на 100 гр. ткани в минуту (мл/ 100 г/ мин). Усредненный объемный мозговой кровоток в физиологических условиях приблизительно равен 50 мл/100г/мин. Существуют региональные отличия для серого и белого вещества мозга, которые варьируют от 70 до 20 мл/100г/мин., соответственно. Нижние границы мозгового кровотока, при которых развиваются гипоперфузия и церебральная ишемия, хорошо изучены и установлены в экспериментальных работах: мозговой кровоток менее 30мл/100г/мин вызывает развитие неврологической симптоматики и изменение функциональной активности нейронов; при снижении до 15-20 мл/100 г/мин развиваются обратимые нарушения на уровне дисфункции мембран нейронов; при снижении кровотока менее 10-15 мл/100г/мин развивается необратимые нейрональное повреждение и гибель нейронов [1;9;10;32]. Однако, следует помнить, что развитие деструктивных морфологических изменений в мозговой ткани зависит не только от степени, но и от длительности ишемии [11;32].
В гидродинамике, как и в электродинамике для расчета силы тока (жидкости или электричества) используется закон Ома I=U/R. В электродинамике – это отношение напряжения или разности потенциалов к сопротивлению, а в гидродинамике – это отношение разности давлений в начале и конце трубки, или системы трубок, к сопротивлению. Таким образом, объемная скорость жидкости прямо пропорциональна разнице давлений и обратно пропорциональна гидродинамическому сопротивлению. Разность давлений, или градиент давлений, создающий поток крови через ткань и называют перфузионным давлением. В тканях организма перфузионное давление определяется градиентом давлений между артериальным и венозным руслом. В клинической практике мы используем ЦПД, как суррогатный показатель перфузии мозга, в виду отсутствия других доступных методов измерения. В соответствии с законом Ома перфузия мозга, или объемный мозговой кровоток, описывается формулой CBF = СРР / CVR, где CBF- объемный кровоток, СРР – церебральное перфузионное давление, CVR- сопротивление церебральных сосудов [2; 9].
Измерение ЦПД.
В нормальных физиологических условиях ВЧД близко к давлению венозных синусах мозга, поэтому ЦПД при нормальном состоянии приравнивается артерио-венозному градиенту. При патологических состояниях мозга сопровождающихся повышенным давлением в полости черепа: отеке мозга, нарушении циркуляции ликвора, появлении патологического масс-эффекта – происходит компрессия вен в местах впадения в синусы мозга. Все это приводит к нарушению венозного оттока и, в конечном счете, способствует дальнейшему росту ВЧД. При этом ВЧД значительно превосходит давление в венозных синусах мозга. В создавшихся условиях перфузия ткани мозга будет зависеть от градиента между САД и ВЧД.
Измерение ЦПД возможно при условии измерения артериального и внутричерепного давления. В условиях отделений нейроинтенсивной терапии данные измерения проводятся прикроватного, инвазивно и в непрерывном режиме. Общеизвестно, что для расчета ЦПД используют среднее артериальное давление (САД). Установлено, что САД определяет перфузию тканей организма и остается относительно неизменным на всем протяжении артериального русла [6;42]. Для правильного измерения ЦПД при горизонтальном положении тела датчик измерения инвазивного АД должен располагаться на уровне левого предсердия. При положении тела с приподнятым головным концом датчик должен размещаться на уровне наружного слухового прохода. Так обеспечивается положение датчика на уровне Виллизиева круга сосудов головного мозга, что гарантирует более точное измерение ЦПД [3;41]. Если в положении приподнятого головного конца под углом 15-450 расположить датчик инвазивного артериального давления на уровне левого предсердия, то может происходить искусственное завышение ЦПД на 10-20 мм рт.ст. так как свой вклад будет вносить возросший уровень гидростатического давления. Неправильное измерение ЦПД может влиять на принятие решения о терапии, затруднять своевременную диагностику гипо- и гиперперфузии мозга и, как следствие, ухудшать исходы заболевания [41].
ЦПД и ауторегуляция мозгового кровотока.
Закон Ома позволяет считать ЦПД суррогатным маркером мозгового кровотока [2;9]. Другим не менее значимым фактором, определяющим интенсивность объёмного мозгового кровотока, является сопротивление церебральных сосудов. В норме, у здорового человека работают механизмы ауторегуляции тонуса мозговых сосудов. В соответствии с уравнением Ома, ауторегуляция обеспечивает адекватное сопротивление мозговых сосудов в ответ на изменения ЦПД и, тем самым, поддерживает постоянство объемного кровотока, отвечая метаболическим потребностям мозга [1; 2; 9]. Ауторегуляция тонуса мозговых сосудов – сложный многокомпонентный физиологический механизм регуляции тонуса мозговых сосудов, обеспечивающий адекватность церебрального кровотока, оксигенации и метаболизма. В основе ауторегуляции лежит способность гладкомышечных клеток регионарных сосудов к повышению сократительной активности при увеличении растяжения сосудов под действием перфузионного давления или к ее уменьшению при ослаблении растяжения в условиях снижения перфузионного давления. Основные компоненты ауторегуляции мозговых сосудов – это миогенный, гуморальный, метаболический, нейрогенный, эндотелиальный [1;2;4;5;9].
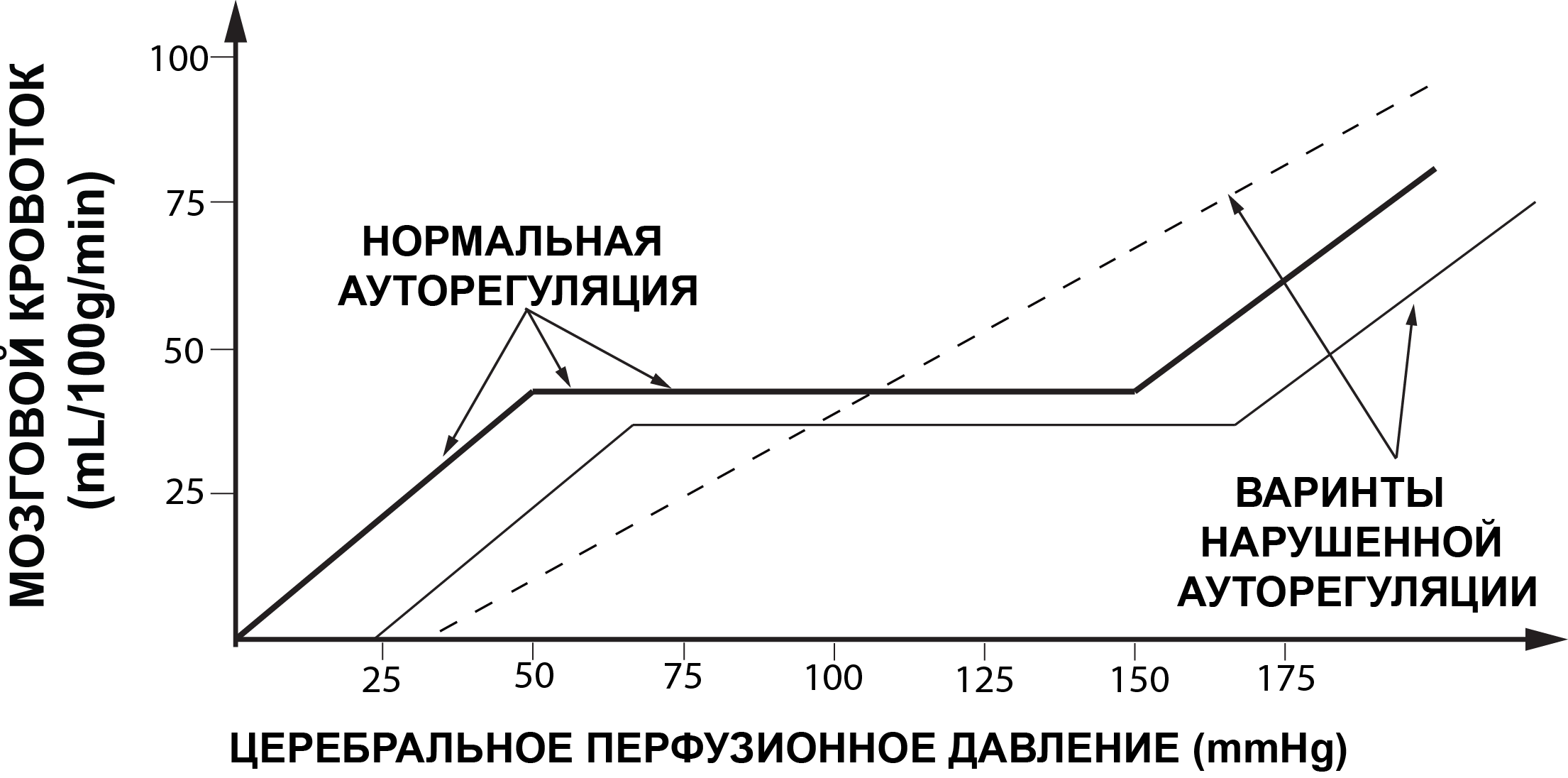
При нормальных физиологических условиях границы ЦПД (Рис. 1) здорового человека лежат в пределах от 50 до 150мм рт.ст.[43]. В пределах указанных границ ЦПД обеспечивается постоянный адекватный объемный мозговой кровоток. Снижение ЦПД ниже 50 мм рт.ст. может приводить к ишемии мозга, а повышение ЦПД выше 150 мм рт.ст. – к гиперемии мозга (Рис. 2).
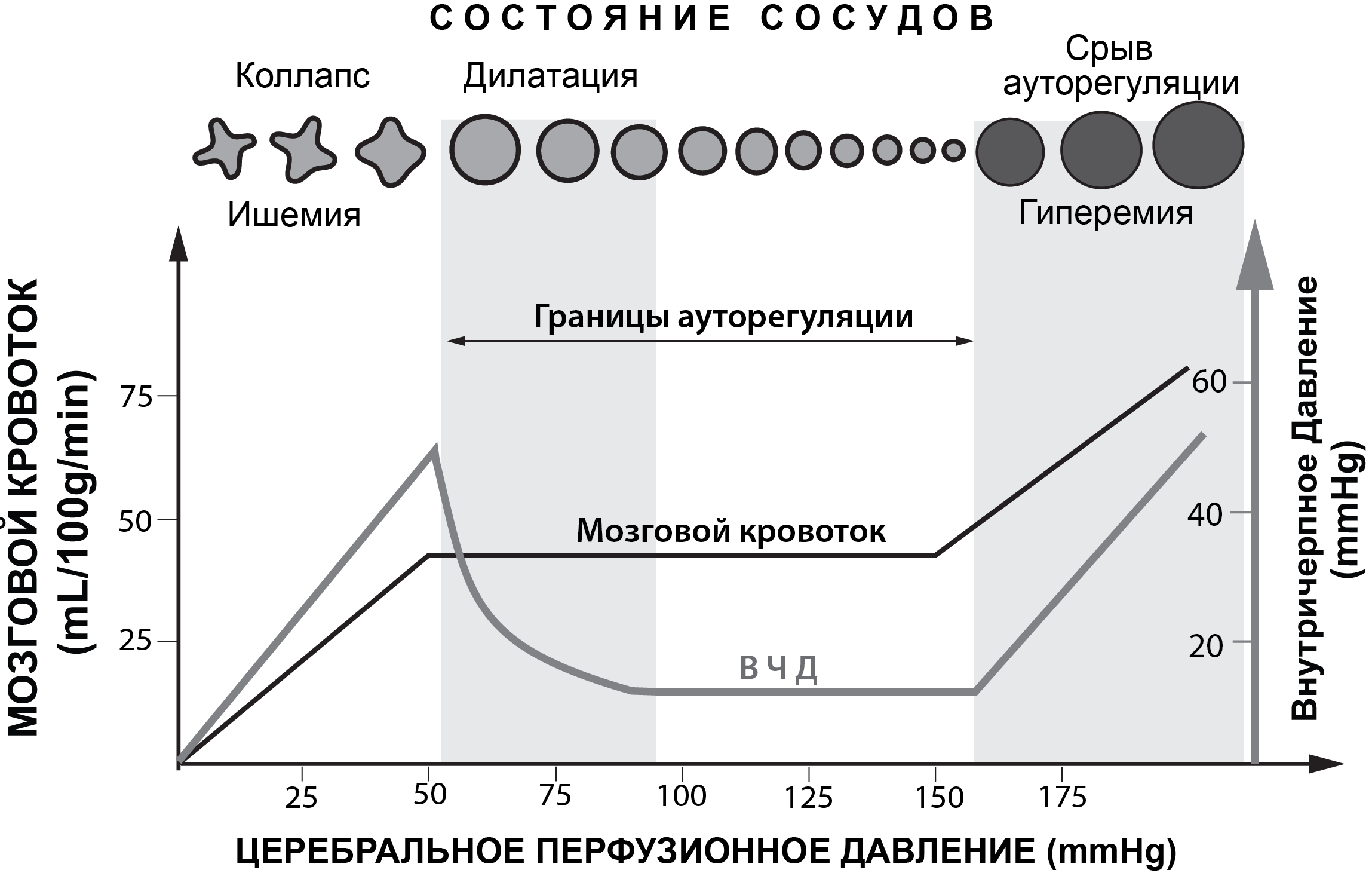
При различных патологических состояниях головного мозга (ЧМТ, САК, ОНМК) ауторегуляция мозговых сосудов может нарушаться. Это означает, что резистивные сосуды плохо обеспечивают постоянство объемного кровотока на фоне изменяющегося АД, изменения газового состава ткани мозга и крови и т.д. В этих патологических условиях мозговой кровоток напрямую зависит от значения ЦПД.
Контроль и обеспечение ЦПД при ЧМТ.
Церебральная ишемия, развивающаяся в остром периоде ЧМТ, остается одним из важных факторов вторичного повреждения мозга, который определяет исход травмы [25;38]. Поддержание церебрального перфузионного давления (ЦПД) у пострадавших с ЧМТ является общепризнанным методом предупреждения развития вторичной ишемии мозга. Согласно данным мировой литературы, ЦПД является независимым прогностическим критерием исхода при ЧМТ [18;37]. Основной причиной снижения церебральной перфузии при ЧМТ является артериальная гипотония. Устранение причин гипоперфузии введено в стандарт оказания первой помощи пострадавших с ЧМТ[29]. Подходы к контролю и обеспечению ЦПД претерпевали изменения, начиная с внедрения первых протоколов лечения пострадавших с ЧМТ. В 60-70-х годах, когда был внедрен мониторинг ВЧД по методу Lunberg, измерению ЦПД не предавалось должного внимания. Основной задачей при ведении пострадавших с ЧМТ считалась коррекция ВЧД. Самый ранний ВЧД-протокол включал в себя такие терапевтические опции, как наружное вентрикулярное дренирование ликвора, гипервентиляцию, использование седативных препаратов, релаксантов, гиперосмолярных растворов и декомпрессивной трепанации [29;36;37;38].
В середине 80-х годов появилась новая концепция ведения пациентов с травматическим поражением головного мозга. В основе концепции, предложенной Rosner et al., лежал каскад вазодилатации и вазоконстрикции. Данная концепция послужила развитию нового направления терапии пострадавших с травматическим поражением головного мозга, а именно, ЦПД-протоколу [48;49;50;51]. По мнению Rosner et al., при ЧМТ границы ауторегуляции мозговых сосудов «смещаются вправо» к более высоким значениям ЦПД. Суть концепции заключается в том, что не зависимо от причин, приводящих к снижению ЦПД, это всегда приводит к вазодилатации мозговых сосудов и увеличению объемного кровотока (внутричерепного содержания крови). Это в свою очередь вызывает повышение ВЧД, что закономерно приводит к дальнейшему снижению ЦПД и, таким образом, причинно-следственный каскад замыкается и повторяется вновь и вновь, приводя к ишемическому повреждение головного мозга. Для разрыва данного патологического круга достаточно повысить перфузионное давление, что приведет к вазоконстрикции мозговых сосудов, уменьшению объемного кровотока и снижению ВЧД. Согласно концепции авторов, для обеспечения адекватного мозгового кровотока и контроля над ВЧД, необходимо поддерживать более высокие значения ЦПД. В дальнейшем ЦПД – протокол был включен в первое международное руководство по ведению ЧМТ и сводился к поддержанию ЦПД выше 70 мм рт.ст. Поддержание ЦПД обеспечивалось инфузионной терапией и введением катехоламинов. Внедрение ЦПД-протокола обеспечило снижение летальности в группе пострадавших с тяжелой ЧМТ с 50% до 35-26% [36;49;55]. Интересно отметить, что с момента внедрения первого ЦПД – протокола и по сегодняшний день произошел пересмотр границ безопасного ЦПД (Таблица №1).

Если на ранних этапах развития делался акцент только на нижние границы допустимого ЦПД, ниже которого считалось нельзя допускать снижения ЦПД из-за риска развития церебральной ишемии, то в настоящее время обсуждается и необоснованность агрессивного обеспечения высоких значений ЦПД. Это обусловлено риском развития различных интра – и экстракраниальных осложнений [15;19].
Альтернативным протоколом по значению безопасного уровня ЦПД является протокол Лунд. Данный протокол, ориентирован на контроль ВЧД. Основной целью протокола является управление внутричерепными объемами за счет снижения транскаппилярной фильтрации, обеспечения целостности гемато-энцефалического барьера, снижения метаболизма мозга, нормализации тонуса прекаппилярных артериол, поддержания коллоидно-онкотического давления. Согласно концепции, высокое АД и повышенное ЦПД являются потенциально опасными, так как провоцируют отек мозга за счет усиления транскаппилярной фильтрации. Терапия ориентирована на снижение АД и понижение ЦПД до 50 мм рт.ст. Обеспечение безопасного уровня ЦПД авторы подтверждали с помощью церебрального микродиализа, контролируя уровень метаболизма мозга [21;26;27]. Разработчики Лунд-протокола утверждали, что он обеспечивает снижение летальности (до 8%) и увеличивает количество благоприятных исходов (до 80%)[21].
Итак, Лунд-протокол был ориентирован на снижение ВЧД 50 мм рт.ст., а другой >70 мм рт.ст. В группе с ЦПД выше 70 мм рт.ст. значительно меньше было эпизодов церебральной ишемии, но при этом не было улучшения исходов заболевания. Авторы связали это с возросшим числом соматических осложнений, чаще в виде респираторного дистресс-синдрома [46].
Таким образом, не было подтверждено преимущество стратегии и положительного эффекта на исходы заболевания при агрессивном обеспечении ЦПД. По результатам этого и ряда других исследований были внесены поправки к существующим рекомендациям по обеспечению ЦПД. Важно отметить, что впервые был ограничен верхний предел ЦПД. Так, согласно последней редакции Guidelines [29], для большинства пострадавших с ЧМТ границы ЦПД должно находиться в пределах 50-70 мм рт.ст. У пострадавших с сохранной ауторегуляцией допускается ЦПД выше 70 мм рт.ст. [29]. ЦПД у пациентов с острым нарушением мозгового кровообращения по ишемическому типу (ОНМК).
Данных о динамике ЦПД и его прогностической значимости у пациентов с ОНМК в литературе практически не встречается. Основной причиной этого является низкая частота встречаемости жизненно угрожающего отека мозга с развитием дислокации. По данным литературы, одно из самых грозных осложнений в виде злокачественного отека при ОНМК в бассейне средней мозговой артерии (СМА) встречается в 10% случаев от всех ишемических инсультов [7;30]. Отсюда следует, что показания для мониторинга ВЧД и ЦПД возникают у этих больных нечасто. В публикациях посвященных интенсивной терапии пациентов с ОНМК неоднократно обсуждался вопрос об адекватности и пользе измерения ВЧД и ЦПД. Так сообщалось, что при полушарных инсультах отрицательная неврологическая симптоматика в виде нарушения сознания, развития гемипареза, афазии, анизокарии, могла развиваться на фоне нормальных значений ВЧД. Ряд авторов достаточно скептически относятся к целесообразности измерения ВЧД и ЦПД при ОНМК и считают, что на данные параметры нельзя ориентироваться при определении лечебной тактики [23;52]. При развитии обширного инфаркта мозга летальность среди пациентов достигала 70-80% даже на фоне мониторинга ВЧД/ЦПД и использовании всего арсенала средств интенсивной терапии: гипервентиляции, седативных препаратов, гиперосмолярных растворов и др. [13;30]. Мета-анализ, проведенный Vahedi et al., на основании трех многоцентровых рандомизированных контролируемых исследований посвященных декомпрессивной трепанации при полушарных инсультах показал, что активная нейрохирургическая тактика снижает летальность и улучшает функциональный исход [54]. Наряду с этим, было сделано важное заключение, что мониторинг ВЧД не влиял на принятие решения о декомпрессивной трепанации. Было так же установлено, что дислокация мозга и неврологическое ухудшение могли развиваться на фоне нормальных значений ВЧД и ЦПД. Таким образом, была показана низкая чувствительность ВЧД мониторинга при выявлении дислокации на фоне ОНМК [54]. В современных рекомендациях по ведению пациентов с ишемическим инсультом основным параметром, обеспечивающим адекватность церебральной гемодинамики, принято считать АД. Артериальная гипотензия при ОНМК встречается редко [17;34]. Установлено, что критическими значениями при ОНМК является АД 100/70 мм рт.ст. [17].
Церебральная гипоперфузия это
Изобретение относится к медицине, а именно к эндоваскулярной хирургии, и может быть использовано при стентировании каротидных артерий у пациентов со стенозирующим поражением сонных артерий, обусловленным высоким риском развития синдрома церебральной гиперперфузии.
Одной из важных проблем неврологии является лечение пациентов с нарушением мозгового кровообращения, это обусловлено высоким уровнем заболеваемости, и в первую очередь такого грозного заболевания, как ишемический инсульт. Смертность от острого нарушения мозгового кровообращения (ОНМК) в экономически развитых странах колеблется в пределах 12-29%, уступая лишь смертности от заболеваний сердца и злокачественных опухолей. Среди основных причин ишемического инсульта – экстракраниальные атеросклеротические поражения брахиоцефальных артерий (БЦА) достигают 70%, а интракраниальный атеросклероз – 8-9%. Доказано, что использование хирургических методов лечения атеросклероза БЦА достоверно снижает риск ОНМК и улучшает прогноз у этих пациентов. Все более широкое распространение получает эндоваскулярный метод лечения атеросклеротических поражений БЦА – стентирование. Исходы этих операций в настоящее время не уступают каротидной эндартерэктомии (КЭ), а при поражении позвоночных артерий (ПА), интракраниальных отделов БЦА, а также перед коронарным шунтированием имеют достоверное преимущество перед открытыми вмешательствами [Ю.Л. Шевченко, Н.В. Боломатов, А.Г. Виллер, «Осложнения после стентирования артерий дуги аорты (Обзор литературы)», Международный журнал интервенционной кардиоангиологии, №41 – 2015, С – 57].
В настоящее время одним из тяжелых операционных и послеоперационных осложнений считается синдром церебральной гиперперфузии.
Синдром церебральной гиперперфузии (СЦГП), или гиперперфузионный синдром (ГПС), представляет собой серьезное осложнение реваскуляризирующих вмешательств на сонных артериях, проявляющееся значительным повышением кровотока в зоне каротидного бассейна на ипсилатеральной стороне. Считается, что ГПС развивается в основном в случаях, когда перфузия после оперативного вмешательства увеличивается в 2 раза и более по сравнению с исходным уровнем и редко наблюдается у пациентов с увеличением кровотока менее чем на 100%.
Данные о распространенности ГПС значительно варьируют: по сведениям разных авторов, от 0,4 до 14% случаев оперативных вмешательств на сонных артериях сопровождаются неврологическими нарушениями, возникающими вследствие увеличения перфузии.
В XXI в., с развитием эндоваскулярной хирургии, ГПС стали наблюдать и изучать при других видах вмешательств, в частности при стентировании сонных артерий (ССА). По результатам рандомизированных клинических испытаний, посвященных сравнению КЭА и ССА, убедительных доказательств преимущества или существенных различий между этими двумя методами в плане общей безопасности представлено не было. В работе D. Ziaja et al. по результатам неврологического обследования в общей сложности 1386 пациентов после КЭА и ССА было продемонстрировано отсутствие статистически значимой разницы по частоте и характеру наблюдаемых проявлений гиперперфузии.
На сегодняшний день механизмы развития церебральной гиперперфузии изучены еще недостаточно. Наиболее важным патофизиологическим фактором ГПС считают снижение цереброваскулярного резерва (ЦВР) в результате длительно существующей ишемии у пациентов с выраженным стенозом сонных артерий, что, в свою очередь, приводит к нарушению ауторегуляции мозговой гемодинамики. Принципиальным моментом в формировании истощения ЦВР являются длительность и интенсивность предоперационной гипоперфузии. В условиях исходно нарушенной ауторегуляции значительное усиление артериального притока, наступившее на фоне дилатации микрососудистого русла, уже не сопровождается необходимой для регуляции мозгового кровотока адекватной реакцией – спазмом на уровне артериол. Как результат – формируется зона гиперимии, являющаяся патофизиологической основой синдрома гиперперфузии [Т.В. Стрелкова, А.Г. Айроян, Церебральный гиперперфузионный синдром, Клиническая физиология кровообращения, №3 – 2015, С – 5-6]. Увеличивается проницаемость гематоэнцефалического барьера, что способствует отеку мозговой ткани, лакунарным геморрагиям. Кровоток может превосходить исходный в 3-4 раза и максимальных значений достигает к 3-4-м послеоперационным суткам, когда возникают клинические признаки гиперперфузионного синдрома: головные боли, боли в глазных яблоках, очаговый неврологический дефицит вплоть до развития геморрагического инсульта. Риск геморрагических осложнений сохраняется до 25-х послеоперационных суток, при этом геморрагический инсульт развивается в 0,5-2% случаев, с летальностью в 30-60%. Предрасполагающими факторами являются неконтролируемая артериальная гипертензия в пред- или послеоперационном периоде, незамкнутый артериальный (Виллизиев) круг, двусторонний стеноз сонных артерий более 85%, односторонний стеноз более 95%. Выявление гиперперфузии возможно на основании транскраниальной допплерографии, перфузионных методов нейровизуализации (двукратный прирост кровотока) и транскраниальной церебральной оксиметрии (прирост значений от 5 до 24%) [Ю.В. Белов, Р.Н. Комаров, П.А. Каравайкин, Кардиология и сердечно-сосудистая хирургия, 5, 2014, «Хирургическое лечение больных с двусторонним поражением сонных артерий», С-36].
С целью профилактики СЦГП многими исследователями подчеркивается роль поддержания оптимального АД в до-, интра- и послеоперационном периодах (у пациентов с наличием факторов риска СЦГП на уровне менее 120/80 мм рт.ст.). Поддержание артериального давления в пределах ниже 120/80 мм рт.ст., бывает крайне затруднительно у пациентов с вазоренальной гипертензией, у которых, как правило, артериальная гипертензия резистента к гипотензивной терапии
Предложены и другие методики предупреждения СЦГП. Одним из таких способов является использование интраоперационного внутрипросветного шунта малого диаметра у пациентов с критическими билатеральными стенозами или с контралатеральной окклюзией внутренней сонной артерии. Данный способ не применим при стентировании сонных артерий.
Известен способ профилактики реперфузионного синдрома, заключающийся в том, что после окончания основного этапа операции до снятия зажимов с оперированной артерии дистальнее сосудистого шва накладывают устройство для регуляции объемной скорости кровотока по реконструированному сосуду, уменьшают кровоток, затем в раннем послеоперационном периоде дозированно восстанавливают кровоток, а после восстановления последнего устройство удаляют [патент RU №2189790, 2002 г.]. Однако данный способ используется только при открытых операциях на каротидном бассейне, не применим при стентировании сонных артерий.
Прототипом изобретения является метод «ступенчатой» ангиопластки, заключающийся в следующем: пациентам назначается двойная антиагрегантная терапия за 3 дня до процедуры. Каротидная ангиопластика и стентирование выполняется с помощью трансфеморального доступа (через левую или правую бедренную артерию) под местной анестезией. Предилатациию проводят баллоном в соответствии с нормальным диаметром целевой внутренней сонной артерией (диаметр при полной дилатации, как правило, 5 или 6 мм). Баллон раздувают до 6-8 атмосфер в течение 60 секунд. Если удовлетворительного увеличения диаметра не было достигнуто или при наличии существенной диссекции стенки выполняют стентирование самораскрывающимся стентом. Постдилатацию не выполняют, чтобы предотвратить эмболические осложнения. Дистальную защита не используют во время процедуры. Внутривенно вводят гепарин во время процедуры (100 мкг/кг плюс 1000 мкг/ч) на протяжении всей процедуры. Также внутривенно вводят прямой ингибитор тромбина – Аргатробан (Daiichi Pharmaceuti – cal Co., Ltd., Nishinomiya, Japan) в течение 24 часов после процедуры (60 мг / 24 ч). Систолическое артериальное давление поддерживают менее 130 мм ртутного столба в течение 1 недели после процедуры [Yasuhiko Kaku, Shin-ichi Yoshimura, and Jouji Kokuzawa, «Factors Predictive of Cerebral Hyperperfusion after Carotid Angioplasty and Stent Placement», AJNR Am J Neuroradiol 25, September 2004, P – 1403-1408].
Недостатками данного метода профилактики синдрома церебральной гиперперфузии является: увеличение линейной скорости кровотока (ЛСК), за счет резкого, неконтролируемого увеличения объема крови в интракраниальных отделах церебральных артерий после сдувания баллона, что ведет к увеличению напряжения пристеночного сдвига и, как следствие, приводит к функциональному и структурному изменению сосудистой стенки и увеличению проницаемости гематоэнцефалического барьера. При «ступенчатой» ангиопластике прирост линейной скорости кровотока будет напрямую зависеть от размера используемого баллона, поэтому при каждом сдувании баллона и увеличении площади свободного прохождения крови через остаточный стеноз, соответственно, будет увеличивать напряжение пристеночного сдвига (НПС). В норме данный показатель определяет работу эндотелий – зависимого механизма регуляции тонуса и диаметра артерии. Под воздействием высокого НПС наблюдается растяжение клеток эндотелия с возможным последующим изменением цитоскелета, перестеройка и реорганизация коллагеновых и эластических волокон [В.В. Крылов, «Хирургия аневризм головного мозга», Москва – 2011, С-24].
Таким образом, представленные выше методы профилактики синдрома церебральной гиперпефузии во время стентирования каротидных артерий не могут должным образом предупредить данное осложнения.
Технический результат при использовании изобретения – предотвращение церебральной гиперперфузии за счет контролируемой регуляции кровоснабжения головного мозга во время стентирования каротидной артерии.
Указанный технический результат достигается тем, что в способе профилактики синдрома церебральной гиперперфузии во время стентирования каротидных артерий, включающем двойную антиагрегантную терапию за 3 дня до процедуры, выполнение с помощью трансфеморального доступа под местной анестезией каротидной ангиопластики и стентирования, предилатацию баллоном, согласно изобретению после выполнения трансфеморального доступа во внутреннюю сонную артерию устанавливают сначала систему проксимальной защиты МоМа, затем проводят коронарный проводник за стеноз, по проводнику проводят баллон диаметром 1,5×20 мм и выполняют предилатацию под давлением 8 атм, после удаления баллона и проводника выполняют активную аспирацию через просвет системы МоМа, после чего проводят за стеноз систему дистальной защиты – фильтр FilterWire и устанавливают в проекции угла нижней челюсти, в проекции внутренней сонной артерии на шее устанавливают ультразвуковой датчик и выполняют ультразвуковое дуплексное сканирование (УДС) кровотока под контролем значения линейной скорости кровотока (ЛСК), под контролем УДС выполняют постепенное сдувание проксимального баллона системы защиты МоМа таким образом, чтобы показатели ЛСК не превышали Vps
УЗИ сосудов головного мозга и шеи
Читайте подробнее о режимах УЗИ.
УЗИ сосудов головного мозга и шеи — это ультразвуковое исследование состояния кровеносных сосудов шеи и головы как снаружи, так и внутри черепа. Процедура безопасна и абсолютно безболезненна. Во время УЗИ пациент сидит или лежит на кушетке, поворачиваясь к специалисту нужным участком головы и шеи. Длительность УЗИ — до 30-40 минут, в конце выдается протокол исследования с заключением врача.
Другое название УЗИ сосудов головного мозга — нейросонография.
Кровоснабжение головного мозга
Кровеносные сосуды головного мозга:
- две внутренние сонные артерии (каротидный бассейн, 70-85% кровоснабжения мозга) и две позвоночные артерии (вертебро-базилярный бассейн, 15-30%) образуют артериальное кольцо на основании мозга (Виллизиев круг). Позвоночные артерии кровоснабжают задние отделы головного мозга (мозжечок и продолговатый мозг).
- глубокие и поверхностные вены головного мозга, венозная кровь от которых попадает в две яремные вены на шее. Имеются и позвоночные вены.
Теория: как кровоснабжается головной мозг.
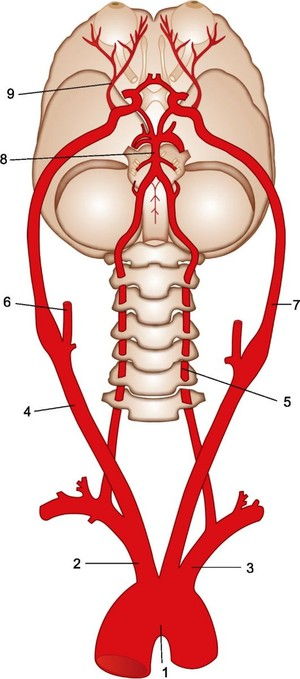
Кровоснабжение головного мозга (вид снизу).
От дуги аорты (1) по очереди отходят плечеголовной ствол (2), левая общая сонная артерия и левая подключичная артерия (3). С каждой стороны общая сонная артерия (правая — 4) делится на наружную (правая — 6) и внутреннюю. Внутренние сонные артерии (левая — 7) идут к головному мозгу и кровоснабжают его передние отделы, а также глаз (глазная артерия — 9).
От подключичной артерии с каждой стороны отходит позвоночная артерия (левая позвоночная артерия — 5). Позвоночные артерии проходят в отверстиях поперечных отростков шейных позвонков. В полости черепа на основании мозга 2 позвоночные артерии соединяются в одну базилярную (основную) артерию (8).
Две внутренние сонные артерии содиняются между собой и базилярной артерией с помощью соединительных ветвей, в 25-50% случаев образуя артериальное кольцо — Виллизиев круг, который позволяет отделам мозга не погибнуть, если кровоток по 1 из 4 артерий к мозгу вдруг прекратится. При хроническом нарушении кровоснабжения головного мозга по позвоночным артериям возникает вертебро-базилярная недостаточность.
Режимы УЗИ сосудов головного мозга и шеи
Для полноты исследования сосудов головы и шеи УЗИ проводится в нескольких режимах последовательно или одновременно:
- B-режим (двухмерный) — в этом режиме получают полную информацию о структуре сосуда и окружающих тканей и минимальную информацию о кровотоке. В B-режиме УЗИ исследуют только сосуды шеи и сосуды головы за пределами черепа. В B-режиме можно изучать вещество головного мозга, но исследовать сосуды головного мозга внутри черепа в этом режиме принципиально невозможно.
- дуплексное сканирование — в этом режиме УЗИ получают подробную информацию о кровотоке в сосуде. С помощью дуплексного сканирования можно исследовать не только сосуды шеи и головного мозга за пределами черепа, но и внутри черепа. В последнем случае дуплексное сканирование называется транскраниальным (от слова cranium — череп).
На этой странице далее изложена информация о двухмерном (B-режиме) УЗИ сосудов головного мозга и шеи, но для полноты исследования необходим следующий этап УЗИ — дуплексное сканирование.
Одно из официальных названий — ультразвуковая допплерография магистральных сосудов головы (УЗДГ).
Исследуемые параметры
Если при оценке состояния артерий возможна четкая визуализация сосудистой стенки и просвета (плечеголовной ствол, сонные и позвоночные артерии вне черепа, артерии рук и ног), то в В-режиме оценивают следующие параметры:
- проходимость сосуда,
- геометрию сосуда (соответствие хода сосуда анатомической траектории),
- диаметр просвета сосуда,
- состояние сосудистой стенки (целостность, толщину комплекса «интима-медиа» — внутренняя и средняя оболочка, эхогенность, степень разделения на слои, форму поверхности);
- состояние просвета сосуда (наличие, расположение, протяженность, эхогенность внутрипросветных образований, степень нарушения проходимости);
- состояние тканей вокруг сосуда (наличие, форма, степень, причина внесосудистого воздействия).

Измерение диаметра внутренней яремной вены
(А — продольное сканирование, Б — поперечное).
Для осмотра обычно используются датчики УЗИ линейного формата с частотой 5-15 МГц — в зависимости от задач исследования и глубины расположения сосуда.
Показания к УЗИ сосудов головного мозга
Показаниями к направлению на УЗИ сосудов головного мозга и шеи являются:
- клинические признаки острой или хронической недостаточности сосудов головного мозга, в том числе синдром головной боли;
- наличие факторов риска поражения сосудов головного мозга (курение, гиперлипидемия, артериальная гипертензия, сахарный диабет, ожирение);
- признаки поражения других артериальных бассейнов при системном характере сосудистой патологии;
- планирование операции по поводу различных видов сердечной патологии, в первую очередь ИБС (аортокоронарное шунтирование);
- патология окружающих органов и тканей, являющаяся возможным источником внесосудистых воздействий.
Цели исследования сосудов головы и шеи
Цели ультразвукового исследования сосудов головного мозга вне и внутри черепа:
- обнаружение стенозов (сужений) и закупорки в сосудах головного мозга, оценка их значимости в развитии заболевания и в нарушении кровотока,
- обнаружение комплекса нарушений, вызванных наличием системного сосудистого заболевания,
- обнаружение первых (доклинических) признаков системной сосудистой патологии,
- контроль эффективности лечения,
- оценка местных и центральных механизмов регуляции тонуса сосудов,
- оценка резервных возможностей кровообращения в сосудах головного мозга,
- обнаружение пороков развития сосудов, аневризм, соустий, спазма сосудов, нарушений венозного кровообращения,
- оценка роли обнаруженной патологии в происхождении клинических симптомов у пациента.
Главный вопрос, на который должен ответить специалист ультразвуковой диагностики врачу-клиницисту после проведения УЗИ: способны ли обнаруженные изменения стать причиной развития имеющихся у пациента клинических симптомов? Кроме того, в большинстве случаев комплексное УЗИ сосудов головного мозга и шеи позволяет решить вопрос о целесообразности проведения операции.
Материал был полезен? Поделитесь ссылкой:
комментариев 7 к заметке «УЗИ сосудов головного мозга и шеи»
20 Май, 2013 в 11:46
Скажите пожалуйста, я прошел УЗИ у меня заключение: при УЗДГ исследовании магистральных артерий головного мозга выявлены признаки гипоперфузии мозга; ВБН с экстравазальной компрессией ПА справа, вот что это значит? можете сказать по подробнее на простом языке)
Комментарий автора сайта:
Гипоперфузия мозга — его недостаточное кровоснабжение.
ВБН (вертебро-базилярная недостаточность, вертебрально–базилярная недостаточность) — обратимое нарушение функций задней части мозга (ствол, мост, мозжечок, затылочные доли больших полушарий), вызванное уменьшением кровоснабжения по позвоночным артериям. Две позвоночные артерии на основании мозга соединяются в одну базилярную (основную) артерию.
Экстравазальная компрессия — внесосудистое сдавление.
Таким образом, у вас правая позвоночная артерия на определенном участке чем-то сдавлена, это нарушает кровоток по ней и ухудшает кровоснабжение задних отделов головного мозга.
28 Сентябрь, 2013 в 16:06
Пример заключения ультразвуковой допплерографии магистральных сосудов головы (УЗДГ):
Церебральный атеросклероз с умеренной гипоперфузией (обусловленной ангиоспазмом и ангиосклерозом) по средним мозговым артериям с обеих сторон и надблоковым (глазным) артериям с обеих сторон. Виллизиев круг замкнут частично (при проведении компрессионных проб задние соединительные артерии не включаются, передняя функционирует). Нарушение гемодинамики в вертебро-базиллярном бассейне с признаками экстравазальной компрессии в экстракраниальных отделах (на уровне V-2 и V-З) склеротически измененных позвоночных артерий и остаточной гипоперфузии в интракраниальных сегментах позвоночных артерий с обеих сторон (справа больше), основной артерии и задних мозговых артерий с обеих сторон. При проведении ротационных проб резерв кровотока по позвоночным артериям достаточный. Адаптационные возможности аппарата ауторегуляции мозгового кровотока снижены с обеих сторон со снижением реактивности со слов на гиперкапнию (сосудисто-метаболическая энцефалопатия). Признаки легкой внутричерепной гипертензии, обусловленной незначительным нарушением венозного оттока. В остальном венозный отток без особенностей.
Словарик терминов:
гипоперфузия — снижение кровоснабжения (кровотока);
ангиоспазм — спазм сосудов (сужение артерий, обусловленное сокращением гладкой мускулатуры в их стенках);
ангиосклероз — уплотнение сосудов из-за увеличения содержания соединительной ткани;
Виллизиев круг — артериальное кольцо на основании мозга, соединяющие несколько артерий в замкнутый круг;
компрессия — сдавление;
экстравазальный — вне сосуда;
экстракраниальный — вне черепа;
интракраниальный — внутри черепа;
ротация — вращение;
ауторегуляция — саморегуляция;
реактивность — способность реагировать на раздражение;
гиперкапния — увеличенное содержание углекислого газа в крови;
энцефалопатия — невоспалительное хроническое распространенное поражение головного мозга;
внутричерепная гипертензия — повышенное давление внутри черепа.
30 Август, 2014 в 17:39
Что бы это значило? Проницаемость височных окон снижена. Проницаемость затылочного окна снижена.
Ответ автора сайта:
На УЗИ плохо видно через стандартные доступы.
15 Май, 2015 в 21:58
Скажите пожалуйста я прошла уздг вот заключение: признаки ангиодистонии с тенденцией к понижению сосудистого тонуса. экстравазальные влияния на левую ПА. выраженная венозная дисциркуляция в ВББ. что это значит?
Ответ автора сайта:
По очереди:
1) нарушен тонус сосудов с тенденцией к их расширению
2) внешние влияния (видимо, сдавление снаружи) на левую позвоночную артерию
3) значительное нарушение кровотока по венам в вертебро-базилярном бассейне (по позвоночным артериям и после их соединения).
16 Май, 2015 в 21:31
Пожалуйста, объясните, что означает в протоколе УЗДГ: признаки стенозирующей стадии атеросклеротического поражения магистральных артерий головы. Стенозы ОСА слева, ВСА с двух сторон. Патологическая извитость сосудов (ПА с двух сторон). Спасибо.
Ответ автора сайта:
Стеноз — это сужение просвета. Есть подозрение, что атеросклероз стал причиной сужения магистральных артерий головы. ОСА — общая сонная артерия, ВСА — внутренняя сонная артерия. ПА — позвоночная артерия, она у вас чрезмерно извита с обеих сторон, это может ухудшать кровоток по ней.
27 Апрель, 2016 в 17:14
Нейросоно и УЗИ сосудов головного мозга это не одно и тоже. Поправьтесь. А позвоночная артерия не может быть чрезмерно извита. Она либо извита (s, c или петлеобразование) либо нет. Без всяких субъективных дополнений. А вообще сайт у Вас хороший. Удачи!
1 Март, 2018 в 14:45
Объясните, пожалуйста, что значит результат УЗДГ: признаки негрубой дисциркуляции кровотока в интракраниальном отделе левой и правой внутренних сонных артерий, более выражено справа (вероятнее всего за счет ангиоспазма).
Ответ автора сайта:
Небольшое нарушение кровотока внутри черепа по внутренним сонным артериям, сильнее справа (вероятно, сужение артерий за счет сокращения мышечной оболочки этих артерий). По описанию — не очень опасно. Остальное зависит от симптомов.
Напишите свой комментарий:
© Блог врача скорой помощи, 2007 – 2017. Политика конфиденциальности.
Работает на WordPress. Дизайн от Cordobo (с изменениями).