Резекция почки в условиях регионарной ишемии
М. С. Мосоян, С. Х. Аль-Шукри, А. М. Есаян, Д. М. Ильин, С. В. Корза,
СПбГМУ им. И. П. Павлова, г. Санкт-Петербург
Нефрэктомия или резекция почки, выполненные по поводу локализованной формы рака, обеспечивают одинаковую онкологическую выживаемость. Однако для предотвращения развития или замедления прогрессирования хронической болезни почек возрастает значение орган-сохраняющих операций. Резекция почки обычно выполняется в условиях тотальной ишемии с пережатием почечных сосудов. Каждая минута тепловой ишемии имеет важное значение в развитии острого повреждения почек, а в последующем и хронической болезни почек. С целью повысить функциональные результаты нефрон-сберегающих операций в последние годы было предложено выполнять процедуру в условиях регионарной ишемии. Первые положительные результаты нового метода позволяют сделать вывод о его эффективности и наметить пути для дальнейшего совершенствования.
Рак почки. Показания к резекции почки
За минувшее десятилетие заболеваемость раком почки в Российской Федерации возросла более чем на 40% и достигла 12,92 на 100 тыс. населения. Около 60% новых случаев выявляются случайно при профилактических осмотрах, диспансерном наблюдении или при плановых обследованиях по поводу других заболеваний [1]. По данным Европейской ассоциации урологов, классическая триада симптомов (боль, гематурия, пальпируемая опухоль) в настоящее время встречается лишь в 6–10% случаев [18]. Основным методом лечения локализованного рака почки остается хирургический: нефрэктомия или резекция почки могут быть выполнены как открытым, так и лапароскопическим или робот-ассистированным способами. Установлено, что резекция почки обеспечивает схожие с нефрэктомией онкологические результаты и обеспечивает преимущество в вопросе общей выживаемости [18, 20].
В настоящее время резекция является методом выбора при лечении больных раком почки в стадии T1a ( 30 мл/мин/1,73 м2 и резекцией почки, выполненной с тепловой ишемией, высок риск развития хронической болезни почек тяжелой стадии в течение 3 лет после операции. На сегодняшний момент, по данным исследований, время тепловой ишемии в ходе открытой резекции почки составляет 14–21 минуты, а при опухолях единственной почки или большого размера в среднем около 38 минут.
При лапароскопической резекции почки время ишемии колеблется от 27 до 35 минут, а при робот-ассистированной – от 19,7 до 32,1 минут [4, 27]. L.T. Lavallee et al. [17] исследовали связь между шкалами оценки опухоли и ВТИ в ходе открытой резекции почки. По данным КТ опухоли были охарактеризованы с использованием трех систем: нефрометрической шкалы R.E.N.A.L.1, PADUA2 и C index3. Было отобрано 78 пациентов. Средние значения для трех систем составили соответственно 7, 8 и 3,9. Среднее ВТИ равнялось 23,4 мин. Диаметр опухоли, близость к полостной системе, передняя/задняя локализация, медиальная/латеральная локализация и вовлечения полостной системы были чрезвычайно связаны с продолжительностью ишемии.
Высокие значения R.E.N.A.L. и PADUA были значительно связаны со временем ишемии, а высокий C index не был достоверно связан. На основании этих данных авторы делают вывод о связи характеристик опухоли с ВТИ.W.A. Mayer et al. [23] исследовали ценность шкалы R.E.N.A.L. для прогноза ВТИ, объема кровопотери и интраоперационного повреждения полостной системы почки в ходе лапароскопической и робот-ассистированной резекции. Авторы делают вывод, что шкала R.E.N.A.L. в целом, а также уровни N и R могут помочь спрогнозировать время тепловой ишемии и вероятность нарушения целостности полостной системы почки в ходе указанных операций, что позволит спланировать ход оперативного вмешательства.
F. Altunrende et al. [5] решили исследовать, как каждый компонент шкалы R.E.N.A.L. влияет на ВТИ в ходе робот-ассистированной резекции почки. Авторы заключают, что подкатегории A и L не имеют значимого влияния на ВТИ. ВТИ сильно зависит как от значений остальных подкатегорий, так и от общего уровня R.E.N.A.L.V. Ficarra et al. [9] провели ретроспективный анализ 347 случаев робот-ассистированной резекции почки с целью определить предикторы длительного времени тепловой ишемии (ВТИ, более 20 мин) и периоперационных осложнений. Оказалось, что опыт хирурга, размер и другие анатомические характеристики опухоли, определенные по шкале PADUA, а также необходимость восстановления полостной системы почки являются независимыми предикторами ВТИ >20 мин. Аналогично, опыт хирурга, размер опухоли, другие анатомические характеристики опухоли, определенные по шкале PADUA, являются независимыми предикторами осложнений в целом.
Резекция почки в условиях регионарной ишемии
Возможно, из-за несоответствия реального и безопасного времени в последние годы разрабатываются меры, направленные на максимальное сокращение времени тепловой ишемии органа – концепция так называемой «нулевой ишемии» («zero ischemia»). Некоторыми авторами предлагается выполнять резекцию опухоли без наложения зажима на сосудистую ножку, что неизбежно приводит к большему объему интраоперационной кровопотери, однако позволяет максимально сохранить количество функционирующих нефронов [12]. Также в ходе лапароскопической и робот-ассистированной резекции почки предлагается выполнять селективную микродиссекцию и пережатие артерии, питающей опухоль, в сочетании с фармакологической гипотонией [11, 31, 40]. Так, I.S. Gill et al. [10] описали 15 случаев роботической и 43 случая лапароскопической резекции почки в условиях нулевой ишемии без пережатия почечной ножки путем микродиссекции почечных артерий 3 и более порядка, питающих опухоль, и наложения на них зажимов типа «бульдог». Средний размер опухоли составлял 3,2 см, средняя продолжительность оперативного вмешательства 4,4 часа, а объем кровопотери – 206 мл. Интраоперационных осложнений не наблюдалось.
Спустя 4 месяца после операции уровень креатинина возрос на 18% от исходного, СКФ снизилась на 13%, а функция контрлатеральной почки снизилась на 10% по данным радионуклидной диагностики. Авторы заключают, что в большинстве случаев лапароскопическая и роботическая резекция почки может быть выполнена без тотальной ишемии органа. В другом исследовании той же группой авторов [11] описано 12 случаев лапароскопической и 3 случая робот-ассистированной резекции почки по поводу маленьких опухолей 1–4 см в диаметре без наложения зажима на сосудистую ножку с фармакологической гипотоний до 60 мм рт. ст. в течение 1–5 мин.
Средняя продолжительность операции составила 3 часа, средний объем кровопотери – 150 мл. Средние пред- и послеоперационные уровни креатинина (0,9 мг/дл и 0,95 мг/дл) и оценочной СКФ (75,3 и 72,9 соответственно) были сравнимыми.G. Simone et al. [34] описали 7-летний опыт выполнения лапароскопической резекции почки в условиях нулевой ишемии путем трансартериальной эмболизации опухоли на 210 пациентах.
Средний размер опухоли был 4,2 см, средняя продолжительность операции составила 62 минуты, а объем кровопотери – 150 мл. Спус-тя 3 и 12 мес после операции СКФ снизилась соответственно на 9 и 5%. Авторы предлагают использовать данную методику для опухолей со средними значениями нефрометрии.В литературе недостаточно подробно описан метод гемостаза, связанный с наложением зажима на паренхиму почки. F. Rodríguez-Covarrubias et al. [29] представили опыт выполнения 7 открытых резекций почек с использованием зажима DeBakey для селективного пережатия почечной паренхимы. M. Khedis at al. [13] изучали результаты применения зажима Reniclamp для тех же целей.
Авторы заключают, что резекция почки в условиях селективной ишемии с наложением зажима на паренхиму – это альтернатива пережатию почечной ножки, которая может быть применима во всех случаях опухолей почки кроме локализации ее в среднем сегменте. Для этих целей также описан опыт применения зажима Simon (Aesculap) у трех пациентов с раком почки, позволявшего выполнить лапароскопическую резекцию почки в условиях регионарной ишемии [33].
Хроническая болезнь почек и сердечно-сосудистые осложнения после нефрэктомии и резекции почкиИзвестно, что хроническая болезнь почек является фактором риска развития инфаркта миокарда и инсульта [41]. На 26 147 пациентах D.E. Weiner et al. [42] изучили частоту возникновения сердечно-сосудистых осложнений у пациентов с ХБП и сердечно-сосудистым заболеванием в анамнезе. Так, в течение 10 лет неблагоприятный исход (инфаркт миокарда, инсульт или смерть) наступил у 33% пациентов с ХБП, 66% у пациентов с исходными ХБП и сердечно-сосудистым заболеванием и только у 4% пациентов без указанных заболеваний в анамнезе.
Таким образом, хроническая болезнь почек является сильным независимым фактором риска тяжелых сердечно-сосудистых осложнений и смерти.В анализе литературы, выполненном А.М. Есаяном и соавт. [2], было показано, что органосохраняющие операции предотвращают развитие или замедляют прогрессирование уже существующей ХБП, а также сердечно-сосудистых осложнений и смертности. T. Sejima et al. [32] исследовали факторы прогноза онкологических и функциональных результатов нефрэктомии, выполненной по поводу рака почки. В результате мультивариантного анализа были получены данные о том, что возникновение почечной недостаточности после нефрэктомии, выполненной по поводу опухоли в стадии Т1, является фактором неблагоприятного прогноза. Такие пациенты нуждаются в тщательном наблюдении, как по вопросу рака почки, так и возможных неблагоприятных сердечнососудистых событий.
F. C. Roos et al. [30] сравнили функциональные результаты нефрон-сберегающих операций и нефрэктомии, выполненных по поводу опухолей более 4 см. Было показано, что при схожих показателях выживаемости и частоты осложнений нефрэктомия связана с существенно большим риском развития ХБП. C.J. Long et al. [19] также показали, что резекция опухолей более 7 см обеспечивает лучшие функциональные результаты по сравнению с нефрэктомией. Ввиду недостаточной изученности вопроса о выборе оптимального метода обеспечения нулевой ишемии в ходе резекции почки особый интерес вызывает работа G.L. Martin et al. [22], в которой сравнивались тотальная, селективная и неартериальная техники наложения зажима в ходе лапароскопической и робот-ассистированной резекции почки.
Автор делает вывод о возможности применения техники селективного пережатия артерий почки или выполнения процедуры без ишемии, при этом среднесрочные результаты не выявили существенных преимуществ одного метода над другим. В работе M. Sun et al. [35] было показано, что пациенты, перенесшие резекцию почки, значительно реже умирают от неонкологических причин по сравнению с теми, кому была предпринята нефрэктомия. Возраст, женский пол, исходные гиперкалиемия и гиперлипидемия являются независимыми предикторами смерти от других причин.
Авторы делают вывод о необходимости выполнения резекции почки во всех возможных случаях. В обзоре S. MacLennan et al. [21] был выполнен анализ периоперационных результатов и качества жизни после хирургического лечения локализованного рака почки. Было доказано преимущество резекции почки в вопросах лучшего сохранения функции почек и качества жизни по сравнению с нефрэктомией, независимо от использованного хирургического метода.
В случаях, когда выполнение резекции почки технически невозможно, самые лучшие периоперационные результаты и качество жизни обеспечивает лапароскопическая нефрэктомия. S. P. Kim et al. [14] осуществили мета-анализ эффективности нефрэктомии и резекции почки в вопросах выживаемости и сохранения почечной функции. Так, резекция почки обеспечивает преимущество в выживаемости пациентов, а также более низкий риск развития тяжелой хронической болезни почек (ХБП) после хирургического лечения локализованного рака почки. Однако, по словам авторов, вопрос требует дальнейшей проработки ввиду низкого качества существующих доказательств и существенной неоднородности исследований. Лишь у небольшого процента пациентов, оперированных по поводу локализованного рака почки, возникает рецидив заболевания. Это означает, что большинство таких больных умирает не от рака почки, а от других причин. В работе M. Sun et al. [36] исследовались пациенты старше 65 лет.
Резекция почки не оказывает защитного эффекта по отношению к нефрэктомии в вопросе смертности от других причин. Не было зафиксировано разницы между резекцией и нефрэктомией среди пациентов ≥75 лет или имеющих ≥2 сопутствующих диагнозов, или ≥75 лет + 2 сопутствующих диагноза. Т.о. некоторые возрастные пациенты и те лица, у которых выраженный коморбидный фон, могут не выиграть от резекции в вопросе смертности от других причин. Им следует предложить другие малоинвазивные методы лечения, такие как радиочастотная аблация, криодеструкция опухоли и др. R. H. Thompson et al. [37] исследовали влияние времени тепловой ишемии (ВТИ), качества и количества сохраненной почечной ткани на функцию почки после ее резекции. Было исследовано 362 пациента, перенесших резекцию почки в условиях тепловой ишемии. Среднее ВТИ составило 21 мин, процент сохраненной почки – 80%. Средняя дооперационная СКФ составляла 61 мл/мин/1,73 м2. У 70 пациентов (19%) в послеоперационном периоде возникла острая почечная недостаточность. Среди пациентов с исходной СКФ более 30 у 17% в период наблюдения развилась ХБП 4.
Время тепловой ишемии (ВТИ), качество и количество сохраненной почки было значимо связано с развитием острой почечной недос-таточности, а с возникновением ХБП 4 были связаны только процент сохраненной ткани почки и предоперационный уровень СКФ. ВТИ более 25 мин было в значительной степени связано с дебютом ХБП 4. Авторы делают вывод о необходимости развития прецизионной хирургии, направленной на сохранение максимального объема функционирующей почечной паренхимы. Эти данные подтверждаются B.R. Lane et al. [16]. Они провели нерандомизированное сравнительное исследование на 660 пациентах, которым в период с 1980 по 2009 г. была выполнена резекция единственной почки в условиях тепловой (360 случаев) и холодовой (300) ишемии.
Средняя продолжительность наблюдения за пациентами составила 4,5 года. Спустя 3 мес после операции уровень клубочковой фильтрации понизился в группах тепловой и холодовой ишемии на одинаковое значение (21 и 22% соответственно), хотя среднее время холодовой ишемии было значительно длиннее (45 против 22 минут). Оказалось, что процент сохраненной паренхимы и предоперационный уровень клубочковой фильтрации являются важнейшими факторами, влияющими на сох-ранение функции почки. Длительность ишемии же не является независимым фактором, определяющим функцию почек, и его влияние требует дальнейшего изучения.
Однако A.R. Patel et al. [24] в обзоре опубликованной урологической, нефрологической и трансплантационной литературы на предмет тепловой ишемии и функции почек уточнили, что функция почек зависит от не только от качества (СКФ до операции) и количества сохраненной в ходе операции паренхимы, но также и от длительности ишемии. В настоящее время не определен безопасный порог для ВТИ, т. к. каждая минута ишемии вносит свой вклад в развитие острого повреждения почки и снижение почечной функции. J. D. Choi et al. [8] изучали влияние тепловой ишемии на восстановление функции почки после резекции, выполненной в условиях пневмоперитонеума. 37 пациентов были обследованы до операции, а также 3 и 12 мес после вмешательства. Оказалось, что при ВТИ >28 мин спустя 3 и 12 мес после операции уровень клубочковой фильтрации оставался значительно сниженным (-22,4 и 30,6% соответственно).
В противоположность этому СКФ значимо не изменилась у пациентов с ВТИ 28 минут и менее. С. Б. Петров и соавт. [25] провели анализ функциональных результатов резекции почки у 31 пациента путем исследования уровня креатинина плазмы крови и радиоизотопного исследования почки. Время тепловой ишемии более 15 минут приводило к ультраструктурному повреждению нефронов и уменьшению клубочковой фильтрации на 20–30%. При этом внезапное изменение уровня креатинина крови на следующий день после операции может рассматриваться как долгосрочный прогностический фактор функции почки. Также локальная гипотермия может быть рекомендована в случае регионарной ишемии более 15 минут.
Заключение
В наши дни, когда хирургические методы позволяют добиться высоких онкологических результатов при лечении локализованного рака почки, вопросам сохранения функции почек, предотвращения сердечно-сосудистых осложнений в отдаленном периоде наблюдения ученым сообществом уделяется все больше внимания. Так, было показано, что резекция почки обеспечивает большее сохранение функции по сравнению с нефрэктомией, однако продолжительное время тепловой ишемии необратимо снижает функцию почек и повышает риск тяжелой ХБП в отдаленном периоде. В последние годы активно развивается концепция «нулевой ишемии» («zero ischemia»), задачей которой является сведение к минимуму или даже полный отказ от тотальной ишемии почки в ходе ее резекции с целью предотвратить развитие осложнений.
В этой связи важно отметить, что не только малая продолжительность тепловой ишемии обеспечивает хорошие функциональные результаты лечения: по мнению исследователей, большой вклад вносят предоперационное состояние паренхимы почки и объем ее сохранения в результате операции. На наш взгляд, перспективным направлением развития нефрон-сберегающей хирургии является применение специальных зажимов для почечной паренхимы, позволяющих выполнить вмешательство, не прибегая к пережатию сосудистой ножки почки. Эта тема недостаточно развита в литературе, несмотря на то, что метод, бесспорно, обладает рядом преимуществ, одним из которых является относительная простота выполнения процедуры по сравнению с другими способами, которые связаны со сложными и потенциально опасными хирургическими манипуляциями в воротах почки.
Не менее важным, но также мало изученным вопросом, остается проблема прогнозирования острой почечной недостаточности в раннем послеоперационном периоде. Необходимо научиться выявлять повреждение почки на самом раннем этапе, чтобы предотвращать развитие острой, а затем и хронической почечной недостаточности и тяжелых сердечно-сосудистых осложнений.
Вестник Национального медико-хирургического центра
им. Н. И. Пирогова, т. 8, №2, июнь 2013
Ишемическая болезнь почек (ишемия почек, ишемическая нефропатия, сосудистая нефропатия)
Причины заболевания
Ишемическая нефропатия — это группа заболеваний, в основе которых лежит ишемия почек, развившаяся вследствие первичного поражения почечных сосудов различного диаметра с нарушением их проходимости и выраженным диффузным обеднением почечного кровотока, приводящим к снижению фильтрационной функции и прогрессирующему нефросклерозу.
Термин «ишемическая нефропатия» появился в 1988 году, однако долгое время эта группа заболеваний почек оставалась недостаточно изученной. На сегодняшний день выявлена причина ишемической болезни почек. Это атеросклероз, который приводит к стенозу и нарушению проходимости крупных сосудов, снабжающих почку кровью. Основная масса пациентов с ишемией почки — это люди старше 60 лет. Увеличение количества диагностированной ишемической нефропатии в развитых странах мира ученые связывают с увеличением продолжительности жизни.
Двусторонний атеросклеротический процесс, который уменьшает количество крови, поступающей к почкам, или 50% поражение единственной функционирующей почечной артерии приводит к развитию ишемии почек и нарушению их функций. Ишемическую нефропатию может вызвать поражение брюшной аорты, почечных артерий как большого, так и малого калибра. Самая главная опасность в том, что сосуды могут оказаться полностью перекрыты, это вызовет остановку кровоснабжения почки, прекращение процесса выведения из организма продуктов жизнедеятельности. Результатом этого будет острая почечная недостаточность — состояние, угрожающее жизни.
Симптомы и протекание заболевания
Основные признаки, позволяющие заподозрить ишемическую нефропатию:
- терминальная почечная недостаточность, развившаяся у лиц, не имевших клинических проявлений поражения почек (протеинурия минимальная или отсутствует, скудный мочевой синдром);
- возраст более 60 лет;
- наличие генерализованного атеросклероза;
- частое развитие артериальной гипертонии.
В настоящее время доказано, что ишемическая нефропатия достаточно широко распространена, хотя часто остается не диагностированной.
У больных пожилого и старческого возраста ишемическая нефропатия является одной из ведущих причин нарушения функции почек. Среди больных с терминальной почечной недостаточностью в возрасте старше 50 лет ишемическая нефропатия составляет 15%.
Общепризнанной утвержденной современной классификации ишемических болезней почек в настоящее время не существует. Чаще ишемическую нефропатию классифицируют по 2 критериям:
- скорости прогрессирования почечной недостаточности, выделяя острую (быстропрогрессирующую) и хроническую;
- локализации поражения почечных артерий (артерии почек крупного, среднего и мелкого калибра).
В качестве наиболее частой причины ишемической болезни почек признается атеросклероз, что дало основание выделять отдельно атеросклеротическую форму ишемической болезни почек.
Ишемическая нефропатия: три формы течения болезни
Атеросклеротический процесс, повреждающий почечные артерии, чаше всего затрагивает артерии большого калибра. Поражение почечных артерий может быть полным и частичным.
Что же происходит? При практически полном поражении артерий развивается острая почечная недостаточность с фактическим прекращением кровоснабжения почек. Если же сосуды поражены не полностью, то кровоснабжение почек частично восстанавливается и ишемическая нефропатия прогрессирует не так быстро.
Различают три основных варианта течения ишемической нефропатии:
- острая почечная недостаточность;
- быстропрогрессирующая почечная недостаточность;
- торпидная (вялотекущая) хроническая почечная недостаточность.
Острая почечная недостаточность вызывается внезапным нарушением проходимости сосудов почек и обеднением почечного кровотока. Об этом процессе свидетельствуют следующие признаки — острый подъем артериального давления, лейкоцитоз, лихорадка, интенсивная боль в области почек или спине. Течение острой почечной недостаточности, как правило, малосимптомное.
Закупорка сосудов кристаллами холестерина — основная причина развития быстропрогрессирующей почечной недостаточности при ишемической нефропатии. В патологический процесс, кроме почек, вовлекаются кожа, нервная система, желудочно-кишечный тракт. Признаками, помогающими распознать этот вид почечной недостаточности, являются — быстрый подъем креатинина крови, повышение артериального давления, боль, тошнота, рвота, желудочно-кишечные кровотечения, некроз пальцев стоп, узловатая эритема и другие. Закупорка сосудов кристаллами холестерина подтверждается обнаружением кристаллов в частицах кожи, мышц, многих внутренних органов, — в первую очередь, почек, а также в печени, поджелудочной железе и других органах.
Торпидная (вялотекущая) почечная недостаточность — самый распространенный клинический вариант ишемической нефропатии. Как правило, эта клиническая форма диагностируется лишь при проведении специальных функциональных исследований сосудов (при артериографических исследованиях, использовании дуплексной ультрасонографии и т.д.) или при аутопсии. Вместе с тем важно помнить, что реальность сосудистого поражения почек высока у больных пожилого возраста при выявлении у них генерализованного атеросклероза.
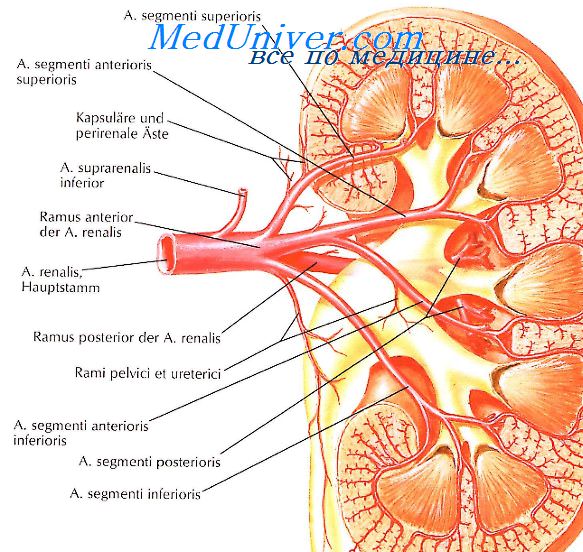
Селективная ишемия почечной паренхимы как альтернатива традиционному пережатию сосудистой ножки при резекции почки
Мосоян М.С. 1 , Аль-Шукри С.Х. 1 , Семенов Д.Ю. 2 , Есаян А.М. 3 , Ильин Д.М. 1
1 Кафедра урологии, 2 кафедра общей хирургии, 3 кафедра нефрологии и диализа ГБОУ ВПО Первого Санкт-Петербургского государственного медицинского университета имени академика И.П. Павлова Минздрава России, г.Санкт-Петербург Адрес: 197022, г.Санкт-Петербург, ул.Льва Толстого, д.6-8., тел. (921) 9632277 Эл.почта: moso03@yandex.ru, al-shukri@spbmedu.ru, semenov_du@mail.ru, essaian.ashot@gmail.com, melker@mail.ru
Введение
Основным методом лечения больных с локализованным почечно-клеточным раком является хирургический [1]. Все больший интерес хирургов вызывают так называемые «функциональные» результаты резекции почки и нефрэктомии [2,3]. Доподлинно известно, что резекция почки и нефрэктомия, выполненные по поводу локализованного почечно-клеточного рака (ПКР), обеспечивают сопоставимую 5-летнюю опухоль-специфическую выживаемость [4,5]. Также было установлено, что резекция почки имеет преимущество перед нефрэктомией в вопросе сохранения функции почки, что выражается в меньшей вероятности развития или усугубления хронической болезни почек (ХБП) [6,7,8]. Состояние клубочковой системы почек после операции может быть оценено на основании данных о скорости клубочковой фильтрации (СКФ) или нефросцинтиграфии. Неоспорим тот факт, что возникновение или прогрессирование ХБП является серьезным предиктором развития у пациента неблагоприятных сердечнососудистых событий: инфаркта миокарда, инсульта, смерти [9,10]. Все последствия операции, за исключением онкологических показателей, являют собой так называемые «функциональные» результаты, над улучшениями которых и работают исследователи, занимающиеся хирургическим лечением ПКР. Как альтернатива существующим способам улучшения почечной функции при резекции почки (контролируемая гипотензия, селективное выделение и клипирование питающих опухоль сосудов, операция без пережатия почечной ножки) нами был предложен способ резекции в условиях селективной паренхиматозной (регионарной) ишемии. Мы разработали и применили на практике 3 инструмента, которые могут быть использованы в ходе открытой, лапароскопической и роботассистированной резекции почки.
Целью работы явилась сравнительная оценка эффективности выполнения резекции почки в условиях регионарной ишемии и в условиях тотальной ишемии с пережатием сосудов почки.
Материалы и методы
В период с января 2011 г. по октябрь 2013 г. на базах ПСПбГУ им.академика И.П.Павлова и ФМИЦ им. В.А.Алмазова нами было выполнено 110 открытых, лапароскопических и робот-ассистированных резекций почек пациентам с почечно-клеточным раком в стадии T1-2N0M0 (таблица).
Таблица. Предоперационные данные
| Показатель | Группа пережатия почечных сосудов (ПС), п=86 | Группа пережатия почечной паренхимы (ПГ1), п=24 | Р |
| Возраст, лет | 56,3±13,1 (18,0-87,0) | 60,2± 10,7 (42,0-76,0) | 0,183 |
| Пол Мужской Женский |
Количество 47(54,7%) Количество 39 (45,3%) |
Количество 13 (54,2%) Количество 11 (45,8%) |
0,966 |
| Локализация Верхний полюс Средний сег мент Нижний ПОЛЮС |
Количество 21 (24,4%) Количество 34 (39,5%) Количество 31 (36,1%) |
Количество 6 (23,0%) Количество 9 (37,5%) Количество 9 (37,5%) |
0,953 |
| Стадия Т,а (ДО 4 СМ) T1b (4-7 см ) T2a (более 7 см) |
Количество 49 (56,9%) Количество 35 (40,8%) Количество 2 (2,3%) |
Количество 13(54,2%) Количество 11 (45,8%) Количество 0 |
0,806 |
| СКФ, мл/мин/1,73м2 | 76,0±12,1 (58,2-94,5) | 74,0± 11,8 (56,3-91,7) | 0,473 |
Пациенты были поделены на группу резекции с пережатием почечных сосудов (группа ПС, 86 пациентов) и группу резекции с пережатием почечной паренхимы (группа ПП, 24 пациента). В обеих группах операции выполняли открытым, лапароскопическим и роботассистированным способами. Основные данные пациентов по группам достоверно не различались. Так, средний возраст составил 56,3 (18,0-87,0) и 60,2 (42,0-76,0) лет для групп ПС и ПП, соответственно (p=0,183). В группе ПС 54,7% пациентов составляли мужчины, в группе ПП мужчин было 54,2%. В обеих группах для установки диагноза и стадирования процесса выполняли МРТ или КТ с внутривенным контрастированием. По данным лучевой диагностики расположение опухолей в паренхиме почки по группам не различалось. Также группы были сопоставимы и по стадиям опухолевого процесса, однако в группе ПС в 2 случаях резекцию почки выполняли на стадии опухоли Т2а, тогда как в группе ПП операции производили только на стадии Т1.
В группе ПС резекции почек выполняли традиционной техникой с полным выключением почки из кровотока путем наложения сосудистого зажима на почечную ножку. Пациентам группы ПП операции осуществляли в условиях регионарной ишемии, когда из кровотока исключался лишь тот участок почечной паренхимы, который содержал в себе опухоль. Для этих целей было использовано 3 разработанных нами зажима на почечную паренхиму (патенты РФ №107471 от 20.08.2011, №118540 от 27.07.2012, №125837 от 20.03.2013, №2011150672 от 27.06.2013), два из которых применяли в ходе открытой (рисунки 1,2), и один – в ходе робот-ассистированной и лапароскопической резекции (рис. 3,4).
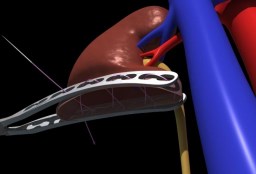
Рис. 1. Зажим Аль-Шукри-Мосояна для открытой резекции почки
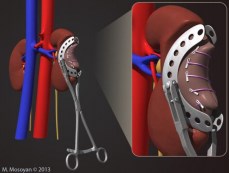
Рис. 2. Зажим Короста-Мосояна для открытой резекции почки
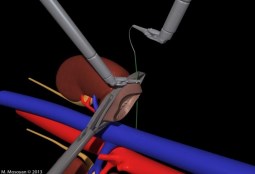
Рис. 3. Зажим Семенова-Мосояна при роботассистированной резекции почки
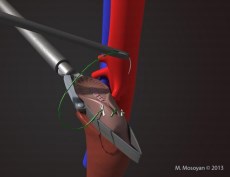
Рис. 4. Зажим Семенова-Мосояна при лапароскопической резекции почки
Оценивали скорость клубочковой фильтрации (СКФ) по формуле CKDEPI до операции, через 24 часа и 1 год после операции. Исходные показатели СКФ по группам достоверно не различались и составляли 76 (58,2-94,5) и 74 (56,3-91,7) мл/мин/1,73 м3 для группы ПС и ПП, соответственно (p=0,473). Изучали также время операции, средний объем кровопотери, время тепловой ишемии (ВТИ, в группе ПС) и длительность селективного пережатия почечной паренхимы (в группе ПП).
Результаты
Средний размер удаленной опухоли был равен 3,4 (1,3-9,0) и 2,8 (2,0-5,6) см для группы ПС и ПП соответственно (p=0,071). Длительность операции по группам достоверно не различалась и составила 118 и 140 мин для группы ПС и ПП, соответственно (p=0,069). Средний объем кровопотери был достоверно ниже в группе ПП: 240 (110-560) мл против 298 (70-700) мл в группе ПС (p=0,047). ВТИ в группе ПС составило 14,4 (8,0-21,9) мин, что превышало длительность селективной ишемии почечной паренхимы в группе ПП (11,8 (7,216,8) мин, p=0,011).
Различия в скорости клубочковой фильтрации были достоверны между группами ПС и ПП как через 24 часа после операции (59 против 70 мл/мин/ /1,73м2 , p=0,0001), так и спустя 1 год наблюдения (50,5 против 65 мл/мин//1,73м2 , p=0,0001) (рисунок 5). Опухоль-специфическая выживаемость в обеих группах за период наблюдения 1 год составила 100%.
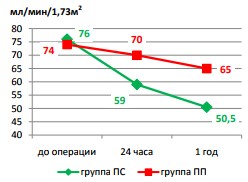
Рис. 5. Динамика СКФ (CKD-EPI) после операции
Обсуждение
Одной из наиболее обсуждаемых тем в сообществе урологов является сохранение почечной функции после резекции почки. С точки зрения «функциональных» результатов на качество резекции может влиять целый ряд факторов, из которых большое значение придается длительности тепловой ишемии [2]. Не существует точного порогового значения ВТИ, ниже которого повреждение почки достоверно не наступает, однако принято считать, что ВТИ менее 20 мин не оказывает существенного влияния на функцию почки [11].
Результаты нашего исследования, напротив, показали, что даже при среднем ВТИ, равном 14,4 мин (группа ПС), снижение почечной функции наступало уже через 24 часа и усугублялось через 1 год. Это позволило нам заключить, что даже относительно непродолжительное ВТИ может сказаться на функциональной способности почек. Наши предположения находят подтверждение в исследованиях Thompson R.H. et al. (2010) и Patel A.R. et al. (2011), которые утверждают, что на отдаленные функциональные результаты резекции почки оказывает влияние каждая минута ишемии [12,13].
Европейские исследователи предлагают ряд способов выполнения резекции почки, которые позволяют исключить тепловую ишемию как фактор, приводящий к худшим функциональным результатам. Одним из таких способов является применение контролируемой гипотензии, при которой системное артериальное давление снижается до 65 mm Hg, что позволяет выполнять резекцию почки без пережатия почечных сосудов с минимально возможной геморрагией [14]. Нельзя не заметить, что при столь низких цифрах АД, особенно в условиях пневмоперитонеума, резко нарушается фильтрация в почечных клубочках. Также могут страдать жизненно важные кислородзависимые органы (сердце, головной мозг), что не позволяет нам считать метод достаточно безопасным.
Более радикальным вариантом этого способа резекции почки является так называемая «беззажимная техника», когда резекция опухоли выполняется без пережатия почечной ножки и при нормальных цифрах АД. Такая процедура неизменно сопровождается значительным, зачастую неконтролируемым, объемом кровопотери из ложа удаленной опухоли [15]. Поэтому способ находит только ограниченное применение при резекции опухолей небольшого размера с преимущественно экзофитным ростом.
Наиболее технически сложным способом выполнить резекцию почки без ишемического повреждения органа является селективная диссекция и клипирование артерий третьего или четвертого порядка, питающих опухоль [16]. Подобные вмешательства могут выполняться в клинике экспертного класса, т.к. требуются значительные навыки работы с сосудами в ограниченном пространстве ворот почки. Для решения таких задач наилучшим образом подходит робот-ассистированный метод резекции почки. Наш опыт применения этого способа резекции подтверждает его эффективность в случаях, когда на этапе предоперационной подготовки по данным МСКТ и МРТ с внутривенным контрастированием визуализируются сосуды третьего и четвертого порядка, питающие опухоль.
Методика селективной паренхиматозной ишемии при резекции почки крайне скупо описана в мировой литературе. Хотя мы предполагаем, что любой опытный хирург в своей практике применял селективную ишемию почечной паренхимы с помощью пальцев рук. В базе данных медицинской литературы PubMed мы находим отдельные работы, в которых авторы описывают наложение различных сосудистых зажимов на паренхиму почки, для того чтобы выполнить резекцию без тотальной ишемии органа [17,18]. Нам не встретилось работ, в которой авторы делились бы опытом применения регионарной ишемии в ходе резекции почки всеми доступными способами: открытым, лапароскопическим и роботассистированным. В малочисленных статьях описан опыт применения специального хирургического зажима Simon (B.Braun, USA) на паренхиму почки [19,20]. В отличие от нашего зажима Семенова-Мосояна для роботассистированных и лапароскопических резекций почки зажим Simon имеет серьезные конструктивные недостатки, которые не позволяют надежно обеспечить гемостаз или избежать соскальзывания. Зажимы Аль-Шукри-Мосояна и Короста-Мосояна, по нашим данным, не имеют аналогов в мире и вместе с роботическим зажимом СеменоваМосояна образуют полноценный набор для выполнения резекции почки без необходимости тотальной ишемии органа. Важной конструктивной особенностью зажима Аль-Шукри-Мосояна является наличие в его браншах специальных отверстий, через которые в зажатом состоянии инструмента возможно наложение непрерывного шва на паренхиматозном органе. К недостаткам лапароскопического инструмента можно отнести то, что использоваться полноценно он может только при опухолях, локализованных в полюсах почки.
В литературе все чаще можно встретить термин «нулевая ишемия» при обсуждении результатов резекции почки. Под этим термином специалисты понимают такие способы выполнения вмешательства, когда на почку не оказывается какого-либо воздействия, приводящего к ишемии даже части органа. К ним относятся описанные выше «беззажимная» техника, техника селективной микродиссекции третичных и четвертичных артерий почки, метод контролируемой гипотензии. Описанный нами подход селективного пережатия почечной паренхимы (селективной паренхиматозной ишемии, регионарной ишемии) скорее всего нельзя в полной мере охарактеризовать как метод «нулевой» ишемии, так как из кровотока временно выключается часть функционирующей паренхимы, окружающей опухолевый узел. Не исключено, что в зоне, которая была подвержена компрессии, возникают изменения, приводящие впоследствии к снижению функциональной активности этого участка паренхимы.
Однако полученные нами результаты динамики СКФ после резекции почки с пережатием сосудов и с пережатием почечной паренхимы позволяют судить о том, что селективная почечная ишемия вызывает меньшее повреждение почечной паренхимы, чем тотальная ишемия почки, и как следствие в большей мере предотвращает развитие и прогрессирование ХБП. Особое значение селективная ишемия паренхимы, как нам представляется, может иметь при резекции единственной (оставшейся) почки.
Данных прямого сравнения регионарной ишемии и «нулевой» ишемии, позволяющих однозначно заявить о преимуществе одного метода над другим, при анализе литературы нами получено не было. Для определения достоверных результатов необходимо накопление большего числа случаев резекции почки в условиях селективной паренхиматозной ишемии, а также требуется проведение рандомизированных сравнительных исследований.
Заключение
Резекция почки в условиях селективного пережатия почечной паренхимы обеспечивает более высокие функциональные показатели, чем классическая резекция с пережатием сосудов почки, сразу после операции и спустя 1 год. Способ селективной (регионарной) ишемии эффективен и легко воспроизводим, и может успешно применяться как при робот-ассистированной, так и при открытой, и лапароскопической резекции почки.
Литература
1. Аляев, Ю.Г. Локализованный и местно распространенный рак почки: нефрэктомия или резекция? / Ю.Г. Аляев, А.А. Крапивин // Онкоурология. – 2005. – Т.№1. – С.10-15.
2. Renal function after partial nephrectomy: effect of warm ischemia relative to quantity and quality of preserved kidney / R.H. Thompson, B.R. Lane, C.M. Lohse et al. // Urology. – 2012. – Vol.79, №2. – P.356-360.
3. Гусев, А.А. Оценка почечных функций и оперативное лечение почечно-клеточного рака / А.А. Гусев, С.В. Евсеев, М.И. Коган // Онкоурология. – 2013. – Т.1. – С.17-23.
4. Novick, A.C. Nephron-sparing surgery for renal cell carcinoma / A.C. Novick // Annu Rev Med. – 2002. – Vol. 53. – P.393-407.
5. Systematic review of oncological outcomes following surgical management of localised renal cancer / S. MacLennan, M. Imamura, M.C. Lapitan et al. // Eur Urol. – 2011. – Vol. 61, №5. – P. 972-993.
6. Systematic review of perioperative and quality-of-life outcomes following surgical management of localised renal cancer / S. MacLennan, M. Imamura, M.C. Lapitan et al. // Eur Urol. – 2012. – Vol. 62, №6. – P.1097-1117.
7. Есаян, А.М. Почечно-клеточный рак и хроническая болезнь почек: внимание к отдаленным неонкологическим исходам / А.М. Есаян, С.Х. Аль-Шукри, М.С. Мосоян // Нефрология. – 2012. – Т.16, №4. – С.94-99.
8. Comparative effectiveness for survival and renal function of partial and radical nephrectomy for localized renal tumors: a systematic review and metaanalysis / S.P. Kim, R.H. Thompson, S.A. Boorjian et al. // J Urol. – 2012. – Vol. 188, №1. – P.51-57.
9. Nephrectomy induced chronic renal insufficiency is associated with increased risk of cardiovascular death and death from any cause in patients with localized cT1b renal masses / C.J. Weight, B.T. Larson, A.F. Fergany et al. // J of Urol. – 2010. – Vol. 183, №4. – P.1317-1323.
10. Muruganandham, K. Chronic kidney disease and small renal tumors: What urologists should know? / K. Muruganandham, A. Mandhani // Indian J Urol. – 2009. – Vol.25, №4. – P.543-544.
11. Assessing the impact of ischaemia time during partial nephrectomy / F. Becker, H. Van Poppel, O.W. Hakenberg // Eur Urol. – 2009. –Vol. 56. – P.625-635.
12. Every minute counts when the renal hilum is clamped during partial nephrectomy / R.H. Thompson, B.R. Lane, C.M. Lohse et al // Eur Urol. – 2010. – Vol. 58. – P.340-345.
13. Patel, A.R. Warm ischemia less than 30 minutes is not necessarily safe during partial nephrectomy: every minute matters / A.R. Patel, S.E. Eggener // Urol Oncol. – 2011. – Vol. 29, №6. – P.826-828
14. Laparoscopic and robotic partial nephrectomy with controlled hypotensive anesthesia to avoid hilar clamping: feasibility, safety and perioperative functional outcomes / R. Papalia, G. Simone, M. Ferriero et al. // J Urol. – 2012. – Vol. 187, №4. – P.1190-1194.
15. Novak, R. Robotic partial nephrectomy without renal ischemia / R. Novak, D. Mulligan, R. Abaza // J Urol. – 2012. – Vol. 79, №6. – P. 1296-1301.
16. Zero ischemia anatomical partial nephrectomy: a novel approach / I.S. Gill, M.B. Patil, A.L. Abreu // J Urol. – 2012. – Vol. 187, №3. – P.807-814.
17. Nephron-sparing surgery for renal tumors using elective parenchymal clamping / F. Denardi, G.M. Borges, W. Silva Jr. et al. // BJU Int. – 2005. – Vol. 96. – P.1036-1039.
18. Efficacy of parenchymal compression in open partial nephrectomies: a comparison with conventional vascular clamping / Y.H. Ko, H. Choi, S.G. Kang et al. // Korean J Urol. – 2010. – Vol. 51. – P.8-14.
19. Laparoscopic partial nephrectomy with selective control of the renal parenchyma: initial experience with a novel laparoscopic clamp / J. Simon, G. Bartsch Jr, F. Finter et al. // BJU Int. – 2009. – Vol. 103, №6. – P.805-808.
20. Whiting, B. Off clamp robotic heminephrectomy: the simon laparoscopic renal pole clamp / B. Whiting, L.-M. Su, A. Yamamoto // J Urol. – 2011. – Vol. 185, №4S. – P.414-415.
Статья опубликована в журнале “Вестник урологии”. Номер №3/2014 стр. 3-10
Ишемия почек: причины возникновения, симптоматика и методы лечебного воздействия

Кабардино-Балкарский государственный университет им. Х.М. Бербекова, медицинский факультет (КБГУ)
Уровень образования – Специалист
ГОУ «Институт усовершенствования врачей» Минздравсоцразвития Чувашии
Среди других видов ишемического поражения внутренних органов ишемия почек занимает одно из ведущих позиций по частоте возникновения, чему способствуют различные внешний и внутренние факторы: врожденные патологии почек, приобретенные и хронические заболевания организма. Симптоматика патологии достаточно характерная, что позволяет своевременно выявить ее и предупредить вероятность усугубления болезни.
Общее описание и патогенез
Ишемическая болезнь почек выражается в ухудшении процесса кровообращения, что приводит к существенному уменьшению количества крови, поступающей в орган, в результате чего нарушается питание почки. Недостаток поступающего кислорода и питательных веществ способны стать причиной ухудшение состояния тканей почки, что при запускании патологического процесса может спровоцировать некроз. Гипоплазия артерий и тканей почки, наследственная предрасположенность к почечной недостаточности, механические воздействия на орган, — всё это может вызвать патологию почки с ухудшением ее кровоснабжения и переходом в ишемию.
Даже незначительное повреждение единственного кровеносного сосуда в почке способно привести к проявлениям ишемического поражения, что становится причиной дальнейшего развития патологии. Патогенез заключается в усилении двустороннего атеросклеротического процесса, который приводит к значительному сужению просвета сосуда. Приводя к постепенному ослаблению скорости движения крови по венам и артериям, атеросклероз и избыток холестерина в крови способны привести к серьезным нарушениям в работе почек, что может спровоцировать недостаточность их работы — это состояние считается опасным как для здоровья, так и для жизни больного.
Быстрота перехода заболевания из начальной стадии в более продвинутую и затем запущенную происходит очень быстро, что следует учитывать при его диагностировании. Методика лечения начальной стадии болезни достаточно проста и высокорезультативна, потому начало лечения должно быть как можно более быстрым с момента выявления патологии почек.

Причины возникновения
Ишемия почки возникает, как было указано выше, по причине значительного ухудшения качества кровообращения, что влечет за собой снижение необходимой интенсивности питания тканей почки кислородом и питательными веществами. Наследственность, предрасположенность к поражениям сосудов почек и общее загрязнение сосудов, выражающееся в развитии атеросклероза, — эти причины наиболее часто являются отправной точкой при возникновении ишемии почек.
Существует также ряд провоцирующих факторов, которые при длительном повторении способны спровоцировать нарушения в процессах кровоснабжения ткани почек. К ним относятся:
- системный васкулит, ухудшающий кровообращение в тканях почек;
- тромбоэмболия;
- гипоплазия артерий почек или аорты;
- фибромускулярная дисплазия кровеносных сосудов в тканях почек.
Перечисленный провоцирующие факторы способны при длительном течении вызывать быстрый переход начальной стадии патологии в более запущенную, когда отмечается затронутость все большего количества тканей почек. Вследствие этого может возникать почечная недостаточность, которая представляет собой реальную опасность для здоровья больного.
Стадии болезни
Различают три основные стадии развития рассматриваемой патологии, каждая из которых имеет свою характерную симптоматику и требует определенного вида лечебного воздействия:
- Хроническая форма, которая имеет минимальное количество явных признаков течения и усугубления болезни. При хронической форме ишемии почек заболевание развивается вяло, выявление его затрудняется вследствие сложности выявления симптомов.
- Острая форма, при которой симптоматика очень явная и позволяет быстро диагностировать текущую патологию. Замедление начала лечебного воздействия чревато развитием осложнений, потому на острой стадии следует как можно быстрее уточнить диагноз и начать лечение, составленное с учетом индивидуальных особенностей организма больного.
- Быстропрогрессирующая форма, которая характеризуется появлением на коже темных синяков и кровоподтеков, возникает ощущение тошноты, позывы к рвоте, отмечается начальная стадия некроза пальцев нижних и верхних конечностей. При анализе крови отмечается изменение ее состава, может резко скакать артериальное давление.

Перечисленные стадии заболевания имеет свои характерные особенности течения, требуют быстрого лечебного реагирования, что позволяет избежать усугубления патологического процесса в тканях почек.
Выявление заболевания наиболее часто происходит в пожилом возрасте, когда отмечается ослабление функции коры надпочечников и накапливаются органические повреждения. Однако в настоящее время начальные стадии все чаще отмечаются и у более молодых людей, потому следует регулярно проходить профилактические осмотры для выявления любых отклонений в тканях почек.
Симптоматика
Наиболее характерными проявлениями ишемического состояния почек, при котором обнаруживаются патологии коры надпочечников, можно считать следующие:
- ощущение сдавливания в области почек, особенно при совершении резких движений;
- тошнота;
- ощущение мурашек и покалывания на коже, особенно в нижних и верхних конечностях;
- образование синяков на коже;
- резкие скачки артериального давления.
Ограничение работы коры надпочечников, которые наиболее часто отмечаются при достижении возраста 55-65 лет, часто сопровождаются изменением состояния тканей почек. Потому контроль собственного состояния здоровья позволяет вовремя выявить как патологии коры надпочечников, так и негативные изменения в работе почек и состоянии их тканей.

Диагностирование и методы лечебного воздействия
Выявление ишемического состояния почек и нарушения в функционировании коры надпочечников может осуществляться как с помощью ряда лабораторных методов диагностики, так и инструментальными методиками исследования.
К лабораторным вариантам исследования работы почек и степени поражения их тканей относятся:
- исследования анализа крови — биохимический и общий анализы;
- анализ мочи (плюс анализ мочи по Зимницкому);
- липидограмма;
- соотношение количества эритроцитов к плазме крови.
Инструментальными методами выявления ишемического состояния являются следующие:
- ультразвуковое исследование грудной клетки и области почек;
- электрокардиограмма;
- эхокардиоскопия;
- допплеровское исследование почек.
Перечисленные анализы назначаются после прохождения хирурга, нефролога, терапевта, а также окулиста. Комплексное обследование позволяет получить наиболее полную картину текущего заболевания и составить схему лечебного воздействия, которая будет особенно результативной.
Лечение и профилактика
Поскольку наиболее часто данная патология почек выявляется при поздних стадиях заболевания ввиду практически полного отсутствия симптоматики на ранних стадиях процесса в тканях почек, лечение заключается в устранении последствий почечной недостаточности.
Медикаментозное лечение приносит выраженный положительный результат при использовании прописанных врачом-нефрологом препаратов на ранней стадии болезни. К наиболее часто применяемым медикаментозным препаратам при диагностировании любой стадии ишемического процесса в почках относятся средства, нормализующие функцию почек, устраняющие застойные явления в них и стимулирующие кровообращение в тканях почек.
При необходимости хирургического вмешательства применяется создание окольного пути кровоснабжения почка, а при стенозе сосуда в ткани почки используется операция по устранению стента.
В качестве профилактики такой патологии, как ишемическое поражение почек, следует назвать исключение таких провоцирующих факторов, как избыток соленых, копченых, острых блюд в питании, отказ от вредных привычек в виде курения и чрезмерно активного употребления алкогольных напитков, приема мер по сбросу лишних килограммов. Регулярный осмотр у врачей, внимательное отношение к собственному здоровью позволяет предупредить усугубление любой патологии почек, не допустить перехода заболевания в более запущенную стадию.
Ишемия и инфаркт почки

Лечение инфаркта почки подразумевает госпитализацию
Инфаркт почки развивается на фоне эмболии (закупорки) ренальных сосудов, что инициирует некротизацию тканей и утрату функциональных способностей органа. Резкое прерывание почечного кровотока и отсутствие адекватного коллатерального кровоснабжения – основные причины патологии. Клинические проявления вариативны и коррелируют со степенью выраженности процесса: от полного отсутствия жалоб до острых болей в животе и поясничной области на стороне поражения, тошноты и рвоты, макрогематурии, повышения кровяного давления и прогрессирования почечной недостаточности. Диагноз устанавливают на основании данных, полученных с помощью оценки анамнеза, анализов крови и мочи, биохимии, ультразвукового исследования почек с допплерографией (УЗДГ), ренальной ангиографии, МРТ, КТ. Лечение включает антиагрегатные и антикоагулянтные препараты, иногда выполняют оперативные вмешательства, направленные на нормализацию кровообращения и купирование явлений ишемии.
Инфаркт почки – нефрологическая патология, регистрируется редко и в большинстве наблюдений является осложнением какого-либо сердечно-сосудистого заболевания. Статистические данные противоречивы, поскольку в 25% из-за отсутствия выраженных проявлений пациенты не обращаются за медицинской помощью, а имеющиеся симптомы напоминают таковые при остром пиелонефрите, нефролитиазе, опухоли и пр. Результаты аутопсий показывают, что заболеваемость составляет от 0,5 до 1,5%. Почечный инфаркт может охватывать всю почку или небольшие участки коркового или мозгового слоя. Некротизации почечной ткани в результате острой ишемии более подвержены возрастные больные, страдающие обменными нарушениями, сердечно-сосудистыми заболеваниями, имеющие вредные привычки (курение) и лишний вес.
Причины инфаркта почки
Инфаркт почки в большинстве наблюдений является осложнением какого-либо сердечно-сосудистого заболевания
Основными причинами, приводящими к инфаркту почки, рассматривают эмболию магистральных почечных сосудов и тромбоз. К патологиям, которые сопровождаются эмболообразованием, относят:
• Эндокардит. Воспалительный процесс во внутренней оболочке левого желудочка либо предсердия сопровождается синтезированием тромботической массы, фрагменты ее могут попадать в большой круг кровообращения с закупоркой просвета ренальных артерий.
• Нарушения сердечного ритма и пороки сердца. Мерцательная аритмия вызывает нарушение гемодинамики, что осложняется тромбообразованием. Аналогичные сосудистые изменения встречаются также и при недостаточности митрального клапана, пролапсе створок.
• Атеросклеротическую болезнь. Массивный атеросклероз крупного сосуда – аорты или венечных артерий рассматривают в качестве наиболее распространенной причины ренального инфаркта. Атеросклеротическое поражение сосудов почки при прогрессировании заболевания осложняется расслоением стенок, что изменяет диаметр просвета и приводит к острой ишемии.
• Узелковый периартериит. Этиология данного патологического процесса изучена недостаточно, но известно, что нарушения в сосудистой сети почки могут стать причиной инфаркта.
• Врачебные манипуляции. Во время диагностических процедур или операций на органах системы мочевыделения иногда происходит травматизация с последующим стенозированием сосудов, что инициирует ишемию почечной ткани. Подобные изменения регистрируют у лиц, употребляющих инъекционные формы наркотических препаратов (опиоиды, эфедрин). При несоблюдении правил асептики и антисептики и использовании нестерильного инструментария может развиться эндокардит, для которого типично многочисленное тромбообразование.
• ДВС-синдром (диссеминированное внутрисосудистое свертывание крови) затрагивает и почечные артерии. При выраженном процессе выявляют множественные очаги некроза в почечной паренхиме.
Тромбоз почечной артерии может произойти на фоне:
• Атеросклероза и фибромышечной дисплазии. При атеросклерозе поражаются артерии на фоне нарушения липидного и белкового обмена, типично отложение холестерина и фракций липопротеидов в просвете сосудистой стенки. Фибромышечная дисплазия характеризуется неатеросклеротическими невоспалительными изменениями артерий с формированием стеноза, окклюзии или аневризмы.
• Травмы. Посттравматические повреждения почечных артерий составляют от 1% до 4% всех непроникающих травм живота. Классически травма почки является следствием падения с большой высоты при вертикальной посадке при ударе. Это приводит к растяжению почечных артерий, поскольку почки продолжают опускаться после остановки остальной части тела. Последующее растяжение и откат почечных артерий могут привести к острому тромбозу, который чаще двусторонний. Прямая тупая травма поясницы или боковых областей, связанная с автомобильными авариями, уличными драками и спортивными травмами, также может привести к тромбозу почечной артерии.
• Установки эндоваскулярных стентов, пересадки почки.
• Гиперкоагуляционных расстройств. Нарушения свертывания крови – дефицит белка C или S, антитромбина III, повышение уровня фактора VIII и лейденские мутации фактора V могут предрасполагать к тромбозу почечных артерий и инфаркту в дополнение к их ассоциации с тромбозом почечной вены. Гиповолемия, полицитемия и использование оральных контрацептивов увеличивают риск тромбообразования при наличии этих основных расстройств.
• Антифосфолипидного синдрома. Синдром антифосфолипидных антител связан как с артериальными, так и с венозными тромботическими явлениями и может включать почечное кровообращение на любом уровне. У пациентов моложе 50 лет АФС является причиной 15-20% всех глубоких венозных тромбозов и 30% от инсультов.
• Злокачественного новообразования почки. По данным исследований, инвазию рака почки в просвет почечной вены регистрируют в 25-30% случаев. Тромбоз почечной вены также выявляют при нефротическом синдроме.
Патогенез
Основное звено патогенеза – закупорка сосудов, питающих почку (чаще – артерии с развитием ишемического инфаркта). Недостаток кислорода и питательных веществ вызывают дистрофические изменения. Нефроны – структурные единицы органа мочевыделения – отмирают, что приводит к зонам некроза. Чем больше калибр пораженного сосуда, тем серьезнее последствия. Ангиотензин 2 начинает вырабатываться в усиленном режиме, что вызывает стойкую нефрогенную гипертензию. Следствием повышения артериального давления могут развиться инфаркт миокарда или инсульт. Продукты распада из зон некротизации поступают в системный кровоток и вызывают интоксикацию. При относительно сохраненном кровообращении почки формируется рубец, но если коллатеральные сосуды не взяли на себя функции питания, а катастрофа произошла в почечной артерии или вене, может наступить гибель всего органа.
Симптомы инфаркта почки

Внезапная боль в поясничной области у пациента с предрасполагающими патологиями к инфаркту почки – повод для обращения за медицинской помощью
Наиболее распространенные клинические проявления включают боль в пояснице, боку или животе, сопровождаемые тошнотой и рвотой. Иногда в моче невооруженным взглядом различима кровь, реже встречается профузное почечное кровотечение, более характерное для геморрагического инфаркта. При закупорке сгустком или некротизированной массой мочеточника развивается классическая почечная колика: болевой синдром возможно купировать приемом наркотических анальгетиков.
Повышение температуры отмечают у 30% пациентов. До четверти случаев инфаркта почки протекают бессимптомно и выявляются при проведении исследований. Артериальная гипертензия может возникать вследствие внезапного выброса ренина из пораженного сегмента. Когда происходит двусторонняя окклюзия обеих почечных артерий или инфаркт единственной функционирующей почки, у пациента появляется олигурия или анурия, что является признаком острой почечной недостаточности.
Вышеописанные жалобы сочетаются с симптомами основного заболевания, например, перебоями в работе сердца, загрудинной болью, цианозом.
Диагностика инфаркта почки

Во время беседы с пациентом врач выясняет заболевания, способные вызвать ишемию почки
Диагностика основана на оценке анамнеза, лабораторных данных и результатов визуализационных способов обследования.
Лабораторные данные
В общем анализе крови обнаруживают лейкоцитоз, в моче – большое количество эритроцитов и белка. Повреждение тканей приводит к повышению уровня сывороточных ферментов, чаще всего лактатдегидрогеназы, но трансаминазы, креатинкиназа и щелочная фосфатаза также могут превышать норму. О почечной недостаточности свидетельствует азотемия.
Исследования визуализации
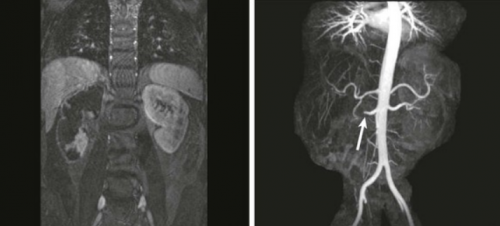
Визуализация участка ишемизированной ткани – признак инфаркта почки. МРТ с контрастированием гадолинием и магнитно-резонансная ангиография демонстрируют почти тотальный инфаркт правой почки с сохранением части нижнего полюса. Стрелка указывает на отсечение правой почечной артерии за счет тромбоза или эмболии
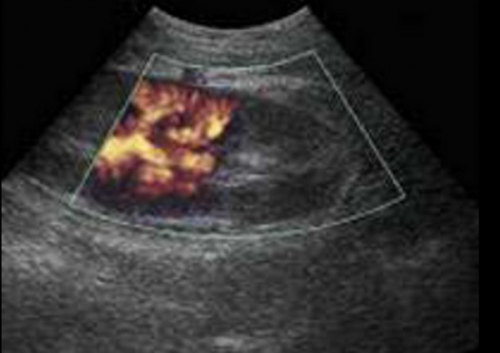
УЗДГ: отсутствие кровотока в левом полюсе органа
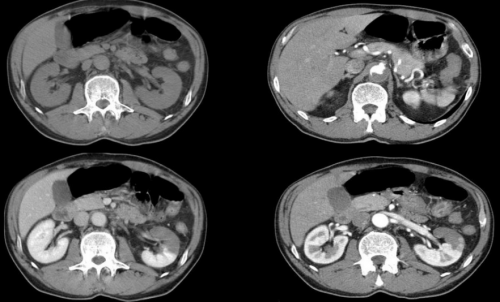
КТ6 инфаркт левой почки
Поскольку симптомы инфаркта почки являются общими для ряда патологических состояний, для постановки диагноза требуется расширенное обследование. Оценка пациента подразумевает исключение/подтверждение явного инфаркта почки и определение жизнеспособности паренхимы. Это может быть достигнуто с помощью:
• артериографии;
• компьютерной ангиографии (CTA);
• компьютерной томографии с контрастным усилением (CT);
• магнитно-резонансной ангиографии (MRA) с введением гадолиния;
• радиоизотопной сцинтиграфии.
Диагностический подход сложен в условиях снижения почечной функции из-за нефротоксичности радиоконтрастного красителя. Использование гадолиния при магнитно-резонансной томографии противопоказано, если скорость клубочковой фильтрации (СКФ) ниже 30 мл / мин из-за риска нефрогенного системного фиброза.
УЗИ почек с допплерографией показывает зону повышенной эхогенности с отсутствием кровотока и является первоначальным способом обследования.
Дифференциальный диагноз проводят с:
• нефролитиазом;
• расслоением стенки брюшной аорты;
• новообразованиями органов мочевыделения (рак ЧЛС, мочеточника, мочевого пузыря, уретры);
• гломерулонефритом.
Лечение
Терапию пациента с инфарктом почки проводят одновременно нефролог, кардиолог, сосудистый хирург
Тактика ведения включает оценку рисков в сравнении с потенциальными выгодами от реваскуляризации: обязательно смотрят состояние контрлатеральной почки и общую остаточную функцию органов мочевыделения. Размер и базовая функция поврежденной почки перед тромбоэмболическим осложнением влияют на пользу от восстановления проходимости сосуда. Если ишемия существовала длительно, успешность операции под вопросом. Необходимо учитывать риск нарушения сердечной деятельности от анестезии и хирургической тромбэктомии или шунтирования. Операцию откладывают до тех пор, пока состояние пациента не восстановится после инсульта, острого повреждения почек, декомпенсированной застойной сердечной недостаточности, инфаркта миокарда и неконтролируемой гипертензии. Реваскуляризация почечной артерии может быть достигнута эндоваскулярным тромболизисом, ангиопластикой и стентированием или хирургическим подходом. Вмешательства успешны в восстановлении почечной функции даже у пациентов с диализ-зависимой почечной недостаточностью, вызванной окклюзионным реноваскулярным заболеванием. Чрескожная тромболитическая терапия и ангиопластика почечной артерии восстанавливают перфузию и функциональную способность органа.
В случае ренального инфаркта следует искать генез нарушения кровообращения, чтобы определить, является ли он эмболическим или тромботическим. Лечение самого инфаркта чаще консервативное, в зависимости от клинической ситуации включает назначение:
• обезболиваюших препаратов;
• гипотензивных средств;
• тромболитиков (при условии отсутствия гематурии);
• гемостатиков;
• антикоагулянтов и антиагрегантов.
Цели лечения связаны с этапом патологии. Первоначальная задача – попытка восстановления кровотока, в последующем – купирование гематурии, борьба с интоксикацией и сохранение функциональных возможностей почки. Некоторые лекарства обладают противоположными свойствами (например – антикоагулянты и гемостатические средства), поэтому необходима определенная осторожность в назначении и постоянный контроль коагулограммы.
Если окклюзия почечной артерии вызвана тромбозом, связанным с гиперкоагуляционным состоянием, или эмболией из центрального источника, показана системная антикоагуляционная терапия. Когда эмболия приводит к инфаркту почки или окклюзии почечной артерии, поиск первопричины включает оценку мерцательной аритмии, болезней сердца, предсердий и поражения клапанов. За исключением случаев септической эмболии, антикоагуляция показана для предотвращения рецидивов.
Травматическая окклюзия почечных сосудов приводит к инфаркту почек в течение 3-6 часов. Попытки восстановления адекватного кровоснабжения в этих обстоятельствах часто оказываются безуспешными, если только диагноз не ставится сразу после поступления пациента, и клинически возможна неотложная операция по реваскуляризации почки.
Тромбоз атеросклеротических ренальных артерий в большинстве наблюдений приводит к выраженной ишемии, но не к инфаркту почки, что делает возможным выполнение хирургической и – иногда чрескожной эндоваскулярной реваскуляризации для восстановления функциональной способности.
Тотальный инфаркт почки, профузное кровотечение, не поддающееся медикаментозной терапии, – показания к нефрэктомии.
Почечная ишемия – причины, симптомы, лечение
 Ишемией или ишемической невропатией почек называется группа болезней, которые вызываются недостаточным кровоснабжением почек. Это название возникло еще в 1988 году, но сама болезнь еще не была хорошо изучена. В настоящее время уже установлена причина недуга – атеросклероз, который может спровоцировать нарушение проходимости больших сосудов, именно через них в почку попадает кровь. Ишемия представляет собой почти бессимптомное заболевание. Но все-таки по некоторым признакам можно узнать о ее существовании. Чаще всего недуг характерен для людей в возрасте.
Ишемией или ишемической невропатией почек называется группа болезней, которые вызываются недостаточным кровоснабжением почек. Это название возникло еще в 1988 году, но сама болезнь еще не была хорошо изучена. В настоящее время уже установлена причина недуга – атеросклероз, который может спровоцировать нарушение проходимости больших сосудов, именно через них в почку попадает кровь. Ишемия представляет собой почти бессимптомное заболевание. Но все-таки по некоторым признакам можно узнать о ее существовании. Чаще всего недуг характерен для людей в возрасте.
Причины
При двухстороннем развитии атеросклероза возникает нарушение поступления объема крови в почки, поэтому появляется ишемия, которая приводит к нарушению работы органа. Еще одной причиной может стать травма аорты в брюшной полости или повреждение больших и малых почечных артерий. Это может спровоцировать полную закупорку сосудов, впоследствии которой полностью прекращает поступать кровь в почки, затем останавливаются процессы выведения из организма токсинов и продуктов жизнедеятельности. Почечная ишемия может привести к острой почечной недостаточности, которая может спровоцировать проблемы со здоровьем.
Одной из причин заболевания может стать непредвиденная реакция человеческого организма на лечение стеноза почек. При хронической недостаточности почек назначают противовоспалительные или антибактериальные препараты, а при явно выраженном стенозе почки назначают обширное гипотензивное лечение.
Спровоцировать ишемическую нефропатию может закупорка почечной артерии кристаллами холестерина, а если сосуды перекрываются полностью, то это может вызвать полную остановку кровоснабжения почки, развитие почечной патологии может привести к летальному исходу. В этот процесс могут вовлекаться другие органы, и тогда появляются симптомы, которые напоминают системный васкулит.
К факторам риска можно также отнести травмы сосудов, закупорка сосудов, тромбоз.
Симптомы
В зависимости от скорости протекания болезни, различают три вида ишемии почек:
- хроническая недостаточность, которая проявляется вялотекущим процессом;
- прогрессирующая форма;
- острая форма возникает в том случае, если уже на фоне существующего стеноза сосудов, происходит нарушение проходимости, закупорка сосудов развивается постепенно и может проявить себя в любой момент.
Хронический или вялотекущий процесс заболевания еще называют торпидным. Этот вид патологии чаще всего встречается при ишемии почек, и его очень тяжело определить, так как он с трудом поддается диагностике. Для этого нужно применить специальные методы обследования состояния сосудов.
Основными симптомами закупорки сосудов являются:
- резкие болевые ощущения в животе (в области почек) и в зоне поясницы;
- беспричинные скачки артериального давления (обычно в сторону увеличения);
- увеличение температуры тела;
- изменения в результатах анализов крови, увеличивается скорость оседания эритроцитов, повышается концентрация лейкоцитов, происходят изменения в остальных показателях крови и анализах мочи.
При таком незначительном признаке заболевания, как уменьшение выделения мочи, человек не проявляет никакого беспокойства, поэтому не спешит идти в больницу.
Если ишемия почек развивается стремительными темпами, то симптомы могут проявляться и на других органах:
- для кожи характерно возникновение цианоза (изменяется цвет кожи), появление некроза на пальцах стоп, узловая эритема, сетчатое ливедо;
- для нервной системы характерно нарушение проводимости, парестезия, в некоторых случаях – паралич;
- симптоматика желудочно-кишечного тракта представлена тошнотой, рвотой, болевыми ощущениями в животе, кровотечениями в желудке и кишечнике;
- для почек характерно повышение количества креатинина в крови, скачки артериального давления.
Диагностика
Чтобы подтвердить предполагаемый диагноз, в медицине применяются специальные методы исследования функции почек, которые помогают определить, в каком состоянии находятся почечные ткани и сосуды, а также измеряют кровоток, степень почечного кровоснабжения.
К таким методам относятся:
- спиральная компьютерная ангиография.
- радиоизотопная ренография почек с введением каптоприла;
- дуплексная ультрасонография.
Диагностическое обследование в большинстве случаев (85-100%) дают точный и определенный результат.
Лечение
Так как диагноз подтверждается уже на этапе четко выраженных симптомов, которые свидетельствуют о развитии почечной недостаточности, то для улучшения работы почек, в первую очередь, проводят курс по очищению крови. Но этот метод не устраняет саму причину заболевания, для этого нужно улучшить кровоснабжение.
Основным методом лечения является хронический гемодиализ, который представляет собой метод очищения крови при разных видах недостаточности. В данном случае используется аппарат “искусственная почка”. Также уместным будет оперативный метод лечения, который называется реваскуляризация почек.
Если диагноз установлен вовремя и болезнь еще не начала прогрессировать, а в почках изменения еще незначительные, то чтобы устранить стеноз артерий применяют хирургический метод, а новые технологии позволяют использовать баллонную ангиопластику и установку стентов при коррекции стенозов.
Чтобы замедлить прогрессирование развития почечной недостаточности, больному назначают курс лечения медпрепаратами.
Итак, осложнения, вызванные ишемией, почки все равно остаются тяжелыми и без надлежащего лечения, могут спровоцировать смертельный исход.