Энзимодиагностика инфаркта миокарда
Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. В этом разделе мы остановимся на основных принципах энзимо- диагностики и энзимотерапии.
Кроме того, ферменты используют в качестве специфических реактивов для определения ряда веществ. Так, глюкозооксидазу применяют для количественного определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче. С помощью различных дегидрогеназ обнаруживают соответствующие субстраты, например, пируват, лактат, этиловый спирт и др.
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы эн- зимодиагностики основаны на следующих позициях:
• при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
• количество высвобождаемого фермента достаточно для его обнаружения;
• активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
• ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
• существуют различия во внутриклеточной локализации ряда ферментов.
1. Причины, приводящие к увеличению количества ферментов в крови
Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например, о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например, при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности выводиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изоферментами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой — изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Изоформы лактатдегидрогеназы. Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (см. раздел 7).

Лактатдегидрогеназа — олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ. muscle — мышца) и Н (от англ. heart — сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 — в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
• Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2-35, Б).
Рис. 2-35. Изоформы лактатдегидрогеназы. А — строение различных изоформ ЛДГ; Б — распределение на электрофорег- рамме и относительные количества изоформ ЛДГ в различных органах; В — содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы — слева и фотометрическое сканирование — справа).

• Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ1 и ЛДГ2 (Н-типы) — в аэробных, когда пируват быстро окисляется до СO2 и Н2O, а не восстанавливается до молочной кислоты.
• При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170 — 520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
• Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифических изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:

Молекула КК — димер, состоящий из субъединиц двух типов: М (от англ. muscle — мышца) и В (от англ. brain — мозг). Из этих субъединиц образуются 3 изофермента — ВВ, МВ, ММ. Изофермент ВВ находится преимущественно в головном мозге, ММ — в скелетных мышцах и МВ — в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Рис. 2-36. Структура и электрофоретическая подвижность различных изоформ креатинкиназы.

Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
Рис. 2-37. Изменение активности ферментов в плазме крови при инфаркте миокарда.

3. Энзимодиагностика при инфаркте миокарда
Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы — ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис. 2-37. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы МВ, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови — основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5 — 40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4 — 6 ч; максимум активности наблюдают в течение 2 — 3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3 — 4-й день, затем наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
Б. Применение ферментов в качестве лекарственных средств
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногенности. Тем не менее энзимотерапию активно развивают в следующих направлениях:
• заместительная терапия — использование ферментов в случае их недостаточности;
• элементы комплексной терапии — применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.).
В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитов.
Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани) (см. раздел 8).
Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов:

Предпосылкой антилейкемического действия аспарагиназы послужило обнаружение в лейкозных клетках дефектного фермента аспарагин- синтетазы, катализирующего реакцию синтеза аспарагина (см. схему ниже).

Лейкозные клетки не могут синтезировать аспарагин и получают его из плазмы крови. Если имеющийся в плазме аспарагин разрушать введением аспарагиназы, то в лейкозных клетках наступит дефицит аспарагина и в результате — нарушение метаболизма клетки.
Биологическая библиотека – материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2018-2020 Все права на дизайн сайта принадлежат С.Є.А.
Диагностика инфаркта миокарда — методы диагностики

Инфаркт миокарда — клиническая форма ишемической болезни сердца. Характеризуется развитием некротических процессов в сердечной мышце вследствие недостаточного кровообращения. Диагностика инфаркта миокарда основывается на выявлении ишемии. Включает в себя субъективные и объективные методы. К последним относят лабораторные и инструментальные исследования.
Опрос больного
Течение, форма и локализация инфаркта миокарда определяют симптомы, с которыми пациент обратиться за медицинской помощью. Сбор жалоб и анамнеза заболевания — первое, к чему прибегает специалист.
К основным признакам инфаркта относят:
- Жалобы пациента на боли за грудиной. Болевой синдром может проявляться по-разному. Некоторые пациенты испытывают сильные боли в грудной клетке с иррадиацией в левую лопатку и руку, а другие переносят безболевую форму заболевания. Это может быть обусловлено сахарным диабетом.
- Тошнота, рвота.
- Нарушения сознания (в некоторых случаях — его потеря).
- Одышка, появление непродуктивного кашля.
При атипичных формах инфаркта миокарда клиническая картина затрудняет его диагностику. Необходима дифференциация с другими заболеваниями.
После оказания первой помощи и стабилизации состояния пациента важно установить факторы риска заболевания и расспросить о возможных сердечно-сосудистых заболеваниях у родственников.
К факторам риска, которые могут способствовать развитию инфаркта миокарда, относят:
- психоэмоциональный стресс на протяжении длительного времени;
- вредные привычки (курение, злоупотребление алкоголем);
- артериальная гипертензия;
- сахарный диабет;
- избыточная масса тела;
- гиподинамический образ жизни;
- определенные пищевые привычки (жирная, жареная, высококалорийная пища);
- атеросклеротическое поражение сосудистых стенок различной локализации.
Осмотр
При внешнем осмотре пациента, у которого подозревают ишемическое поражение сердечной мышцы, может наблюдаться:
- повышенная потливость;
- кожные покровы и видимые слизистые оболочки бледные;
- яремные вены расширены;
- при пальпации грудной клетки отмечается ее повышенная чувствительность;
- возможно появление цианоза;
- беспокойное поведение.
При измерении артериального давления может быть выявлена гипертензия. При этом прощупываемый на лучевой артерии пульс нитевидный, а при аускультации возникают дистантные шумы.
У большинства пациентов с инфарктом миокарда возникает четвертый тон сердца. Он появляется в позднюю фазу диастолы желудочков.
Изменение формулы крови и температура тела
Инфаркту миокарда свойственны изменения и со стороны крови. В клиническом анализе наблюдается увеличение количества лейкоцитов, то есть лейкоцитоз. Также может наблюдаться сдвиг формулы влево и анэозинофилия.
Выраженный лейкоцитоз — неблагоприятный клинический признак.
Изменение кожной температуры в сторону ее снижения может наблюдаться при развитии острой сердечной недостаточности. Более всего это явление характерно для верхних и нижних конечностей — кисти и стопы.
Однако при крупноочаговом расположении инфаркта наблюдается повышение температуры тела. Оно наблюдается к концу первого дня заболевания, держится в субфебрильных цифрах и сохраняется таким образом на протяжении 3-5 дней.
Коронарография
Коронарографию принято проводить совместно с чрескожным коронарным вмешательством (ЧКВ). Желательно, чтобы эти исследования проводились в кратчайшие сроки от начала развития острого инфаркта миокарда. Они позволяют врачу не только удостовериться в выставленном диагнозе, но и используются в качестве наиболее эффективного метода лечения. Коронарография обладает низкими показателями заболеваемости и смертности. Отличается долгосрочными результатами.
Чрескожное коронарное вмешательство — метод, который подразумевает под собой ангиопластику с установлением стентов.
Показания к проведению коронарографии (после начатого медикаментозного лечения):
- сохранение ишемии миокарда, которая подтверждается данными электрокардиографии и клинической картиной;
- гемодинамика нестабильного течения;
- нарушения ритма со стороны желудочков.
Электрокардиография
На электрокардиографии могут быть выявлены:
- аритмии;
- экстрасистолии;
- фибрилляция предсердий.
ЭКГ — наиболее информативный метод, который должен быть сделан в первые 10 минут от момента поступления пациента в клинику.
ЭКГ признаки, свидетельствующие о развитии ишемического процесса в сердечной мышце:
- элевация (подъем от изолинии) сегмента ST более чем на 1 мм в двух и более отведениях;
- наличие патологических зубцов Q (не обязательный критерий — в клинике выделяют инфаркт миокарда без патологического зубца Q).
Электрокардиография должна проводиться пациенту в динамике: через каждые 8 часов в первые сутки заболевания (в 15 отведениях), а далее — ежесуточно. Это позволяет в дальнейшем подтвердить выставленный пациенту диагноз.
Лабораторные анализы
Лабораторные данные, как и инструментальные, являются ключевыми в установлении диагноза.
Общеклинические анализы крови и мочи
Для инфаркта миокарда не специфичны изменения в общем анализе мочи. Они могут появиться при наличии тяжелых осложнений, развившихся на фоне того или иного сердечноо-сосудистого заболевания, которое сопровождается повреждением почек.
В общем анализе крови при инфаркте миокарда выявляют:
- анемию (снижение эритроцитов, гемоглобина);
- повышение СОЭ, что свидетельствует о воспалительном процессе в организме;
- лейкоцитоз.
Кардиоспецифические маркеры
К кардиоспецифическим маркерам относят:
- миоглобин (нормализуется через 24 часа от момента начала заболевания);
- креатинфосфокиназа фракции МВ;
- лактатдегидрогеназа;
- аспартатаминотрансфераза.
Они используются для разграничения нестабильной стенокардии и мелкоочагового инфаркта миокарда.
Тропониновый тест
Тропонины Т и I относятся к ферментам «быстрого реагирования», которые оказываются в кровотоке уже в первые часы некроза миокарда. Отрицательный тропониновый тест в начале появления загрудинных болей и через 12 часов позволяет исключить инфаркт и диагностировать у больного нестабильную стенокардию.
Незначительное повышение тропонинов через 6-12 часов после появления блей расценивается как клинический признак инфаркта миокарда даже при отсутствии данных ЭКГ и характерных симптомов.
Биохимические анализы на маркеры некроза сердечной мышцы
К маркерам повреждения сердечной мышцы относят:
- кардиоферменты (КФК-МВ);
- клеточное содержимое (тропонин Т и I, миоглобин).
Они обнаруживаются в системном кровотоке в различное время от момента начала некротических процессов. Чувствительность и специфичность маркеров к ним различается. В настоящее время предпочтительно полагаться на значения тропонинов, поскольку им свойственна более высокая чувствительность при ишемии кардиомиоцитов.
Повышенная концентрация тропонинов должна соотноситься с клинической картиной, которая складывается из:
- жалоб пациента;
- наличии факторов риска;
- данных объективного осмотра;
- данных ЭКГ.
Тропонин T, I и миоглобин оказываются в системном кровотоке при развитии некроза в кардиомиоцитах.
Ферментная диагностика ИМ
Энзимодиагностика инфаркта миокарда основывается на следующих ферментах и изоферментах.
1. Основные маркеры:
- ЛДГ (лактатдегидрогеназа);
- АСТ;
- КК (креатинкиназа);
- Фракция МВ изофермента КК;
- Миоглобин;
- Тропонины T и I.
2. Дополнительные ферменты:
- Изоформы МВ-КК;
- Легкие и тяжелые цепи миозина;
- Гликогенфосфорилаза;
- Карбоангидраза III.
Рентгенография органов грудной клетки
Проведение рентгенографии органов грудной клетки рекомендовано всем пациентам, поступившим в стационар с подозрением на инфаркт миокарда. При этом исследовании обращается внимание на органы грудной клетки, их расположение и размеры. Диагностическая ценность рентгенографии состоит в ее способности выявлять застойные явления в малом кругу кровообращения. Физикальные методы в данном случае бессильны.
УЗИ сердца (эхокардиография)
Эхокардиография — инструментальный метод, позволяющий исследовать морфологические и функциональные изменения со стороны сердца и его клапанов, а также объем его полостей и движение по ним крови. Значение УЗИ сердца состоит не только в его возможности диагностировать инфаркт миокарда, но и выявить возможные осложнения. К ним принято относить следующие:
- разрыв сердца;
- тромботические процессы;
- перикардит;
- расслоение аорты;
- тромбоэмболия легочной артерии (ТЭЛА).
Радиоизотопные методы
К радиоизотопным методам относят метод сцинтиграфии, который основан на способности пирофосфата (технеция) аккумулировать в ишемизированной ткани. Повышенная концентрация этого вещества наблюдается через 12 часов от момента начала заболевания и сохраняется на протяжении двух недель.
Сцинтиграфия используется в качестве дополнительного метода верификации наркотических изменений в миокарде, когда имеются затруднения в интерпретации полученных пленок электрокардиографии.
МРТ и мультиспиральная компьютерная томография
Магнитно-резонансная томография нашла применение в качестве альтернативного лучевым методам исследования. При нем используется контрастное вещество (гадолиний). Во время теста выявляются зоны ишемизированного миокарда, а в дальнейшем отслеживаются его рубцовые изменения.
Метод отличается безопасностью и высокой информативностью.
Дифференциальная диагностика
Дифференциация инфаркта миокарда проводится со следующими заболеваниями:
- расслоение аорты;
- тромбоэмболия;
- острый перикардит;
- пневмоторакс;
- межреберная невралгия;
- заболевания со стороны желудочно-кишечного тракта (пищевод, желудок, двенадцатиперстная кишка).
| Инфаркт миокарда | Стенокардия | ТЭЛА | Перикардит | |
| Характер боли | Давящая, жгучая. Может иметь иррадиацию в область шеи, нижнюю челюсть, живот | Давящая, жгучая. Может быть иррадиация в нижнюю челюсть, правую и левую руку, спину | Тупо характер боли | Колющая, давящая боль |
| Локализация болей | За грудиной | За грудиной | По боковым поверхностям грудной клетки, а в некоторых случаях — за грудиной | За грудиной |
| Особенности анамнеза заболевания | Наследственный фактор + факторы риска, ассоциированные с сердечно-сосудистыми заболеваниями | Наследственный фактор + факторы риска, ассоциированные с сердечно-сосудистыми заболеваниями | Нарушение целостности ксотных структур (переломы), тромбофлебиты, злокачественные процессы | Бактериальные инфекции, ОРВИ и грипп |
| Дополнительные симптомы | Одышка, бледность кожных покровов, тахикардия, холодной и липкий пот, головокржение и поетря сознания, тошнота и рвота | Одышка | Одышка, кровохарканье, рвота, обморочное состояние | Общая слабость, усиление болевого синдрома наблюдается при кашле. Отмечается также лихорадка |
| ЭКГ | Появление патологического зубца Q, подъем сегмента ST, инверсия зубца T | Депрессия сегмента ST. В некоторых случаях ЭКГ может быть в рамках нормы | Нормальный вариант ЭКГ, но в некоторых случаях отмечаются признаки перегрузки правых отделов сердца | Элевация (подъем) сегмента ST |
| Другие исследования | Биохимические маркеры инфаркта миокарда, сцинтиграфия, коронароангиография, УЗИ сердца | Проведение нагрузочной формы ЭКГ, коронарная ангиография | Вентиляционно-перфзионная сцинтиграфия легких, ангиопульмонография | УЗИ сердца |
В большинстве случаев диагноз оказывается очевидным. Его подтверждают жалобы пациента, данные объективного обследования, лабораторные и инструментальные тесты. Своевременное проведение необходимых исследований необходимо для оказания полного объема лечения и избежания развития необратимых последствий в сердечной мышце.
Энзимодиагностика инфаркта миокарда
Помимо клинических данных и ЭКГ, в диагностике инфаркта миокарда существенное значение имеет резорбционно-некротический синдром — неспецифическая реакция миокарда, возникающая вследствие асептического некроза, всасывания продуктов некроза и эндогенной интоксикации. Его критерии: лихорадка, гиперферментемия (ферменты выходят из погибших миоцитов при разрушении их мембран) и изменения общего анализа крови. Верификация инфаркта миокарда базируется на существенном росте уровня кардиоспецифических ферментов в плазме. Весьма важны сроки определения уровня ферментов у больного ИМ.
Ферменты «быстрого реагирования», которые выходят в периферический кровоток из зоны некроза:
• миоглобин — мышечный белок (норма в крови — до 40 нг/мл), при повреждении миокарда повышается уже через 1—2 ч в 10 раз и более (максимум повышения — через 4—8 ч). Нормализация происходит к концу первых суток ИМ. Специфичность этого фермента для патологии миокарда не столь высока;
• тропонин-Т (специфический миокардиальный белок, отсутствующий в скелетных мышцах) имеет первый пик роста через 2—3 ч с максимумом через 8—10 ч, и высокий уровень сохраняется на протяжении 4-7 дней. Однократное измерение этого теста через 72 ч может быть показателем распространенности ИМ. Тропониновый тест имеет прогностическое значение: если у больного с НСт нет повышения тропонина (в начале ангинозного приступа и через 12 ч), то у него отсутствует свежий инфаркт миокарда. Обычно для верификации диагноза ИМ достаточно двух исследований тропонина-Т (в отличие от необходимости многократных исследований МВ-КФК и КФК). При мелкоочаговом инфаркте миокарда тропонин начинает повышаться с такой же скоростью, как и МВ-КФК, но возвращается к норме более длительно (до 7—14 дней начального периода).
Поэтому тропонины не только высокоспецифичные, но и «поздние» диагностические маркеры, позволяющие выявить «пропущенный» ИМ, протекавший ранее без явных клинических и ЭКГ-признаков заболевания. У больных ИМ, доставленных через 48—72 ч от начала появления симптоматики, особенно при минимальных изменениях ЭКГ, предпочтительнее использовать тропониновый тест (он остается повышенным в течение 7—14 дней);
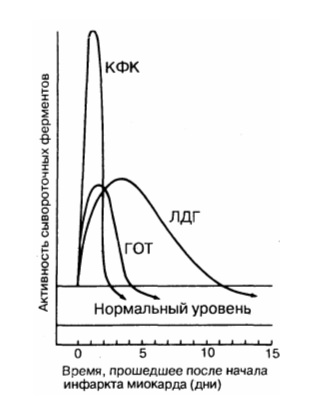 Динамика сывороточных ферментов после типичного инфаркта миокарда.
Динамика сывороточных ферментов после типичного инфаркта миокарда.
КФК – креатинфосфокиназа; ЛДГ – лактатдегидрогеназа; ГОТ – глутаматрксалоацетаттрансаминаза.
• изофермент МВ-КФК более специфичен (в высоких концентрациях отмечен только в сердце, но в небольших концентрациях содержится в скелетных мышцах). Уровень менее 10 мкг/л указывает на мелкоочаговый ИМ, а более 10 мкг/л — на крупноочаговый. Чтобы исключить ИМ, МВ-КФК регистрируют каждые 8 ч (нужны минимум 3 отрицательных результата). Оценка МВ-КФК весьма полезна, когда имеется сопутствующее поражение мышц или мозга (в них есть КФК, но нет МВ-КФК);
• суммарная КФК (норма – 20-80 усл. ед., или до 1,2 ммоль/л, в СИ) повышается через 4—6 ч (пик через 1—2 суток), а нормализуется на 4-й день. КФК содержится не только в сердце, но и в скелете, мышцах, мозге, потому рост ее может быть обусловлен травмами или болезнями мышц (полимиозит, миопатия); катетеризацией сердца; ИЭ и миокардитом (при которых интервал ST может повышаться во многих отведениях); ЭИТ; длительной иммобилизацией; шоком или алкогольной интоксикацией. Необходимо определять КФК в динамике (3-4 раза). Уровень КФК ее возрастает в ходе первых, суток, сохраняется стабильным в течение 3—4 суток и снижается к 6-7-м суткам. Пиковый уровень КФК (и МВ-КФК) на 2-е сутки после ИМ в большей мере, чем другие сывороточные маркеры, указывает на размер некроза.
Ранняя диагностика инфаркта миокарда (6—8 ч от начала) с помощью этих кардиоспецифических тестов важна для «сортировки» больных с наличием боли в грудной клетке, для определения соответствующего лечения вследствие объективных трудностей разграничения кардиальной ишемии от ИМ на основе клинических данных.
В целом, исследование биохимических специфических маркеров некроза миокарда весьма важно (особенно, если данные ЭКГ позволяют сомневаться в диагнозе инфаркта миокарда). На основе их величин выделяют ОКС с некрозом (ИМ) и без некроза (НСт). Диагностика кардиоспецифических сывороточных ферментов (находившихся в миокардиоцитах и при их разрушении оказавшихся в кровяном русле) имеет большое значение для верификации ИМ без Q.
3. Энзимодиагностика при инфаркте миокарда
Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы – ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис. 2-37. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови – основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение
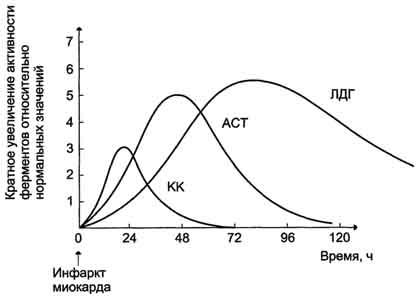
Рис. 2-37. Изменение активности ферментов в плазме крови при инфаркте миокарда.
2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
99. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена. Роль аскорбиновой кислоты в созревании коллагена.
Коллаген – основной структурный белок межклеточного матрикса. Он составляет от 25 до 33% общего количества белка в организме, т.е. -6% массы тела. Название “коллаген” объединяет семейство близкородственных фибриллярных белков, которые являются основным белковым элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. В разных тканях преобладают разные типы коллагена, а это, в свою очередь, определяется той ролью, которую коллаген играет в конкретном органе или ткани. Например, в пластинчатой костной ткани, из которой построено большинство плоских и трубчатых костей скелета, коллагеновые волокна имеют строго ориентированное направление:
продольное – в центральной части пластинок, поперечное и под углом – в периферической. Это способствует тому, что даже при расслоении пластинок фибриллы одной пластинки могут продолжаться в соседние, создавая таким образом единую волокнистую структуру кости. Поперечно ориентированные коллагеновые волокна могут вплетаться в промежуточные слои между костными пластинками, благодаря чему достигается прочность костной ткани. В сухожилиях коллаген образует плотные параллельные волокна, которые дают возможность этим структурам выдерживать большие механические нагрузки. В хрящевом матриксе коллаген образует фибриллярную сеть, которая придаёт хрящу прочность, а в роговице глаза коллаген участвует в образовании гексагональных решёток десцеметовых мембран, что обеспечивает прозрачность роговицы, а также участие этих структур в преломлении световых лучей. В дерме фибриллы коллагена ориентированы таким образом, что формируют сеть, особенно хорошо развитую в участках кожи, которые испытывают сильное давление (кожа подошв, локтей, ладоней), а в заживающей ране они агрегированы весьма хаотично. Аминокислотный состав и конформация коллагена описаны в подразделе “Фибриллярные белки” раздела 1.
Здесь будут разобраны синтез и созревание коллагена, структуры, которые он образует, и их функции, а также заболевания, связанные с нарушением этих процессов.
Коллаген – ярко выраженный полиморфный белок. В настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Вариантов α-цепей, образующих тройную спираль, гораздо больше 19 (около 30). Для обозначения каждого вида коллагена пользуются определённой формулой, в которой тип коллагена записывается римской цифрой в скобках, а для обозначения α-цепей используют арабские цифры: например коллагены II и III типа образованы идентичными α-цепями, их формулы, соответственно [α1(II)]3 и [α1(III)]3; коллагены I и IV типов являются гетеротримерами и образуются обычно двумя разными типами α-цепей, их формулы, соответственно [α1(I)]2α2(I) и [α1(IV)]2α2(IV). Индекс за скобкой обозначает количество идентичных α-цепей. Распределение коллагенов по органам и тканям представлено в табл. 15-1.
Гены коллагена называются соответственно типам коллагена и записываются арабскими цифрами, например COL1 – ген коллагена I типа, COL2 – ген коллагена II типа, COL7 – ген коллагена VII типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид a-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1 и α2-цепи коллагена I типа.
А. Этапы синтеза и созревания коллагена
Синтез и созревание коллагена – сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе. Синтез и созревание коллагена включают в себя целый ряд посттрансляционных изменений (рис. 15-1):
гидроксилирование пролина и лизина с образованием гидроксипролина (Hyp) и гидроксилизина (Hyl);
частичный протеолиз – отщепление “сигнального” пептида, а также N- и С-конце-вых пропептидов;
образование тройной спирали.
Синтез полипептидных цепей коллагена
Полипептидные цепи коллагена синтезируются на полирибосомах, связанных с мембранами ЭР, в виде более длинных, чем зрелые цепи, предшественников – препро-α-цепей. У этих предшественников имеется гидрофобный “сигнальный” пептид на N-конце, содержащий около 100 аминокислот.
Основная функция сигнального пептида – ориентация синтеза пептидных цепей в полость ЭР. После выполнения этой функции сигнальный пептид сразу же отщепляется. Синтезированная молекула проколлагена содержит дополнительные участки – N- и С-концевые пропептиды, имеющие около 100 и 250 аминокислот, соответственно. В состав пропептидов входят остатки цистеина, которые образуют внутри- и межцепочечные (только в С-пептидах) S-S-связи. Концевые пропептиды не образуют тройную спираль, а формируют глобулярные домены. Отсутствие N- и С-
Таблица 15-1. Распределение коллагена в тканях и органах
Энзимодиагностика при инфаркте миокарда
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы – ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения.
45. Принципы обнаружения и количественной оценки ферментов. Единицы измерения активности и количества ферментов
Ферменты обнаруживают и оценивают по двум критериям: по появлению продуктов реакции или по исчезновению субстратов. Ферменты проявляют специфичность в отношении субстратов и типа реакции. Активность ферментов зависит от температуры, рН среды, концентрации субстрата [S] и концентрации фермента [Е].
Количественная оценка активности ферментов в биологических жидкостях (кровь, моча, слюна) широко используются в клинической практике для диагностики и дифференциальной диагностики заболеваний. Как правило, активность ферментов увеличивается при заболеваниях печени, инфаркте миокарда и других видах патологии. При диагностике болезней, связанных с врожденной недостаточностью метаболизма, определение активности ферментов становится единственным критерием болезни.
Количественная оценка активности ферментов основывается на измерении количества образовавшегося продукта реакции или убыли субстрата в единицу времени, отнесенного к 1 мг белка или 1 мл биологической жидкости.
Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени
Для выражения концентрации фермента и количественной оценки его активности в условных единицах Комиссией по ферментам Международного биохимического союза была рекомендована стандартная международная единица (МЕ)
Количество единиц активности nME определяют по формуле:
nME= 
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяют по формуле:
n катал = 
Международная единица ферментативной активности ME связана с каталом следующими равенствами:
1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME,
1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности – ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (пМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани:
Уд. ак. = 
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность.
Рекомендовано, кроме того, измерять активность фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента.
46 Опыты по изучению pH среды, термолабильности и специфичности ферментов техника выполнения
Белковая природа обеспечивает ферментам характерные для белков строение и свойства и, прежде всего, лабильность, т.е. способность изменять активность в зависимости от различных факторов (температуры, рН, концентрации фермента и концентрации субстрата, активаторов и ингибиторов и т.п.). Степень изменения активности от различных факторов можно определить по скорости ферментативной реакции. Мерой скорости ферментативной реакции служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. При изучении влияния какого-либо фактора на скорость ферментативной реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальные значения.
Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоком значении к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрат. Кроме того, для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. Специфичность – одно из наиболее выдающихся свойств ферментов. Данное свойство ферментов объясняется в первую очередь совпадением пространственных конфигураций субстрата и субстратного центра фермента. Ферменты могут обладать абсолютной, относительной, стереохимической специфичностью. Влияние на ферменты активаторов и ингибиторов впервые было изучено А.Я.Данилевским. Ингибиторы тормозят действие ферментов. Механизм ингибирующего действия сводится к двум типам торможения (необратимое и обратимое). Обратимое ингибирование действия ферментов может быть конкурентным и неконкурентным.
Специфичность действия ферментов – это способность катализировать одну или несколько близких реакций, преобразовывать одно вещество или один вид связей. Специфичность ферментов бывает нескольких видов: абсолютная, относительная (групповая), стереохимическая.
Ферменты отличаются от катализаторов небиологической природы высокой специфичностью, что обусловлено индивидуальными особенностями строения активных центров различных ферментов. Пространственная структура активного центра предопределяет не только комплементарность субстрату, но и природу последующих превращений субстрата в фермент- субстратном комплексе, приводящих к образованию соответствующего продукта. Будучи высокоспецифичной, ферментативная реакция протекает в 10 5 -10 12 раз быстрее, чем самопроизвольная (спонтанная) реакция.
СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ АМИЛАЗЫ И САХАРАЗЫ
Для изучения специфичности этих ферментов используем амилазу слюны и сахаразу хлебопекарных дрожжей. Амилаза слюны (3.2.1.1) по механизму действия является a-амилазой. Катализирует гидролиз a-1,4-гликозидных связей в молекуле крахмала (и гликогена)
без определенного порядка. Процесс гидролиза происходит как бы ступенчато и может быть выражен в виде схемы:
Крахмал ® Амилодекстрины ® Эритродекстрины ® Ахродекстрины ® Мальтодекстрины ® Мальтоза. Глубину гидролиза крахмала можно контролировать по цветной реакции с раствором йода (см. табл. 8).
Сахараза из дрожжей имеет более правильное рабочее название b-фруктофуранозидаза (3.2.1.26). Катализирует гидролиз
b-гликозидных связей в молекулах как сахарозы, так и раффинозы, при этом сахароза расщепляется на глюкозу и фруктозу, которые обнаруживаются реакцией Троммера.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ (на акт ферментов)
Скорость ферментативной реакции зависит от температуры. Оптимальным считается то значение ее, при котором реакция протекает с максимальной скоростью. Для большинства ферментов, выделенных из организма теплокровных и многих микроорганизмов оптимальная температура составляет 37-40 °С, для ферментов растительного происхождения – 40-50 ˚С. Повышение температуры сверх оптимальной приводит к уменьшению, а затем прекращению действия фермента, что связанно с денатурацией. При переходе от оптимальной к низким температурам скорость ферментативной реакции падает в 2-2,5 раза на каждые 10 ˚С, достигая минимальной величины при 0 °С и приостанавливается при отрицательных её значениях (минус 18 ˚С). Причиной является снижение скорости движения молекул субстратов и ферментов, что замедляет образование фермент-субстратного комплекса и проведения реакции. При повышении температуры от отрицательных значений действие ферментов восстанавливается, скорость катализируемых реакций возрастает в 2-2,5 раза на каждые 10 ˚С, до оптимальной температуры. Принцип снижения активности ферментов при понижении температуры используется при консервировании сырья и готовой продукции низкими температурами. Инактивация ферментов высокой температурой необратима, используется в пищевой промышленности для консервирования многих продуктов растительного и животного происхождения.
ВЛИЯНИЕ рН НА СКОРОСТЬ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ
Ферменты при постоянной температуре работают наиболее эффективно в пределах рН (от 2 до 10) . Оптимальным считается то значение рН, при котором реакция протекает с максимальной скоростью. Отклонение в любую сторону от этого значения сопровождается снижением скорости ферментативной реакции. Это объясняется тем, что ферменты имеют большое число полярных, положительно и отрицательно заряженных групп, участвующих в поддержании нативной конформации, образовании фермент-субстратного комплекса и проведении реакции.
Во многих случаях субстраты являются электролитами, и реакция осуществляется лишь с определенными (ионизированными или неионизированными) их формами, возникающими при оптимуме рН.
Многие ферменты являются двухкомпонентными (сложными белками), небелковый компонент которых слабо связан с белком ионными, водородными связями в условиях оптимума рН. Сдвиги рН за пределы оптимума вызывают диссоциацию кофактора и разрушение структуры активного центра. Например, пероксидаза диссоциирует в кислой среде на два компонента, однако при рН 7,0 её структура и активность восстанавливаются.
При очень низких и очень высоких значениях рН ферменты денатурируют.
Энзимодиагностика
развивается по двум путям:
1) использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых).
2) открытие и количественное определение самих ферментов в биологических жидкостях при патологии. Оказалось, что ряд ферментов появляется в сыворотке крови при распаде клеток (отсюда их название «некротические ферменты»).
Для диагностики органических и функциональных поражений органов и тканей широко применяются отдельные ферментные тесты, выгодно отличающиеся от других химических диагностических тестов, используемых в клинике, высокой чувствительностью и специфичностью. Известно около 20 тестов, основанных на количественном определении активности ферментов (и изоферментов), главным образом в крови (реже в моче), а также в биоптатах (кусочки тканей, полученные при биопсии). В практическом плане энзимологические тесты должны помогать в ранней постановке и дифференциации диагноза, информировать о возможном исходе болезни и эффективности применяемой терапии. Теоретические аспекты медицинской энзимологии сводятся, в основном, к выяснению наиболее полной и достоверной картины патогенеза и этиологии заболевания, т.е. в конечном итоге к познанию молекулярных механизмов нарушений метаболических процессов.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов:появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
Для правильной интерпретации результатов проведенных исследований обязательным является сопоставление энзимопоказателей с клинической картиной болезни в целом.При оценке выявленных нарушений необходима определенная осторожность, так как один и тот же энзиматический сдвиг может являться звеном патогенетической причинной цепи или характеризовать вторичные механизмы, сопутствующие данной форме патологии, или быть связанным со стереотипной, неспецифической реакцией организма на заболевание, такой, как реакция стресса.
В большинстве случаев клиницисты используют в энзимодиагностике комплекс прямых и косвенных методов исследования ферментов. Иногда появление в крови фермента, в норме в ней отсутствующего, позволяет сразу обнаружить поврежденный орган.Это возможно в том случае, когда фермент присутствует только в одном органе. Например, орнитинкарбомоилтрансферазанайдена только в печени. Однако таких высокоорганоспецифичных ферментов очень мало. Несколько больше ферментов, обнаруженных в двух органах или тканях. Большинство же ферментов широко распространены в организме, что затрудняет выяснение источника их происхождения.
Следует отметить, что из огромного числа ферментов (более 3500), открытых в природе (частично и в организме человека), в диагностической энзимологии используется лишь ограниченный набор ферментов и для весьма небольшого числа болезней (гепатиты, инфаркт миокарда, органические поражения почек, поджелудочной железы, печени и др.). Так, уровень липазы, амилазы, трипсина и химотрипсина в крови резко увеличен при сахарном диабете, злокачественных поражениях поджелудочной железы, болезнях печени и др. Резко повышается в сыворотке крови уровень двух аминотрансфераз, креатинкиназы (и ее изоферментов) и лактатдегидрогеназы (и ее изоферментов) при инфаркте миокарда; умеренно повышено их содержание при поражениях тканей мозга и печени. Определяют, кроме того, активность кислой фосфатазы (уровень повышен при карциноме предстательной железы), щелочной фосфатазы, холинэстеразы и других органоспецифических ферментов (например, гистидазы, глицинамидинотрансферазы, уроканиназы) в сыворотке крови при патологии костной ткани.
Использование изоферментов. При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет
170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей. Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. Выявление в плазме крови тканеспецифических изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы – ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.





