Тромбин: общие сведения
Адреналин, коллаген и тромбин, связываясь с мембранными рецепторами, активируют два мембранных фермента – фосфолипазу С и фосфолипазу A2. Эти ферменты катализируют расщепление двух мембранных фосфолипидов, фосфатидилинозитол-4,5-дифосфата и лецитина, с образованием арахидоновой кислоты.
Тромбин ( EC 3.4.21.5 ) – сериновая протеиназа семейства трипсина – ключевой фермент свертывающей системы крови , который превращает фибриноген в фибрин – основу тромба, участвует в регуляции многих физиологических и патофизиологических процессов, таких как свертывание крови и противосвертывающие механизмы, тромбообразование и фибринолиз, регуляция сосудистого тонуса и процессов развития организма, а также в процессах воспаления, репарации тканей, атерогенеза, канцерогенеза и болезни Альцгеймера [ Струкова ea 1977 , Струкова ea 1998 , Henrikson, ea 1999 , Glusa, ea 1996 , Carney, ea 1992 , Grand, ea 1996 ]. Активация свертывания крови и образование тромбина происходят при воспалении, заживлении ран, атерогенезе и других процессах, индуцируемых при повреждении эндотелия сосудов. Тромбин образуется из протромбина на заключительном этапе свертывания крови и превращает растворимый фибриноген в нерастворимый фибриновый сгусток, при этом реализуется высокоспецифическое взаимодействие участка фибриногена, содержащего фибринопептиды А и В, с отрицательно заряженным центром узнавания тромбина, удаленным от каталитического участка активного центра ( рис. 4.8а,б ). Тромбин активирует за счет реакций ограниченного протеолиза факторы свертывания V , VIII , XIII и белок СИ . В результате связывания с тромбомодулином тромбин теряет свертывающую активность. Гормональные свойства тромбина проявляются при взаимодействии с рецепторами на тромбоцитах , эндотелиальных и других клетках. Благодаря такого рода взаимодействиям происходит активация тромбоцитов и секреция содержимого их гранул, активация эндотелиальных клеток и секреция простациклина, тканевого активатора плазминогена , стимуляция хемотаксиса лейкоцитов. Многие функции тромбина реализуются при его взаимодействии с рецепторами семейства PAR , при активации клеток крови и соединительной ткани, таких как тромбоциты , клетки эндотелия , лейкоциты , гладкомышечные и тучные клетки.
Полифункциональность тромбина обусловлена особенностями его структуры и наличием кроме классического активного центра нескольких субцентров, называемых экзосайтами или субцентрами связывания субстратов и рецепторов. Эти субцентры отвечают за высокоспецифическое связывание тромбина с субстратами и рецепторами и высокую избирательность в расщеплении связей и отборе субстратов [ Струкова ea 1989 , Stubbs, ea 1993 , Fenton, ea 1995 ]. Структурно-функциональные особенности тромбина и механизмы его протеолитической активности в отношении фибриногена и других субстратов – белков системы свертывания крови – достаточно хорошо изучены и обсуждены [ Струкова ea 1989 , Stubbs, ea 1993 , Fenton, ea 1995 , Stubbs, ea 1995 ].
Весьма актуальной и менее известной областью представляется участие тромбина в реакциях воспаления и репарации тканей, всегда сопровождающихся активацией системы свертывания, генерацией и концентрацией тромбина в участке повреждения сосуда и прилежащей ткани. До последнего времени тромбин расценивали в основном как провоспалительный фактор, не учитывая его модулирующего влияния на функции клеток [ Cirino, ea 1996 , Kranzhofer, ea 1996 , Moms, ea 1994 ]. В связи с этим представляет интерес изучение роли тромбина в реакциях, направленных на ограничение воспалительного процесса: блокаду адгезии клеток к поврежденному участку сосуда, ингибирование секреции медиаторов воспаления тучными клетками. Тромбин, образующийся в участке повреждения сосудов, активирует многие клетки, вовлекаемые в процессы воспаления и репарации, в том числе моноциты, Т- лимфоциты крови и тучные клетки соединительной ткани, которые локализованы в основном вдоль сосудов [ Струкова ea 1977 , Струкова ea 1998 , Henrikson, ea 1999 , Glusa, ea 1996 , Carney, ea 1992 ].
Тучные клетки участвуют в активации клеток эндотелия, миграции лейкоцитов, образовании отека и других процессах, вовлекаемых в репарацию тканей. Они активируются иммунными и неиммунными либераторами и освобождают медиаторы и модуляторы воспаления [ Valent, ea 1998 , Bissonnette, ea 1997 , Galli, ea 2000 ].
Тромбин
Конечный этап свертывания плазмы – образование фибринового сгустка
Конечная стадия каскада свертывания плазмы заключается в образовании из растворимого плазменного белка фибриногена нерастворимого фибрина под воздействием тромбина и ф.ХIII (рис. 42).
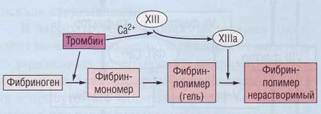
Рис. 42. Последовательные стадии образования нерастворимого фибринаиз растворимого фибриногена
Тромбин – ключевой фермент гемостаза. Тромбин – витамин-К-зависимый белок – является сериновой протеазой. В печени происходит синтез неактивного предшественника протромбина, который в дальнейшем циркулирует в плазме. В комплексе ф.Ха-Va-II на фосфолипидной поверхности происходит ограниченный протео-лиз протромбина. Образуется несколько активных структур с уменьшающейся молекулярной массой – мезотромбин, α-тромбин,β–тромбин, γ-тромбин. Наиболее значимым продуктом является сериновая протеаза – α-тромбин. На мо-
лекуле тромбина имеется, по крайней мере, 4 сайта связывания для субстратов, ингибиторов, кофакторов и иона кальция. Это, а также способность тромбина активно функционировать не только на твердой фазе, но и в токе крови позволяет ему выполнять многочисленные функции. Важнейшие функции тромбина в гемостазе:
• Ограниченный протеолиз фибриногена до
фибрин-мономеров (происходит в жидкой
фазе – кровотоке).
• Активация ф.V, -VIII, -VII, -XI.
• В комплексе с тромбомодулином тромбин
активирует протеин С.
• Ограниченный протеолиз плазматической
карбоксипептидазы В до активной формы –
активируемого тромбином ингибитора фиб
ринолиза (TAFI).
• Стимуляция выброса из эндотелиоцитов тка
невого активатора плазминогена.
Однако роль тромбина в организме не огра
ничивается вышеперечисленными функциями.
Ключевая роль в процессе свертывания крови,
активация сосудистого эндотелия, клеточный
рост и процессы репарации, активация перифе
рических клеток крови, активация фибриноли
за – это наиболее изученные функции тромби
на. Видимо, со временем этот список значитель
но увеличится.
Плазменные белки гемостаза
Косвенным подтверждением важности тромбина для организма может служить тот факт, что известны лишь единичные описания пациентов с гомозиготным дефектом молекулы тромбина, а пациенты с гипопротромбинемией встречаются чрезвычайно редко.
Важнейшим ингибитором тромбина является антитромбин III. Несколько меньшую роль играет кофактор гепарина П.
Фактор XIII – трансглютаминаза. В плазме большая часть неактивного ф.ХIII связана с фибриногеном. Активация ф.ХIII происходит путем ограниченного протеолиза неактивного ф.ХIII тромбином одновременно с отщеплением пептида А от фибриногена. Как и большинство других ферментов, он выполняет несколько функций в гемостазе:
• Стабилизирует фибриновый сгусток путем
образования ковалентных связей между у-це-
пями мономеров фибрина.
• Участвует в связывании, α-ингибитора плаз-
мина с фибрином, что способствует предотв
ращению преждевременного лизиса фибрино-
вого сгустка.
• Значительную роль ф.ХIII играет в процес
сах полимеризации актина, миозина и других
компонентов цитоскелета тромбоцитов, что
чрезвычайно важно для активации тромбо
цитов и ретракции образовавшегося фибри-
нового сгустка. Это объясняет наличие ф.ХIII
в цитоплазме тромбоцитов.
• Обнаружены перекрестные реакции ф.ХIII с
ф.V, фон Виллебранд протеином.
Помимо непосредственно реакций гемостаза,
ф.ХIII участвует в процессах образования соединительной ткани, репаративных реакциях:
• Участвует в связывании молекул фибронек-
тина между собой и с молекулами фибрина.
Вероятно, это важно для направленной миг
рации клеток и процессов репарации.
• Играет роль в биосинтезе коллагена, катали
зируя образование связей между молекулами
коллагена типов I, II, III и V.
крови и образовывать прочную объемную структуру, которая эффективно закрывает повреждение сосуда и предотвращает потерю крови. Концентрация фибриногена в крови здорового человека значительно выше, чем концентрация других белков гемостаза, что связано с его уникальной ролью.
Синтез фибриногена происходит в печени и не зависит от витамина К. Некоторое количество фибриногена синтезируется в мегакариоцитах и содержится в тромбоцитах. Этот фибриноген несколько отличается от фибриногена, синтезированного в печени.
Помимо гепатоцитов и мегакариоцитов, активность гена γ-цепей фибриногена обнаружена в некоторых других тканях – головном мозге, легких, костном мозге, где γ-цепи фибриногена, видимо, выступают в роли молекул адгезии.
Фибриноген – большой многокомпонентный белок, который состоит из трех пар полипептидных цепей – 2α, 2β, 2γ, связанных между собой дисульфидными мостиками и переплетенных друг относительно друга (рис. 43).
Пространственная структура молекулы фибриногена состоит из центрального Е-доме-на и 2 периферических D-доменов. α- и β-цепи формируют глобулярные структуры – фибрино-пептиды А и В (ФПА и ФПВ), которые закрывают комплементарные участки в фибриногене и не позволяют этой молекуле полимеризовать-ся. Процесс взаимодействия фибриногена и тромбина происходит в жидкой фазе – кровотоке. Тромбин соединяется с фибриногеном и отщепляет конечные последовательности от α- и β-це-пей – 2 ФПА и 2 ФПВ (рис. 44). Образуются ра-

Формирование гемостатического тромба
Фибриноген – уникальная молекула, обладающая свойством быстро полимеризоваться в токе
Рис. 43. Фибриногенсостоит из 3 парных белковых молекул α, β и γ, Фибринопептиды А и В (ФПА и ФПВ) отщепляются тромбином от фибриногена, инициируя тем самым процесс полимеризации и превращение фибриногена в фибрин
Плазменные белки гемостаза

Рис. 44. Формирование фибрин-мономеровиз фибриногена. Тромбин отщепляет фибринопептиды ФПА и ФПВ от молекулы фибриногена, тем самым образуются растворимые мономеры фибрина, которые способны полимери-зоваться до линейного полимера, или «растворимого фибрина»
створимые мономеры фибрина. В дальнейшем происходит спонтанное соединение комплиментарных участков фибрин-мономеров. Сначала образуются димеры, далее олигомеры и в конечном итоге собираются мононити полимери-зованного фибрина. Таким образом, фибрино-вая цепь формируется спонтанной, конец в конец полимеризацией фибрин-мономеров, при которой концевая часть одного мономера взаимодействует с центральной частью другого мономера в месте отщепления ФПА. Результатом такой полимеризации является линейный полимер шириной в 2 молекулы (рис. 44). На этом этапе фибрин легко растворим в 5-молярной
мочевине, поэтому он получил название растворимого фибрина.
Соединяясь с фибриногеном, тромбин не только отщепляет фибринопептиды. но и активирует связанный с ним фактор XIII. Фактор ХIIIа образует ковалентные связи между γ-цепями (D-доме-нами) нитей растворимого фибрина (рис. 45), которые соединяются за счет образования пептидных мостиков между боковыми радикалами лизина и глютамина. Сшитые между собой мононити фибрина образуют прочную сеть, менее подверженную фибринолизу и более устойчивую к механическим воздействиям. В такой форме фибрин не растворяется в 5-молярной мочевине и называется нерастворимым фибрином.
| Рис. 46. Организованный тромб,в котором в фибрино-вую сеть включены клетки крови |
Образовавшийся фибриновый сгусток – трехмерная молекулярная сеть, в которую включены тромбоциты, эритроциты и лейкоциты (рис. 46). Активированные тромбоциты, связанные с нитями фибрина через рецепторы GPIIb-IIIa, сокращают-


Рис. 45. Образование нерастворимого фибринапод влиянием фактора ХIIIа
Плазменные белки гемостаза
ся под действием тромбостенина (тромбоцитарно-го актомиозина) вследствие присущих им контрак-тильных свойств (см. главу «Тромбоциты»). Происходит ретракция сгустка крови. Сгусток уплотняется, из него выдавливается часть сыворотки. Формирование окончательного тромба наступает на 10-15-й минуте после полимеризации фибрина.
Если тромбоциты отсутствуют или имеют дефект GPIIb-IIIa, то ретракции кровяного сгустка не происходит и он быстро лизируется в процессе фибринолиза. При отсутствии ретракции тромба в сосудистом русле возможен отрыв тром-ботических масс и эмболия удаленных сосудов (тромбоэмболия).
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9789 –  | 7481 –
| 7481 –  или читать все.
или читать все.
Функция тромбина крови
Прекращение кровотечения после травматического повреждения кровеносных сосудов называется гемостазом.
Выделяют четыре фазы гемостаза:
· Первая фаза — сокращение поврежденного сосуда. При этом уменьшается кровоснабжение дистальной от травмы области.
· Вторая фаза — образование в месте повреждения рыхлой тромбоцитарной пробки или белого тромба. Имеющийся в участке повреждения коллаген служит связывающим центром для тромбоцитов; у последних в результате связывания разрушается их внутренняя структура и высвобождаются тромбоксан и ADP . Они в свою очередь индуцируют присоединение новых тромбоцитов и таким образом образуется рыхлая временная пробка. Длительность данной фазы гемостаза определяют по продолжительности кровотечения.
· Третья фаза — формирование красного тромба (кровяного сгустка).
· Четвертая фаза — частичное или полное растворение сгустка.
Различают три типа тромбов или сгустков:
· Белый тромб (первый тип) образуется из тромбоцитов и фибрина; в нем относительно мало эритроцитов. Формируется он в местах повреждения или на патологически измененной стенке сосуда в условиях высокой скорости кровотока (в артериях).
· Второй вид тромбов — это диссеминированные отложения фибрина в очень мелких сосудах (капиллярах).
· Третий вид тромбов — красный тромб — состоит из эритроцитов и фибрина. Морфология красного тромба сходна с морфологией сгустков, образующихся в пробирке. Красные тромбы формируются in vivo в областях замедленного кровотока при отсутствии патологических изменений в стенке сосуда, в месте повреждения или на измененной стенке сосуда вслед за инициирующей тромбоцитарной пробкой.
- Инициация образования тромба в ответ на повреждение ткани осуществляется по внешнему пути свертывания.
- Инициация формирования красного тромба в области замедленного кровотока или на аномальной сосудистой стенке при отсутствии повреждения ткани происходит по внутреннему пути свертывания.
- Внешний и внутренний пути свертывания завершаются общим конечным путем. На этом этапе происходит переход протромбина в тромбин и катализируемое тромбином превращение фибриногена в фибрин тромба.
Таблица 1. Система нумерации факторов свертывания крови.
Номера не отражают последовательности действия факторов
Лабильный фактор, проакселерин , Ас-глобулин
Проконвертин , ускоритель превращения сывороточного протромбина, котромбопластин , аутопротромбин I
Антигемофильный фактор, антигемофильный глобулин
Тромбопластиновый компонент плазмы (фактор Кристмаса )
Предшественник тромбопластина плазмы
Превращение фибриногена в фибрин, катализируемое тромбином
Фибриноген (фактор I , см. рис. 1 и табл. 1) — это растворимый гликопротеин плазмы, синтезируемый в печени, длина его молекулы 46 нм, мол масса 340000. Молекула состоит из шести полипептидных цепей (две А α – цепи, две Вβ -цепи и две γ -цепи). Структура фибриногена — Аα2Вβ2γ2. Вβ – и γ – цепи содержат сложные олигосахариды, связанные с остатками Asn . Концы молекул фибриногена обладают сильным отрицательным зарядом; это обусловлено присутствием большого количества остатков аспартата и глутамата в А-области цепи А α и в В-области области цепи Вβ (рис. 1). Помимо этого В-область цепи В β содержит необычно отрицательно заряженный остаток тирозин-О-сульфата . Отрицательно заряженные концы молекул фибриногена не только способствуют растворимости последних в воде, они отталкивают концы других молекул фибриногена, что предотвращает агрегацию последних.

Рис. 1. Схематическое изображение фибриногена, его структуры ( АαВβγ )2, заряженных концов, сайтов расщепления тромбином (стрелки) четырех пептидных связей Arg – Gly .
Тромбин — это сериновая протеаза с мол . м ассой 34000, состоящая из двух полипептидных цепей. Тромбин гидролизует четыре пептидные связи Arg – Gly в фибриногене (рис. 1). Из этих четырех связей две соединяют области А и α , а другие две — области В и β в цепях Аα и Вβ соответственно. Удаляемые из молекулы фибриногена фрагменты А и В являются отрицательно заряженными фибринопептидами , в результате образуется мономер фибрина, имеющий структуру ( αβγ )2. Длинные нерастворимые мономеры фибрина спонтанно ассоциируют в регулярные зигзагообразные структуры; в результате образуется нерастворимый полимерный фибриновый сгусток. Он захватывает эритроциты, тромбоциты и другие компоненты крови, в результате чего образуется красный тромб или белый тромб ( тромбоцитарная пробка). На ранней стадии фибриновый сгусток представляет собой весьма рыхлое образование, удерживающееся лишь нековалентносвязанной системой нерастворимых фибриновых мономеров.
Функция тромбина помимо превращения фибриногена в фибрин заключается в переводе фактора XIII в его активную форму ( XIII а ). Фактор Х III а ( трансглутаминаза ) «сшивает» мономеры фибрина путем образования специфической изопептидной связи между γ – карбоксамидной группой глутамина и ε -аминогруппой лизина (рис. 2). Такая стабилизация фибринового сгустка способствует его ретракции , что можно наблюдать в пробирке. Повышенная кровоточивость, наблюдаемая у пациентов с наследственной недостаточностью фактора XIII , объясняется невозможностью образования стабильного фибринового сгустка.

Рис. 2. Поперечная сшивка фибриновых молекул при действии активированного фактора XIII .

Рис. 3. Схематическое строение протромбина, N -конец — слева; область I содержит все остатки Gla . Показаны сайты расщепления фактором Х а и наименования продуктов расщепления. Локализация каталитически активного остатка серина обозначена ▲. А- и В-цепи активного тромбина ( заштрихованы ) удерживаются вместе дисульфидным мостиком.
Известно, что внезапный тромбоз сосудов может иметь опасные и даже катастрофические последствия. Вот почему активность тромбина должна в организме тщательно контролироваться. Такой контроль осуществляется двумя механизмами. Один из них опосредован функцией антагониста тромбина — антитромбина III (см. ниже). Второй механизм состоит в том, что в организме синтезируется и циркулирует каталитически неактивный зимоген тромбина — протромбин. Протромбин, или фактор II , синтезируется в печени и содержит остатки γ – карбоксиглутамата ( Gla ). Протромбин представляет собой одноцепочечный гликопротеин с мол массой 72000; рис. 3 знакомит нас с первичной и вторичной структурой этой молекулы. N -концевая область протромбина (1- на рисунке) содержит до 14 остатков Gla . Пунктирной линией обозначен дисульфидный мостик между областями А и В протромбина. Черным треугольником отмечена локализация каталитически активного остатка серина протеазного центра.
Активация протромбина происходит на тромбоцитах ; в этом процессе участвуют анионный тромбоцитарный фосфолипид , ионы Са 2 + , факторы Va и Xa .
Фосфолипиды, находящиеся на внутренней стороне плазматической мембраны тромбоцитов, экспонируются в результате индуцированного коллагеном разрушения и дегрануляции тромбоцитов. Эти фосфолипиды связывают ионы Са 2 + и протромбин (последний, по N -концевой области, содержащей остатки Gla ). Тромбоциты содержат также фактор V , который в активированной форме ( Va ) соединяется со специфическими рецепторами на мембране тромбоцитов (рис. 4). Фактор Va служит рецептором для фактора Х а, который в свою очередь связывает протромбин в области F -1-2 (рис. 3). Фактор Х а также является сериновой протеазой, он расщепляет каталитически неактивную молекулу протромбина в областях, указанных на рис. 3. При этом высвобождается N -концевая часть протромбина. В результате расщепления тромбина фактором Х а образуются полипептиды тромбина А и В, связанные дисульфидным мостиком.
Связывание фосфолипида через ионы Са 2 + с остатками Gla протромбина усиливает процесс активации последнего в 50—100 раз. Это происходит, по-видимому, вследствие создания высокой локальной концентрации протромбина и фактора Х а (рис. 4). Фактор Va вызывает усиление активации протромбина примерно в 350 раз также благодаря повышению локальной концентрации фактора X а.
Фактор Va , образуемый под действием тромбина из фактора V , впоследствии тем же тромбином и инактивируется, таким путем ограничивается процесс активации протромбина в тромбин.
Протромбин может быть активирован стафилокоагулазой в результате конформационных изменений.

Рис. 4. Схема связывания факторов Va , Xa , ионов Са 2 + и протромбина с плазматической мембраной тромбоцита.
Активация фактора Х
Внешний путь образования фактора Ха
Разрыв связи Arg – Ile , а следовательно и превращение фактора Х в фактор Х а, на внешнем пути осуществляют совместно фактор VII а и тканевый фактор. Фактор VII а функционирует только на внешнем пути, который быстро включается после повреждения ткани. Предшественник фактора VIIa — фактор VII (еще один Gla -содержащий гликопротеин) — синтезируется в печени и может активироваться тромбином или фактором Х а. Фактор VII — это зимоген, однако он обладает относительно высокой эндогенной активностью. Тканевый фактор, ускоряющий действие факторов VII или VIIa на фактор X , в большем количестве содержится в плаценте, легких и мозге.
В 1 мл плазмы содержится примерно 3 мг фибриногена и только 0,01 мг фактора X . Это означает, что в системе свертывания должна иметь место амплификация. И действительно, превращение фактора X в Х а — аутокаталитический процесс, который можно рассматривать как амплификацию. В рассмотренной группе реакций нелегко понять, что является первичным — «курица или яйцо»; в данном случае — фактор II а (тромбин) или фактор Х а (рис. 5).
Внутренний путь образования фактора Х а
Внутренний путь образования фактора Х а начинается с взаимодействия in vivo прекалликреина , высокомолекулярного кининогена , факторов XII и XI на активирующей поверхности, вероятно на коллагене (рис. 6). Активирующей поверхностью внутреннего пути в опытах in vitro служит стекло и каолин. Взаимодействие фактора XII с активирующей поверхностью делает его более доступным для протеолитической атаки калликреином . В результате действия калликреина образуется фактор Х II а, который в свою очередь индуцирует переход прекалликреина в калликреин . Таким образом, имеет место реципрокная активация. Фактор Х II а высвобождает из высокомолекулярного кининогена брадикинин и активирует фактор XI в Х I а. Фактор Х I а в результате двух последовательных реакций активирует фактор IX ( Gla -содержащий зимоген). Фактор I Ха в присутствии ионов Са 2 + и кислых фосфолипидов медленно активирует фактор X ; активация происходит путем расщепления той же связи Arg — Il е, которую расщепляет фактор VIIa на внешнем пути. Скорость активации фактора X фактором I Ха увеличивается в 500 раз в присутствии фактора VIII (или VIIIa ). Для активации фактора VIII , по-видимому, необходимо небольшое количество тромбина. Фактор VIII не является протеазой; вероятно, он служит рецептором для фактора IX а при расщеплении последним связи Arg — Il е в факторе X . Внутренний путь свертывания крови — медленный процесс, поскольку в нем участвует большое число факторов. Все вместе они образуют каскадный механизм, генерирующий фактор Х а (рис. 6).

Рис. 5. Взаимосвязь внутреннего, внешнего и конечного общего пути в процессе свертывания крови.

Рис. 6. Внутренний путь активации фактора X в Х а. ВМК — высокомолекулярный кининоген .
Имеется целый ряд наследственных болезней человека, обусловленных недостаточностью различных компонентов системы свертывания. Наиболее часто наблюдается недостаточность фактора VIII , детерминирующая гемофилию А (соответствующий ген локализован в 10-й хромосоме человека). Эта болезнь сыграла значительную роль в истории королевских династий в Европе.
У пациентов с аутосомно-доминантой болезнью Виллебранда помимо недостаточности фактора VIII имеется нарушение в адгезии тромбоцитов. Между тем у больных гемофилией А отсутствует только свертывающая активность фактора VIII , при этом адгезия тромбоцитов не нарушена. Фактор адгезии тромбоцитов (фактор Виллебранда) синтезируется клетками эндотелия сосудов и мегакариоцитами (клетками-предшественниками тромбоцитов); он представляет собой крупный гликопротеин с мол . м ассой более 200000. Фактор Виллебранда обнаруживается в плазме и тромбоцитах в составе комплекса с молекулой фактора VIII . По-видимому, на поверхности тромбоцитов имеется рецептор гликопротеиновой природы, связывающий комплекс фактора Виллебранда с фактором VIII . Фактор Виллебранда, вероятно, стабилизирует прокоагулянтную активность фактора VIII . Болезнь Виллебранда может быть результатом наследуемого дефекта в олигосахаридном фрагменте гликопротеинового фактора Виллебранда. Аномальный олигосахарид может препятствовать адгезии тромбоцитов и дестабилизировать фактор VIII . При гемофилии А имеется дефект фактора VIII ; при этом нарушается его свертывающая активность, в то же время адгезия тромбоцитов, определяемая фактором Виллебранда, не меняется. Фактор VIII представляет собой гликопротеин, содержащий 2300 аминокислот; его молекула обнаруживает частичную гомологию с церулоплазмином и фактором V . Синтезируется этот фактор в печени, селезенке и почках.
Нормальная плазма характеризуется несколькими видами антитромбиновой активности. Небольшой вклад в нее вносит α1-антитрипсин. На долю специфического α2-глобулина приходится около 25% всей антитромбиновой активности плазмы. Он образует необратимый комплекс с тромбином и другими протеазами, препятствуя таким образом связыванию этих ферментов с их природными субстратами. α2-Глобулин рассматривается как α2-ингибитор плазмина, поскольку он инактивирует также плазмин, являющийся сериновой протеазой с фибринолитической активностью.
Наибольшая антитромбиновая активность присуща антитромбину III . Антитромбин III обладает незначительной эндогенной активностью и сильно активируется в присутствии гепарина, обладающего большим отрицательным зарядом. Гепарин, по-видимому, связывается со специфическим катионным участком антитромбина III , вызывая конформационное изменение его молекулы. В результате этого изменения антитромбин III приобретает возможность связываться со всеми сериновыми протеазами, включая трипсин, химотрипсин и плазмин. В системе свертывания крови антитромбин III ингибирует активность тромбина, факторов I Ха, Ха, Х I а и Х II а. У индивидов с наследственной недостаточностью антитромбина наблюдается склонность к образованию тромбов. Отсюда можно сделать вывод, что антитромбин выполняет физиологические функции и что в норме процесс свертывания крови у человека представляет собой очень динамичную систему.
Гепарин часто используется в клинической практике в качестве препарата, предотвращающего свертывание крови. Главным фактором, определяющим противосвертывающую активность гепарина, является активация им антитромбина III , который в свою очередь ингибирует рассмотренные выше сериновые протеазы. Известно, что небольшое количество гепарина находится на стенках сосудов, вследствие этого снижается активация внутреннего пути. Противосвертывающую активность гепарина можно подавить сильно катионными полипептидами (например, протамином). Такие полипептиды конкурируют с катионными участками антитромбина III за связывание с полианионным гепарином.
Препараты группы кумарина ингибируют витамин-К-зависимое карбоксилирование остатков Glu , приводящее к образованию Gla в N -концевой части молекулы факторов II , VII , IX и X . Все эти факторы синтезируются в печени, и образование остатков Gla необходимо для их созревания и, следовательно, для нормального функционирования внутреннего, внешнего и общего конечного путей свертывания. По-видимому, препараты кумарина ингибируют восстановление хиноновых производных витамина К в активные гидрохиноновые формы. Введение витамина К снимает блок, вызываемый кумарином, и обеспечивает созревание в печени Gla -зависимых факторов свертывания. Обращение действия кумарина витамином К наблюдается только через 12—24 ч; обращение же противосвертывающей активности гепарина протамином происходит практически сразу; это различие обусловлено природой антагонистических механизмов.
Имеются убедительные данные, свидетельствующие о том, что система свертывания крови в норме находится в динамическом равновесии, при котором фибриновые сгустки постоянно образуются, а затем растворяются. Плазмин представляет собой сериновую протеазу, способную гидролизовать фибриноген и фибрин, факторы V и VIII , факторы комплемента и различные полипептидные гормоны. В норме плазмин содержится в плазме в форме неактивного профермента (плазминогена). В большинстве тканей организма имеются активаторы плазминогена различных типов. Тканевый активатор плазминогена — это сериновая протеаза, каталитически неактивная в отсутствие контакта с фибрином. Находясь в контакте с фибрином, активатор плазминогена способен расщеплять молекулу плазминогена с образованием плазмина. Когда плазмин гидролизует фибрин, активатор плазминогена теряет свою активность и протеолиз затухает. Таким образом, обеспечивается эффективная регуляция процесса фибринолиза. Весьма перспективным представляется использование в терапевтических целях тканевого активатора плазминогена (ТАП), получаемого методами генной инженерии. ТАП способствует восстановлению проходимости коронарных артерий, снижая, таким образом, повреждение миокарда, происходящее при остром тромбозе коронарных сосудов. Еще один активатор плазминогена — протеолитический фермент урокиназа — содержится в моче. Урокиназа — это тоже сериновая протеиназа; она может активировать плазминоген, расщепляя его в двух местах.
Плазминоген в норме осаждается с фибрином и, следовательно, входит в состав фибринового сгустка. Образующийся в результате активации плазмин расщепляет молекулы фибрина на растворимые фрагменты, и сгусток исчезает (растворяется). Фибриновые сгустки с поперечными сшивками, труднее растворяются плазмином.
Концентрация активаторов плазминогена повышается при ряде заболеваний, в том числе при некоторых формах рака и при шоке. Антиплазминовая активность, обусловленная α1-антитрипсином и α2-ингибитором плазмина, может снижаться при циррозе печени. Некоторые бактериальные продукты, например стрептокиназа, способны активировать плазминоген без расщепления его молекулы и могут быть ответственны за диффузные кровоизлияния, наблюдаемые иногда у больных с диссеминированными бактериальными инфекциями.
ТРОМБИН
ТРОМБИН (син. фибриногеназа) — протеолитический фермент (КФ 3.4.21.5) свертывающей системы крови, катализирующий гидролитическое расщепление фибриногена до фибрин-мономеров, к-рые полимеризуются в фибрин — основу тромба. Т. относится к пептид-гидролазам, к подклассу сериновых протеиназ (см. Пептид-гидролазы).
А. А. Шмидт установил, что в циркулирующей крови Т. находится в форме предшественника — протромбина, к-рый превращается в Т. ферментативным путем (см. Протромбин). В 40-е гг. 20 в. были получены первые препараты очищенного Т. В СССР в 1942 г. было освоено промышленное производство Т. из крови лошадей по методу Б. А. Кудряшова для использования в качестве местного гемостатического средства при кровотечениях из паренхиматозных органов.
Т. представляет собой гликопротеид с мол. весом (массой) ок. 40 000, содержит ок. 5% углеводов. Изоэлектрическая точка (см.) Т. находится при pH 7,0—7,6. В более щелочной среде и при повышении концентрации белка происходит его аутолиз (см.), в результате к-рого тромбин (альфа-тромбин) превращается в бета- и гамма-формы. Эти формы отличаются от а-тромбина по структуре, не обладают свертывающей активностью, сохраняют эстеразную, амидазную и частично протеолитическую активность. Специфичным ингибитором Т. является гирудин (см.), к-рый необратимо блокирует участок «узнавания» высокомолекулярных субстратов вне активного центра. Природным ингибитором Т. является антитромбин III (кофактор гепарина) — гликопротеид с мол. весом ок. 60 000 (см. Геморрагические диатезы).
Т. представляет собой узкоспецифичную протеиназу. Он гидролизует пептидные, амидные и эфирные связи, образуемые основными аминокислотами, преимущественно аргинином. В своем основном субстрате — фибриногене (см.) — Т. гидролизует три пары пептидных связей, освобождая фибринопептид А (при этом образуется фибрин-мономер, содержащий так наз. пептид В) и три-пептид. Мономеры фибрина без пептидов быстро полимеризуются и стабилизируются в фибрин (см.) фактором XIII. Мономеры с пептидами В полимеризуются ограниченно и образуют высокомолекулярные комплексы с фибриногеном — так наз. растворимый фибрин (см. Паракоагуляция), к-рый появляется в крови при нек-рых патол. состояниях, напр, при синдроме диссеминированного внутрисосудистого свертывания (см. Геморрагические диатезы), и служит показателем тромбинемии.
Т. вызывает ограниченный протеолиз нек-рых факторов свертывающей системы крови (см.). Т. действует на клетки крови и стенки кровеносных сосудов: индуцирует агрегацию и реакцию освобождения тромбоцитов (см.), стимулирует синтез ими тромбоксана А2 (см. Простагландины) и фосфорилирование внутриклеточных белков; стимулирует освобождение простациклина (простагландина 12) клетками эндотелия, синтез и освобождение фибронектина (белок, имеющийся на наружной поверхности нормальных клеток); возбуждает специфические хеморецепторы стенки сосудов, инициируя рефлекторную реакцию противосвертывающей системы .
Т. образуется из протромбина под влиянием фактора Ха (активного фактора Стюарта — Прауэра аутопротромбина С), находящегося в крови в форме профермента — фактора X (см. Протромбин, Свертывающая система крови).
Состояние конечного этапа процесса свертывания крови (превращение фибриногена в фибрин) отражает тромбиновое время, к-рое определяется по времени свертывания плазмы крови под действием стандартного р-ра тромбина. В норме тромбиновое время составляет 15—18 сек. Удлинение тромбинового времени может быть обусловлено качественными или количественными изменениями фибриногена (см.), напр, при дисфибриногенемии, при гипо-фибриногенемии (см. Афибриногенемия), накоплением продуктов фибринолиза с антиполимеразной активностью (см. Фибринолиз), а также инактивацией Т., напр, при гипергепаринемии, избытке антитромбинов (см. Геморрагические диатезы), о чем свидетельствует отсутствие коррекции тромбинового времени при добавлении к испытуемой плазме крови фибриногена.
Для определения активности Т. предложено несколько методов. Наиболее часто применяют метод определения времени свертывания 0,1 — 0,5% р-ров фибриногена или плазмы крови исследуемым р-ром Т. Высокочувствительным является метод определения амидазной активности Т. по отношению к высокоспецифичным хромогенным субстратам — n-нитроанилидам трипепти-дов аргинина, имитирующим участки связывания фермента в молекуле фибриногена. О появлении Т. в крови свидетельствуют повышение содержания в ней продуктов раннего протеолиза фибриногена тромбином — фибринопептида А и растворимого фибрина, снижение концентрации в крови антитромбина III и обнаружение комплексов его с Т., а также появление продуктов реакции освобождения тромбоцитов — тромбоцитарного фактора 4 и Р-тром-боглобулина. Анализ этих данных имеет диагностическое значение при синдроме диссеминированного внутрисосудистого свертывания, тромбозе (см.), тромбоэмболии (см.) и др.
Тромбин как препарат
Применяемый в мед. практике Т. получают из плазмы донорской крови. В СССР метод производственного получения высушенного препарата Т. из крови человека был впервые разработан в 1949 г. в Ленинградском ордена Трудового Красного Знамени НИИ гематологии и переливания крови.
Препарат Т. (Tbrombinum) представляет собой белый аморфный порошок без запаха, растворимый в изотоническом (0,9%) р-ре хлорида натрия (pH 6,2—7,2). В р-рах тромбин быстро теряет свою активность. Кроме того, Т. инактивируется под влиянием к-т, щелочей и солей тяжелых металлов.
Активность препарата выражают в ЕА (единицах активности). За 1 ЕА принимают активность такого количества Т., к-рое при t° 37° вызывает свертывание 1 мл свежей плазмы крови в течение 30 сек. или 1 мл 0,1% р-ра фибриногена в течение 15 сек.
По фармакол. свойствам Т. относится к кровоостанавливающим средствам (см.) местного действия. При нанесении р-ра тромбина на поверхность кровоточащей ткани происходит быстрое свертывание крови и образование пленки фибрина, к-рая препятствует кровотечению из поврежденных мелких сосудов.
Т. применяется для остановки капиллярных и паренхиматозных кровотечений при операциях на почках, печени и других паренхиматозных органах, при черепно-мозговых операциях, а также при кровотечениях, напр, из десен, особенно при гипопластической анемии (см.) и болезни Верльгофа (см. Пурпура тромбоцитопеническая).
Препарат применяют местно, растворяя его непосредственно перед употреблением в стерильном изотоническом р-ре хлорида натрия комнатной температуры с соблюдением правил асептики. Р-рами препарата пропитывают стерильные марлевые салфетки или гемостатическую губку, к-рые накладывают на кровоточащую поверхность. Если рану закрывают наглухо, марлевый тампон удаляют сразу после остановки кровотечения. Удалять тампон из раны необходимо с осторожностью, чтобы не повредить образовавшейся фиб-ринной пленки и тромбов. В случае лечения раны открытым способом тампон можно удалять при очередной перевязке. Гемостатическую губку, пропитанную р-ром тромбина, можно оставлять в ране, т. к. губка в ней рассасывается.
Побочное действие Т. проявляется относительно редко, гл. обр. аллергическими реакциями.
Т. противопоказан при кровотечениях из крупных сосудов. Р-ры тромбина не следует вводить внутривенно и внутримышечно во избежание развития распространенных тромбозов со смертельным исходом.
Форма выпуска: ампулы и флаконы емкостью по 10 мл, содержащие не менее 125 ЕА препарата. Количество и активность препарата указываются на ампулах и флаконах. Сохраняют в сухом месте при температуре от 2 до 10°.
Библиогр.: Зубаиров Д. М. Биохимия свертывания крови, М., 1978; Кудряшов Б. А. Биологические проблемы регуляции жидкого состояния крови и ее свертывания, М., 1975; Лабораторные методы исследования системы гемостаза, под ред. Е. Д. Гольдберга, Томск, 1980; Машковский М. Д. Лекарственные средства, ч. 2, с. 83, М., 1984; Струков А. И. и Стру-к о в а С. М. Структурно-функциональные основы гемостаза и его патология, Арх. патол., т. 42, в. 9, с. 3, 1980; Струкова С. М. Структурно-функ-циональные особенности тромбина, в кн.: Биохим. животных и человека, под ред. М. Д. Курского и др., в. 6, с. 26, Киев, 1982; Chemistry and biology of thrombin, ed. bv R. L. Lundblad a. o., Ann Arbor, 1977; ‘Fenton J. W. Thrombin specificity, Ann. N. Y. Acad. Sci., v. 370, p. 468, 1981; The physiological inhibitors of blood coagulation and fibrinolysis, ed. by D. Collen a. o., p. 19, Amsterdam a. o., 1979.
С. М. Струкова; В. К. Муратов (фарм.).
методичка СВЁРТЫВАЮЩАЯ СИСTЕМА. Свёртывающая сисtема крови
| Название | Свёртывающая сисtема крови |
| Анкор | методичка СВЁРТЫВАЮЩАЯ СИСTЕМА.doc |
| Дата | 25.09.2017 |
| Размер | 1.2 Mb. |
| Формат файла |  |
| Имя файла | методичка СВЁРТЫВАЮЩАЯ СИСTЕМА.doc |
| Тип | Документы #19489 |
| страница | 2 из 4 |
| Каталог |
|
Тромбин выполняет ряд важных физиологических функций: является ферментом прокоагулянтного и контактного путей свёртывания крови, инициирует реакции антикоагулянтной фазы, вызывает агрегацию тромбоцитов и оказывает митогенное действие, участвуя в пролиферации и репарации клеток. Частичным протеолизом активируются также факторы V и VIII, превращаясь, соответственно, в факторы Va и VIIIa. В результате активации этих факторов изменяется их конформация и повышается сродство к фосфолипидам мембран и ферментам, которые они активируют. Функции тромбина:
Взаимодействие белков-активаторов с протеолитическими ферментами. Тканевый фактор, фактор Va и фактор VIIIa имеют центры связывания с фосфолипидами мембран и ферментами VIIa, IXa и Ха, соответственно. При связывании с белками-активаторами в результате конформационных изменений активность этих ферментов повышается. Тканевый фактор (фактор III) представляет собой комплекс, состоящий из белка и фосфатидилсерина. Белковая часть тканевого фактора (апопротеин III) экспонирована на поверхности многих клеток (мозга, лёгких, печени, селезёнки и др.) и связана с фосфатидилсерином плазматических мембран. Однако появление апопротеина III на поверхности клеток, соприкасающихся с кровью (эвдотелиальных и моноцитов), происходит только при определённых условиях: при повреждении сосуда и/или нарушении нормальной асимметрии их плазматических мембран. Тканевый фактор в протеолитической активации не нуждается.
Фактор V и фактор VIII – доменные белки, циркулирующие в крови. Фактор V синтезируется в печени, а фактор VIII – эндотелиальными клетками. Оба фактора активируются частичным протеолизом под действием тромбина. Фактор VIII в плазме крови находится в комплексе с белком – фактором тромбоцитов фон Виллебранда. Фактор фон Виллебранда в этом комплексе стабилизирует фактор VIII, препятствуя его разрушению прогеолитическим ферментом антикоагулянтной фазы фактором Са. Взаимодействие ферментных комплексов с клеточными мембранами происходит с участием ионов Са 2+ . Все проферменты прокоагулянтного пути (II, VII, IX, X) содержат остатки у-кар-боксиглутаминовой кислоты, образующиеся в результате посттрансляционой модификации этих белков в ЭР гепатоцитов. Остатки γ-карбоксиглутаминовой кислоты в факторах VIIa, IXa и Ха обеспечивают взаимодействие этих ферментов посредством Са 2+ с отрицательно заряженными фосфолипидами клеточных мембран. В отсутствие ионов Са 2+ кровь не свёртывается. Роль витамина К в карбоксилировании остатков глутаминовой кислоты в проферментах прокоагулянтного пути свёртывания крови. Карбоксилирование остатков глутаминовой кислоты в проферментах прокоагулянтного пути катализирует карбоксилаза, коферментом которой служит восстановленная форма витамина К (нафтохинона) – дигидрохинон витамина К. Поступивший в организм витамин К (нафто-хинон) восстанавливается в печени NADPH-зависимой витамин К редуктазой с образованием дигидрохинона витамина К. В ходе реакции кар-боксилирования остатков глутаминовой кислоты в проферментах прокоагулянтного пути дигидрохинон окисляется и эпоксидируется с образованием 2,3-эпоксида витамина К. Регенерация эпоксида в дигидрохинон витамина К происходит следующим образом: сначала 2,3-эпоксид витамина К восстанавливается в витамин К тиолзависимой эпоксидредуктазой, коферментом которой является белок, подобный тиоредоксину. Затем образующийся в этой реакции витамин К восстанавливается ферментом витамин К тиолзависимой редуктазой в дигидрохинон витамина К. Донором водорода в этой реакции, так же, как и в предыдущей, служит тиоредоксинподобный белок (рис. 6). Недостаточность витамина К приводит к нарушению карбоксилирования проферментов прокоагулянтного пути и сопровождается кровоточивостью, подкожными и внутренними кровоизлияниями. Структурные аналоги витамина К дикумарол и варфарин ингибируют тиолзависимые ферменты витамин К 2,3-эпоксидредуктазу и витамин К редуктазу, вызывая торможение свёртывания крови (рис. 7). Эти препараты применяют в клинической практике для предупреждения тромбозов. Инициация каскада реакций прокоагулянтного пути. Ферментные мембранные комплексы прокоагулянтного пути образуются только при наличии на внешней поверхности плазматической мембраны клеток тканевого фактора и отрицательно заряженных фосфолипидов. Поперечная асимметрия плазматических мембран, в частности, определяется преобладанием в наружном слое нейтральных фосфолипидов (фосфатидил-холина и сфингомиелина), а во внутреннем – отрицательно заряженных (фосфатидилинозитол-бисфосфата и фосфатидилсерина). Специальная ферментная сисгема обеспечивает трансмембранный перенос и такое распределение фосфолипидов в клеточных мембранах, при котором в норме внешняя поверхность плазматических мембран клеток не заряжена. При нарушении поперечной асимметрии мембран тромбоцитов и эндотелиальных клеток на их поверхности формируются отрицательно заряженные (тромбогенные) участки и экспонируется апопротеин III тканевого фактора. Такие нарушения могут возникнуть при физической травме. В этом случае тканевый фактор и внутренняя поверхность клеточной мембраны становятся доступными для плазменных факторов прокоагулянтного пути. Кроме того, взаимодействие сигнальных молекул, вызывающих тромбогенез, с рецепторами эндотелиальных клеток и тромбоцитов активирует Са 2+ -зависимые регуляторные системы. В конечном итоге это приводит к повышению содержания в цитоплазме Са 2+ , который ингибирует АТФ-зависимую аминофосфолипидтранслоказу. Этот фермент играет важную роль в сохранении поперечной асимметрии мембран, так как переносит фосфатидилсерин из внешнего липидного слоя во внутренний. Снижение активности аминофосфолипидтранслоказы приводит к увеличению содержания во внешнем слое клеточной мембраны фосфатидилсерина и образованию отрицательно заряженных участков, необходимых для формирования мембранных ферментных комплексов. Кроме того, в результате такого нарушения структуры плазматической мембраны на её внешней поверхности экспонируется тканевый фактор и формируется первый ферментный комплекс прокоагулянтного пути свёртывания крови VII-ТФ-Са 2+ .
Активация ферментов каждого комплекса – результат взаимодействия всех его компонентов. Если факторы IX, X и II требуют активации, то фактор VII обладает невысокой протеолитической активностью. Фактор VII мембранного комплекса VII-ТФ-Са 2+ частичным протеолизом активирует факторы IX и X. Активные факторы IХа и Ха включаются в образование мембранных комплексов IXa-VIIIa-Са 2+ и Ха-Va-Са 2+ . При этом фактор Ха протеолитически активирует фактор V, а протромбиназный комплекс не только превращает протромбин в тромбин, но и активирует фактор VII, протеолитическая активность которого в комплексе VIIa-Тф-Са 2+ в 10 000 раз выше, чем в комплексе VII-Тф-Са 2+ . Образовавшийся в результате каскада реакций тромбин катализирует реакции частичного протеолиза фибриногена, фактора XIII и по принципу положительной обратной связи протеолитически активирует факторы V, VII и VIII. В процессе свёртывания действуют 2 механизма усиления сигнала: каскад реакций, в котором каждое ферментативное звено обеспечивает усиление сигнала, и положительные обратные связи. Контактный путь свёртывания крови начинается с взаимодействия профермента фактора XII с повреждённой эндотелиальной поверхностью сосудистой стенки. Такое взаимодействие приводит к активации фактора XII и инициирует образование мембранных ферментных комплексов контактной фазы свёртывания. Они содержат ферменты калликреин, факторы XIa (плазменный предшественник тромбопластина) и ХIIа (фактор Хагемана), а также белок-активатор – высокомолекулярный кининоген (ВМК) (рис. 8). Фактор XII – профермент, циркулирующий в крови. Он последовательно активируется двумя способами: сначала в результате изменения конформации при взаимодействии с отрицательно заряженной поверхностью повреждённого эндотелия, затем частичным протеолизом мембранным комплексом калликреин-ВМК. Высокомолекулярный кининоген – белок-активатор в ферментных мембранных комплексах ХIIа-ВМК, Xla-BMK и калликреин-ВМК. ВМК – гликопротеин плазмы крови, который синтезируется в печени и имеет молекулярную массу 120 кД. Он опосредует взаимодействие протеолитических ферментов контактной фазы свёртывания крови с коллагеном субэндотелия и, кроме того, является компонентом каллик-реин-кининовой системы. INCLUDEPICTURE “http://www.biochemistry.ru/biohimija_severina/img/B5873p676-a1.jpg” * MERGEFORMATINET Рис. 8. Схема прокоагулянтного (внешнего) и контактного (внутреннего) путей свёртывания крови. Обозначения: ВМК – высокомолекулярный кининоген; ТФ – тканевый фактор; → – активация факторов свёртывания крови; ····> активация факторов свёртывания по принципу положительной обратной связи; – мембранный фосфолипидный компонент ферментных комплексов. Все ферменты мембранных комплексов свертывающей системы крови являются протеазами и активируются частичным протеолизом. 1 – активированный в результате контакта с субэндотелием фактор XII превращает прекалликреин в калликреин; 2 – калликреин мембранного комплекса калликреин-ВМК активирует фактор XII; 3 – фактор ХIIа активирует фактор XI; 4 – активированный частичным протеолизом фактор ХIIа превращает прекалликреин в калликреин по принципу положительной обратной связи; 5 – фактор XIa мембранного комплекса XIa-BMK активирует фактор IX; 6 – фактор (Ха мембранного комплекса IXa-VIIIa-Са 2+ активирует фактор X; 7, 8 – фактор VIIa мембранного комплекса VIIa-Тф-Са 2+ активирует факторы IX и X; 9 – фактор Ха протромбиназного комплекса активирует фактор II; 10, 11 – тромбин (фактор II) превращает фибриноген в фибрин и активирует фактор XIII; 12 – фактор XIIIa катализирует образование амидных связей в геле фибрина. Калликреин – сериновая протеаза, субстратами которой являются, кроме фактора XII, белки плазмы крови плазминоген (профермент, участвующий в растворении фибрина) и кининогены с низкой (69 кД) и высокой (120 кД) молекулярной массой. При частичном протеолизе кининогенов образуются регуляторные пептиды кинины. В частности, мощный вазодилятатор брадикинин повышает проницаемость сосудов и вызывает разрушение клеточных мембран эндотелия. В результате контакта фактора XII с субэндотелием сосудов он активируется. Активный фактор ХIIа в комплексе с ВМК протеолитически превращает прекалликреин, связанный с мембраной посредством ВМК, в калликреин. Мембранный комплекс калликреин-ВМК по принципу положительной обратной связи частичным протеолизом активирует фактор XII. При этом фактор XII приобретает максимальную ферментативную активность и по принципу положительной обратной связи активирует связанный с ВМК прекалликреин. Кроме того, образовавшийся в результате частичного протеолиза фактор ХIIа протеолитически активирует фактор XI, а фактор ХIа в составе ферментного комплекса XIa-ВМК активирует фактор IX. Фактор IХа мембранного комплекса 1Ха-VIIIa-Са 2+ активирует фактор X, который в составе протромбиназного комплекса активирует протромбин. Каскад реакций, ведущий к образованию тромбина, может реализоваться двумя путями – прокоагулянтным (внешним) и контактным (внутренним) (рис. 8). Для инициации реакций внешнего пути необходимо появление тканевого фактора на внешней поверхности плазматической мембраны клеток, соприкасающихся с кровью. Внутренний путь начинается с активации фактора XII при его контакте с повреждённой поверхностью эндотелия сосудов и взаимной активации ферментов прекалликреина и фактора XII. Таким образом, в прокоагулянтном и контактном путях свёртывания крови последовательное образование мембранных ферментных комплексов приводит к активации фактора X и образованию протромбиназы. Этапы, одинаковые для обоих путей свёртывания крови, называют общим путём свёртывания крови. В настоящее время понятие о внутреннем и внешнем путях свёртывания считают достаточно условным, так как стало ясно, что комплекс УПа-ТФ-Са 2+ более эффективно активирует фактор IX, чем фактор X, а фактор VII активируется фактором 1Ха, хотя и значительно медленнее по сравнению с активацией фактором Ха. Следовательно, можно полагать, что каскад реакций свёртывания крови идёт преимущественно в линейной последовательности, а не по двум относительно независимым путям. Контактный путь, очевидно, не является абсолютно необходимым для инициации свёртывания; по-видимому, он служит для сопряжения системы свёртывания крови с различными регуляторными сисгемами организма, например калликреин-кининовой и системой ферментов фиб-ринолиза, растворяющей тромб. Кровь здорового человека in vitro свёртывается за 5-10 мин. При этом образование протромбиназного комплекса занимает 5 – 8 мин, активация протромбина – 2-5 с и превращение фибриногена в фибрин – 2-5 с. Снижение свёртываемости крови. При снижении свёртываемости крови наблюдают заболевания, сопровождающиеся повторяющимися кровотечениями. Гемофилии – наследственные болезни, характеризующиеся повышенной кровоточивостью. Причиной этих кровотечений (спонтанных или вызванных травмой) является наследственная недостаточность белков свёртывающей системы крови. Гемофилия А (классическая гемофилия) обусловлена мутацией гена фактора VIII, локализованного в X хромосоме. Классическая гемофилия составляет 80% всех случаев заболевания гемофилией. Гемофилия В встречается реже и обусловлена генетическим дефектом фактора IX. Дефект гена фактора VIII проявляется как рецессивный признак, поэтому этой формой гемофилии болеют только мужчины. Это заболевание сопровождается подкожными, внутримышечными и внутрисуставными кровоизлияниями, иногда опасными для жизни. Дефект фактора VIII встречается примерно у одного из 10 000 новорождённых. Больных лечат препаратами, содержащими фактор VIII, получаемыми из донорской крови или методами генной инженерии. Противосвертывающая система крови
1. Физиологические ингибиторы свёртывания крови играют важную роль в поддержании гемостаза, так как они сохраняют кровь в жидком состоянии и препятствуют распространению тромба за пределы повреждённого участка сосуда. Тромбин, образующийся в результате реакций прокоагулянтного и контактного путей свёртывания крови, вымывается током крови из тромба. Он может инактивироваться при взаимодействии с ингибиторами ферментов свёртывания крови или активировать антикоагулянтную фазу, тормозящую образование тромба. Белок плазмы крови антитромбин III – наиболее сильный ингибитор свёртывания крови; на его долю приходится около 80-90% антикоагулянтной активности крови. Он инактивирует ряд сериновых протеаз крови: тромбин, факторы IХа, Ха, ХIIа, калликреин, плазмин и урокиназу. Не ингибирует фактор VIIIa и не влияет на факторы в составе мембранных комплексов, а устраняет ферменты, находящиеся в плазме крови, препятствуя распространению тромбообразования в кровотоке. Взаимодействие антитромбина с ферментами свёртывания крови ускоряется в присутствии гепарина. Гепарин – гетерополисахарид, который синтезируется в тучных клетках. В результате взаимодействия с гепарином антитромбин III приобретает конформацию, при которой повышается его сродство к сериновым протеазам крови. После образования комплекса антитромбин III-гепарин-фермент гепарин освобождается из него и может присоединяться к другим молекулам антитромбина. При наследственном дефиците антитромбина III в молодом возрасте наблюдают тромбозы и эмболии сосудов, опасные для жизни. α2-Макроглобулин образует комплекс с сериновыми протеазами крови. В таком комплексе их активный центр полностью не блокируется, и они могут взаимодействовать с субстратами небольшого размера. Однако высокомолекулярные субстраты, например фибриноген, становятся недоступными для действия протеаз в комплексе α2-макроглобулинтромбин. Тромбин: что это, роль в крови, действие, применение в качестве препарата
© Автор: З. Нелли Владимировна, врач лабораторной диагностики НИИ трансфузиологии и медицинских биотехнологий, специально для СосудИнфо.ру (об авторах) Тромбин – один из участников механизма свертывания крови, при этом, далеко не маловажный. Имеющие общий корень понятия: «тромб», «тромбообразование», «тромбоз», «тромбиновое время», определенно касаются процесса формирования сгустков, которые в случае травм с повреждением сосудистой стенки останавливают кровотечение, препятствуют потере драгоценной жидкости, чем нередко спасают жизнь человека. Или же, наоборот, свертки, образованные в очаге поражения эндотелия патологическим процессом, отрываясь и перемещаясь с током крови, закрывают просвет сосуда и тем самым создают опасные для жизни ситуации. Тромбин в плазмеТромбин в плазме в готовом виде не содержится. Он в аварийной ситуации должен образоваться из предшественника – протромбина (фактора II – FII), который сам прежде будет активирован фактором Х (внешний путь свертывания крови). Однако до того, пока начнется процесс образования тромбина:
При травмах все эти преобразования (активация факторов свертывания, переход протромбина в тромбин, фибриногена – в фибрин) представляют собой очень сложный, но весьма нужный организму защитный механизм. И если вдруг по каким-либо причинам этот процесс нарушен, то недостающее звено в виде полученных из донорской плазмы препаратов врачи возмещают пациенту извне и, таким образом, останавливают кровотечение. Болезни сердца и сосудов + тромбинДругое дело, если эти процессы начинают идти тогда, когда в этом нет необходимости, но есть патология, влекущая поражение выстилки кровеносных сосудов и развитие местных реакций с активацией факторов свертывания:
Хотя в подобных случаях в целом система гемостаза как бы остается в норме, но патологические изменения эндотелия расстраивают деятельность систем свертывания и противосвертывания на месте поражения сосуда. Местное образование тромбина (которого, как известно, в готовом виде при отсутствии кровотечений в плазме нет) создает условия для формирования тромбов, повышающих риск развития тромбозов и тромбоэмболий во много раз. Например, врачи нередко отмечают особо «дружеские отношения» между атеросклерозом и тромбозом. И, если представить, что сосуды только малой части населения определенного возраста не затронул атеросклеротический процесс, а все остальные люди 50 – 60 лет в той или иной степени уже жалуются на симптомы атеросклероза (или пока не знают о нем), то можно предположить, что скажет статистика о распространении:
Тромбин во флакончикеВ списке лекарственных препаратов, предназначенных для предотвращения потери такой драгоценной жидкости, как кровь, при ранениях или хирургических операциях, то есть, для остановки кровотечений, числится гемостатик, называемый тромбином. Тромбин, полученный из крови (плазмы) доноров, подвергается лиофильному высушиванию и в виде стерильного лиофилизата (сухой порошок) выпускается в герметически закрытых пенициллиновых флакончиках или ампулах. Готовый гемостатик имеет активность не менее 125 МЕ, он представляет собой активированный протромбин плазмы крови, несущий значимую функцию в реакции гемокоагуляции. Контакт лиофилизата с кровью, нативной плазмой либо растворами фактора I (фибриногена) возбуждает стремительное образование кровяного сгустка – в этом состоит основное действие данного препарата как кровоостанавливающего средства.
Перед использованием препарат при соблюдении правил асептики растворяется изотоническим раствором хлорида натрия, количество которого указывается на этикетке. После разведения сухого тромбина полученный раствор выдерживается 3-5 минут. Чтобы использовать разведенный тромбин в качестве лекарственного средства, способного остановить кровь, его в большом количестве наносят на стерильный марлевый тампон, который прикладывают к кровоточащей ранке на 5-10 минут (манипуляция проводится с чрезвычайной осторожностью, иначе есть риск разрушить нежный сверток, образовавшийся в месте кровотечения). Тромбин никогда не вводится в вену или мышцу – подобное действие недопустимо, поскольку может закончиться гибелью больного в результате тромбоза кровеносных сосудов. Данный гемостатик может быть применен исключительно местно при:
Флакончиком тромбина комплектуется набор, называемый фибриностатом (фибриностат – «фибриновый клей быстрого действия», фибриностат М – «фибриновый клей медленного действия»), предназначенный для приготовления геля, цель которого – остановить кровотечение. Данный гемостатический препарат разработан в Белоруссии специалистами Республиканского научно-практического центра трансфузиологии и медицинских биотехнологий. Помимо тромбина с активностью 125 МЕ, в состав набора входит фибриноген, также полученный при фракционировании плазмы (1-я фракция), и хлорид кальция. «Фибриновый клей» склеивает, фиксирует и помогает регенерации тканей при хирургических операциях и травмах.
| |||||||


 – остатки карбоксиглутаминовой кислоты; штрихстрелки указывают положение гидролизуемых в молекуле протромбина пептидных связей. Молекула протромбина состоит из одной полипептидной цепи, а образующийся в результате частичного протеолиза протромбина тромбин состоит из двух полипептидных цепей, связанных между собой одной дисульфидной связью.
– остатки карбоксиглутаминовой кислоты; штрихстрелки указывают положение гидролизуемых в молекуле протромбина пептидных связей. Молекула протромбина состоит из одной полипептидной цепи, а образующийся в результате частичного протеолиза протромбина тромбин состоит из двух полипептидных цепей, связанных между собой одной дисульфидной связью.


 перейти в каталог файлов
перейти в каталог файлов