Геморрагический инфаркт
Геморрагический инфаркт (ишемический инфаркт с геморрагической трансформацией) – инфаркт в основе которого лежит ишемизация нервной ткани с последующим достаточно быстрым развитием реканализации пораженного сосуда и формированием кровяного пропитывания на участке ишемического инсульта. Часто такой инфаркт возникает при кардиоэмболическом типе развития ишемии.
 Рис.1 Следы геморрагического пропитывания на участке ишемического инсульта в виде гиперденсных ретикулярных зон в веществе мозга в отличии от области ишемического инсульта – гиподенсная зона справа. Былые стрелки обозначают зону ишемического повреждения, а жёлтые – область кровяного пропитывания.
Рис.1 Следы геморрагического пропитывания на участке ишемического инсульта в виде гиперденсных ретикулярных зон в веществе мозга в отличии от области ишемического инсульта – гиподенсная зона справа. Былые стрелки обозначают зону ишемического повреждения, а жёлтые – область кровяного пропитывания.
 Рис.2 На МРТ геморрагическое пропитывание выглядит как неоднородный, смешанный МР-сигнал с участками чередующегося повышенного и пониженного МР-сигнала по Т2 и Flair, а так же повышенного МР-сигнала на Т1 в подострую фазу. Былые стрелки обозначают зону ишемического повреждения, а жёлтые – область кровяного пропитывания.
Рис.2 На МРТ геморрагическое пропитывание выглядит как неоднородный, смешанный МР-сигнал с участками чередующегося повышенного и пониженного МР-сигнала по Т2 и Flair, а так же повышенного МР-сигнала на Т1 в подострую фазу. Былые стрелки обозначают зону ишемического повреждения, а жёлтые – область кровяного пропитывания.
 Рис.3 На МРТ в режиме градиентного эхо отмечается отчётливо выраженное понижение МР-сигнала от участка геморрагического пропитывания.
Рис.3 На МРТ в режиме градиентного эхо отмечается отчётливо выраженное понижение МР-сигнала от участка геморрагического пропитывания.
Автор: врач-рентгенолог, к.м.н. Власов Евгений Александрович
Полная или частичная перепечатка данной статьи, разрешается при установке активной гиперссылки на первоисточник
Похожие статьи

Аневризмы артерий головного мозга, структура, расположение, МР-признаки, диагностика, наблюдение, признаки разрыва и оценка эффективности лечения.

Артериовенозная мальформация (АВМ) – врожденный патологический сосудистый клубок большого количества мелких артерий и одной или двух расширенных дренажных вен, связанных напрямую, без капиллярного русла.

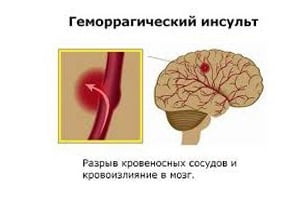
Геморрагический инсульт – острое нарушение мозгового кровообращения с разрывом артерий, вен, сосудистой мальформации, фистулы или аневризмы, образованием кровоизлияния в мозг, верифицированное на визуализации

Ишемический инфаркт (инсульт) – органическое поражение ЦНС, вызванное острым нарушением мозгового кровообращения с развитием ишемии нервной ткани и появлением инфаркта, сопровождающееся характерными морфологическими проявлениями на визуализации (МРТ и КТ)

Контрастирование при ишемическом инсульте возникает в подострой фазе и может наблюдаться еще некоторое время в хронической фазе

Дифференциальная диагностика ишемического инсульта с другой органической патологией ЦНС

Последствия инсульта, перенесенного во взрослом возрасте сохраняются на всю жизнь в виде глиозных и атрофических изменений без тенденции к уменьшению или увеличению области поражения (исключение составляют лишь повторные и вновь возникшие инсульты, рядом со следами перенесенного ранее)

На основе морфологической оценки при визуализации в большинстве случаев удаётся заподозрить механизм развития церебральной ишемии с возможным установлением его причины.

Венозный инфаркт возникает при тромбозе мозговой вены или дурального синуса, при котором сохраняется артериальный приток, но отсутствует венозный отток.
![]()
Амилоидная ангиопатия, болезнь Бинсвангера, Кавернозная ангиома, Варианты Виллизиева круга, трифуркация внутренней сонной артерии, гипоплазия мозговой артерии, осложнения в виде кровоизлияния, ишемии. Венозная ангиома, венозная дисплазия.
Геморрагическая трансформация ишемического инфаркта
Геморрагическая трансформация является осложнением ишемического инфаркта головного мозга и может значительно ухудшить прогноз.
На этой странице:
терминология
Следует отметить, что термин геморрагическая трансформация используется немного по-разному и в совокупности относится к двум различным процессам, которые имеют различную частоту, внешний вид и прогностические последствия. Это:
- петехиальное кровоизлияние
- внутримозговая гематома
Таким образом, при использовании термина следует попытаться четко указать, какой из них имеет в виду.
ECASS II классификация
Для Европейского совместного исследования острого инсульта (ECASS II) была разработана общепринятая система классификации, которая разделяет геморрагическую трансформацию на четыре подтипа 9:
- геморрагический инфаркт типа 1 (HI1)
- петехиальные кровоизлияния на краях инфаркта
- геморрагический инфаркт типа 2 (HI2)
- петехиальные кровоизлияния по всему инфаркту
- нет массового эффекта, связанного с кровоизлияниями
- паренхиматозная гематома типа 1 (PH1)
- ≤30% инфарктной области
- незначительный массовый эффект, связанный с гематомой
- паренхиматозная гематома типа 2 (PH2)
- > 30% зоны инфаркта
- существенный массовый эффект, связанный с гематомой
эпидемиология
Частота геморрагической трансформации ишемического инсульта неоднократно сообщалась, но, как правило, более половины всех инфарктов головного мозга на той или иной стадии развивают некоторый геморрагический компонент. Большая часть геморрагической трансформации после инсульта (89%) — это петехиальные кровоизлияния; меньшинство (11%) гематом 5,6.
Пострадавшая группа пациентов представляет собой подгруппу пациентов, перенесших инфаркт головного мозга. Следовательно, пациенты, страдающие геморрагической трансформацией, чаще страдают от ишемических инсультов, такие как пожилые люди и цереброваскулярные факторы риска. Помимо этого, некоторые факторы увеличивают риск геморрагической трансформации инсульта, в том числе 11:
- пожилой возраст
- больший размер хода
- этиология кардиоэмболического инсульта 1
- применение антикоагулянтов
- лихорадка
- гипергликемия
- низкий уровень холестерина в сыворотке
- повышенное систолическое артериальное давление в острой обстановке
- тромболитическая терапия или другая реканализация
Хотя геморрагическая трансформация может происходить спонтанно, она чаще встречается у пациентов, получающих антикоагулянтную терапию, и еще чаще у пациентов, проходящих тромболитическую терапию 1,2,4. Сообщается, что общий уровень спонтанной геморрагической трансформации (с гематомой)
5% 5. Частота симптоматической геморрагической трансформации, однако, намного ниже, от 0,6 до 3% у нелеченных пациентов и до 6% пациентов, получавших IV tPA 2,4,6.
После IV tPA предикторы геморрагической трансформации включают 6:
- тяжелые инсульты (NIHSS> 14)
- окклюзия проксимальной средней мозговой артерии
- гиподенситивность (КТ), поражающая> 1/3 территории средней мозговой артерии
- отсроченная реканализация (> 6 часов после начала инсульта)
- отсутствие побочного потока
Клиническая презентация
В то время как различные критерии использовались для определения того, является ли кровотечение симптоматическим, только паренхиматозные гематомы были последовательно связаны с неврологическим ухудшением и ухудшением отдаленных результатов 10. Многие случаи геморрагической трансформации, в том числе большинство петехиальных кровоизлияний, не имеют симптомов.
Значительная геморрагическая трансформация инфаркта головного мозга обычно проявляется в быстром и часто глубоком ухудшении клинического состояния.
У нелеченных пациентов геморрагическая трансформация редко происходит в первые 6 часов. Обычно это наблюдается в первые несколько дней, большинство в течение 4 дней после инфаркта. У пациентов, которые были подвергнуты острому лечению тромболизисом или тромбэктомией, кровотечение происходит в подавляющем большинстве в течение 24 часов после начала лечения 3.
Петехиальная геморрагическая трансформация традиционно упоминается патологами как «красное смягчение» в отличие от более распространенного мягкого или анемического инфаркта.
Считается, что геморрагическая трансформация происходит в результате сохраненной коллатеральной перфузии (из соседних сосудов / территорий) или в результате реперфузии инфарктных тканей, которые ослабили сосуды (то есть из-за экстравазации или диапедеза) 1. Первое объясняет, почему геморрагическая трансформация наблюдается у пациентов с постоянно закупоренными сосудами. Последнее объясняет увеличение заболеваемости у пациентов, получающих терапию, предназначенную для увеличения частоты реперфузии.
Рентгенографические особенности
Рентгенологические особенности различаются при петехиальном кровоизлиянии и вторичной гематоме.
Петехиальные кровоизлияния, как следует из названия, обычно проявляются в виде крошечных точечных областей кровоизлияния, часто не поддающихся индивидуальному разрешению, а скорее приводящих к повышенному затуханию области при КТ или потере сигнала при МРТ. Хотя это изменение петехиального может привести к тому, что кора головного мозга выглядит почти нормальной, его не следует путать с явлением запотевания, наблюдаемым на КТ, которое происходит через 2–3 недели после инфаркта.
В случае вторичных гематом рентгенологические признаки как на КТ, так и на МРТ представляют собой просто сумму признаков ишемического инфаркта с наложенным кровоизлиянием в мозг. Количество кровоизлияний относительно размера инфаркта может широко варьироваться, но обычно можно определить значительные участки мозга, которые инфарктированы, но не геморрагические. Это может быть не так, если кровоизлияние большое и основной инфаркт мал.
Петехиальное кровоизлияние обычно более выражено в сером веществе и приводит к увеличению ослабления. Это иногда имитирует нормальную плотность серого вещества и способствует явлению запотевания.
Появление МРТ такое же, как и ожидалось для ишемического инсульта, демонстрируя ограниченную диффузию на последовательностях DWI / ADC. Последовательности, восприимчивые к выпадению сигнала из-за продуктов крови (особенно SWI), полезны, поскольку они более чувствительны, чем КТ, к раннему кровоизлиянию и могут помочь в прямой терапии (например, не допустить тромболитической терапии), хотя их трудно получить в условиях чрезмерной остроты.
Лечение и прогноз
В случае петехиального кровоизлияния обычно не влияют ни прогноз, ни лечение. То же самое нельзя сказать о вторичных гематомах, которые в больших количествах могут оказать существенное негативное влияние на выживаемость и заболеваемость. Фактически, во многих исследованиях тромболизиса именно эти вторичные гематомы почти сводят на нет успехи, достигнутые успешной реперфузией.
Ишемический инфаркт головного мозга
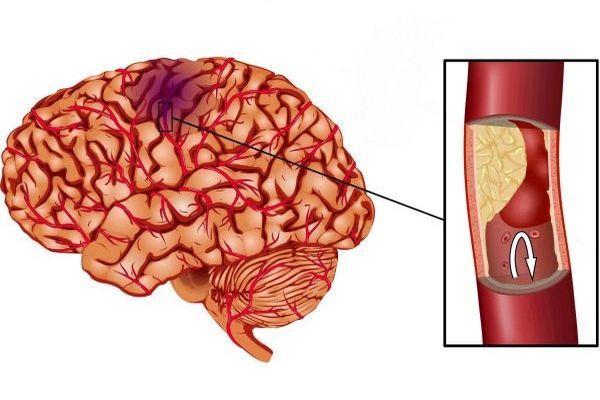
Инфаркт – некроз (отмирание тканей) участка головного мозга вследствие недостаточности кровоснабжения, это такое состояние, которое часто называют инсульт ишемического типа, что обусловлено идентичными механизмами развития. Мозговое вещество чувствительно к кислородному голоданию. В нервных клетках не содержатся запасы энергетических ресурсов, что обуславливает их скорую гибель без поступления питательных веществ и кислорода с током крови. Размеры очага поражения определяют характер и степень выраженности нарушений.
Общая информация
Инфаркт мозга – это такое состояние, которое отражает повреждение нервной ткани на фоне нарушения кровотока, что определяет последствия (дисфункция мозга, неврологический дефицит). Инфаркт – это патологический процесс. Ишемический инсульт – комплекс симптомов, возникающих вследствие нарушения мозгового кровотока, протекающего в острой форме.
Механизм развития в обоих случаях одинаковый. Инсульт развивается при критическом снижении объема поступающей крови к определенному отделу мозга. Обычно нарушения затрагивают отдельный бассейн мозговых артерий. Реже происходит обширный инфаркт, когда в патологический процесс вовлекаются артерии нескольких бассейнов головного мозга.
Вследствие прекращения кровотока возникает инфаркт мозга – образование очага некроза мозгового вещества. Инфаркт мозга – это болезнь, которая сопровождается нарушением функций мозга, что обуславливает развитие неврологической симптоматики. Распространенность патологии составляет 1-4 случая на 1 тысячу населения ежегодно. Более 50% инфарктов с локализацией в тканях мозга диагностируется у пациентов старше 70 лет.
Классификация патологии
Инфаркт, затронувший ткань головного мозга – это такой патологический процесс, который различается по характеру течения и обратимости неврологических симптомов, что позволяет выделять формы (малый, обширный). При малой форме, доля которой в общей структуре инсультов составляет около 15%, симптоматика полностью регрессирует на протяжении 2-20 дней. По степени завершенности патологического процесса выделяют формы: прогрессирующая, завершенная.
В первом случае интенсивность симптомов нарастает, во втором – наблюдается стабилизация или регресс проявлений патологии. Инфаркт мозгового вещества – это такое состояние, которое всегда обусловлено нарушением проходимости сосудов, пролегающих в головном мозге, что предполагает выделение форм с учетом этиологических факторов:
- Атеротромботическая. Чаще развивается на фоне атеросклероза, поразившего экстракраниальные или интракраниальные артерии большого диаметра. Коррелирует с повреждением целостности, разрушением атеросклеротической бляшки, от которой отрываются частицы – эмболы, впоследствии закупоривающие артериальное русло. Встречается с частотой около 55% случаев.
- Кардиоэмболическая. Развивается вследствие эмболии (закупорки артериального просвета) кардиоцеребрального генеза, когда нарушения возникают из-за патологий сердца. В роли эмболов выступает тромболитический субстрат (кровяные сгустки), образовавшийся в клапанных отделах сердца и его полостях. Встречается с частотой около 20% случаев.
- Гемодинамическая. Развивается как результат стенозирующих процессов, протекающих в тяжелой форме. Грубое поражение артерий выражается в стойком сужении просвета с уменьшением площади сечения больше, чем на 70% от нормы. Встречается с частотой около 15% случаев. В патологический процесс обычно вовлечены артерии, пролегающие в зоне шеи и головы. Стеноз чаще ассоциируется с атеросклеротическим поражением сосудистой стенки. Провоцирующий фактор – резкое снижение показателей артериального давления.
- Реологическая. Развивается по принципу гемореологической микроокклюзии (множественное нарушение проходимости артерий мелкого калибра). Нарушения чаще спровоцированы тромбозом, поразившим мозговые артерии. Причины возникновения коррелируют с болезнями крови и расстройством функций системы гемостаза (регуляция состояния крови), что приводит к гиперкоагуляции (повышенная склонность к свертыванию с образованием сгустков) и увеличению вязкости крови. Встречается с частотой около 9% случаев.
- Лакунарная. Ассоциируется с множественной окклюзией (нарушение проходимости) мелких церебральных артерий. Обычно очаги инфаркта локализуются в зоне подкорковых ядер. Клинические проявления идентичны признакам лакунарного синдрома (наличие артериальной гипертензии в анамнезе, развитие симптоматики преимущественно в ночное время, отсутствие боли в зоне головы, проблемы с речью не выявляются). Патогенез схож с механизмом развития атеротромботической формы, но клиническая картина различается. Встречается с частотой около 30% случаев.
Формы инфаркта выделяют с учетом локализации патологического очага – в каротидном (артерии внутренняя сонная, передняя и средняя мозговые) или вертебробазилярном (артерии позвоночная, базилярная, задняя мозговая) бассейне. Очаги, образующиеся в вертебробазилярном бассейне, могут затрагивать зону мозжечка и таламуса.
Причины возникновения
Распространенная причина инфаркта, протекающего в головном мозге – атеросклеротическое поражение мозговых артерий (около 95% случаев), что приводит к тромбозу или эмболии (закупорка сосудистого просвета эмболом – частицей, в норме не свойственной крови) сосудистого русла. Кардиогенная (спровоцированная нарушением деятельности сердечно-сосудистой системы) эмболия нередко становится причиной развития ишемических процессов.
В патогенезе образования очага инфаркта участвуют стенозирующие (провоцирующие сужение сосудистого просвета) процессы и нарушение нейрогуморальной регуляции тонуса артериальной стенки. ТИА (ишемическая атака преходящего типа) является маркером, указывающим на высокий риск образования очага инфаркта. Статистика показывает, у 40% пациентов с ТИА в анамнезе инсульт развивается в 5-летний период. Провоцирующие факторы:
- Артериальная гипертензия.
- Гиперлипидемия (повышение концентрации липидных фракций в крови).
- Сахарный диабет.
- Мерцательная аритмия.
Факторы риска: перенесенный малый инфаркт, возраст старше 50 лет, мигренозный статус, недостаток двигательной активности, избыточный вес. В группе риска пациенты с заболеваниями системы кроветворения, сердечной недостаточностью, другими патологиями сердца и элементов кровеносной системы, злоупотребляющие алкогольными напитками, курящие.
Ухудшение, ослабление мозгового кровотока коррелирует с патологиями сосудов, в числе которых атеросклероз, варикозное расширение участков вен, расположенных в области нижних конечностей, васкулиты (системное поражение стенок сосудов воспалительного характера), сосудистые мальформации и другие заболевания элементов кровеносной системы.
Основные симптомы
Инфаркт головного мозгового вещества клинически проявляется неврологической симптоматикой очагового типа в зависимости от бассейна, в котором находятся пораженные артерии. Основные признаки:
- Параличи, парезы преимущественно односторонние с локализацией в зоне конечностей, лица.
- Зрительная дисфункция (выпадение полей зрения, появление посторонних предметов в зоне обзора).
- Расстройство речи.
- Парестезия (расстройство чувствительности, проявляется ощущением покалывания, ползания мурашек).
- Апраксия (нарушение двигательной активности, сложности при выполнении согласованных, произвольных движений).
- Пространственное игнорирование одностороннего типа (отсутствие рефлекторных реакций на внешние раздражающие стимулы в одной половине туловища).
- Нарушение двигательной координации.
- Головокружение, неустойчивость в вертикальном положении, сложности при удержании равновесия.

Инфаркт с локализацией в головном мозге нередко проявляется симптомами общемозгового типа с такими последствиями, как боль в зоне головы, тошнота, сопровождающаяся рвотой, помрачение сознания. Чаще очаговые симптомы доминируют в клинической картине. Если преобладает общемозговая симптоматика (боль в зоне головы, помрачение сознания), это свидетельствует о тяжелом течении, обусловленном обширными поражениями зоны ствола и мозжечка.
При инсульте в 60% случаев достаточно несколько минут, чтобы сформировалась клиническая картина. Инфаркт мозга может протекать скрыто без выраженных симптомов, присущих ишемическому инсульту, что указывает на различие патологических состояний и их последствий. Инфаркт – патоморфологические изменения, происходящие в тканях мозга, инсульт – симптомокомплекс (синдром).
Диагностика
Достоверный диагноз ишемический инфаркта ставят по результатам нейровизуализации (КТ, МРТ) головного мозга. Если невозможно сделать КТ, МРТ, назначают люмбальную пункцию. Анализ цереброспинальной жидкости позволяет выявлять геморрагическую природу инсульта, исключать патологии – менингит, кровоизлияние в мозговое вещество или субарахноидальное (под паутинной оболочкой) пространство. Заподозрить развитие инсульта ишемического типа можно по признакам:
- Потеря чувствительности в зоне лица.
- Внезапная мышечная слабость (чаще в одной половине тела).
- Неожиданное расстройство зрения.
- Нарушение речи (сложности при произношении слов и понимании обращенных к больному фраз).
- Головокружение, невозможность удерживать туловище в вертикальном положении.
При внезапном развитии и остром течении возможно грубое нарушение сознания, вплоть до развития комы. Анализ крови (общий, биохимический) показывает концентрацию глюкозы, липидов, тромбоцитов, скорость свертываемости и другие реологические свойства. Инструментальные методы исследования (электрокардиография, УЗ-допплерография, ангиография, электроэнцефалография) дают представление о состоянии и функциональности органов и систем.

Методы лечения
Лечение инфаркта мозга направлено на нормализацию функций дыхательной и сердечно-сосудистой системы, поддержание нормальных значений артериального давления и гомеостаза (естественная саморегуляция организма), устранение судорожного синдрома и отека мозгового вещества.
При благоприятном течении происходит резорбция (рассасывание) некротизированной, отмершей ткани. На месте очага инфаркта формируется рубец, состоящий из глиальных нервных клеток. В некоторых случаях очаг некроза трансформируется в кистозную полость. В острую фазу патологического процесса больные нередко нуждаются в экстренных мерах медицинской реабилитации.
Для восстановления функций дыхания пациентов подключают к аппарату ИВЛ (вентиляция легких искусственным способом), выполняется очистка дыхательных путей с последующей установкой воздуховода. Эндотрахеальная интубация (помещение дыхательной трубки в трахею) выполняется по показаниям (дыхательная недостаточность, брадипноэ – редкое дыхание, тахипноэ – учащенное, поверхностное дыхание).
Назначают препараты, регулирующие показатели артериального давления. Для снижения АД применяют Каптоприл, Эналаприл. Проводится тромболизис (внутривенное введение лекарств, растворяющих тромбы), показана антиагрегантная терапия (препятствует аккумуляции тромбоцитов и образованию тромбов). Иногда показаны терапевтические мероприятия:
- Терапия вазоактивными (сосудорасширяющими) средствами.
- Гиперволемическая гемодилюция (повышенное содержание водной фракции в крови) – введение препаратов для коррекции вязкости циркулирующей крови.
- Хирургическое лечение. Методы: декомпрессивная краниотомия (удаление части черепной кости для предотвращения сдавливания мозгового вещества, расширенного вследствие отека), хирургическое удаление тромба, расположенного внутри магистральной артерии.
Параллельно назначают нейропротекторы (препятствуют повреждению нейронов, стимулируют процессы метаболизма в нервной ткани), лечение статинами (для снижения концентрации липидов). После перенесенного инфаркта с локализацией в веществе головного мозга проводится восстанавливающее лечение и реабилитация.
Восстановление двигательной активности наиболее заметно в начальные 3 месяца реабилитационного лечения. Неблагоприятным прогностическим критерием является сохранившаяся гемиплегия (утрата способности совершать произвольные движения рукой и ногой в половине тела) к концу 1 месяца терапии. В период позднего восстановления применяются методы: пассивная, активная лечебная гимнастика, физиотерапия, массаж.

Возможные последствия и прогноз
Сколько живут после образования очага инфаркта в веществе головного мозга, зависит от локализации и размеров участка пораженной ткани. На продолжительность жизни влияют другие факторы – возраст и общее состояние здоровья пациента, наличие сопутствующих патологий, характер течения и реакция на терапию.
Последствия появления очага инфаркта в тканях головного мозга связаны с высоким риском летального исхода, причем среди пожилых людей уровень смертности выше, чем в других возрастных группах. Статистика показывает, около 25% пациентов, перенесших острый, обширный мозговой инфаркт, погибают в течение следующего месяца, около 40% больных – на протяжении следующего года. Основные причины летального исхода при мозговом инфаркте:
- Геморрагическая трансформация с повторным кровоизлиянием в вещество мозга.
- Отек мозгового вещества.
- Дислокация (смещение) структур мозга.
- Повторная ишемия в зоне ствола с формированием новых очагов инфаркта.
- Пневмония и тромбоэмболия элементов кровеносной системы легких.
- Эпилептический статус.
- Прогрессирующая гидроцефалия.
Статистика показывает, уровень летального исхода спустя 5 лет после перенесенного эпизода мозгового инфаркта составляет 50% случаев. К неблагоприятным прогностическим критериям относят пожилой возраст, сердечную недостаточность и инфаркт миокарда в анамнезе, диагностированную мерцательную аритмию.
Если после успешного реабилитационного лечения, нарушения мозгового кровотока не дают о себе знать, прогноз относительно благоприятный. Продолжительность жизни после перенесенного эпизода инсульта в 25% случаев превышает 10 лет.
Инфаркт мозга – патологический процесс, характеризующийся формированием очага некроза в мозговой ткани. Обычно состояние спровоцировано нарушением проходимости кровеносных сосудов, питающих мозг, что приводит к ухудшению кровоснабжения нервной ткани. Своевременная диагностика и корректная терапия увеличивают шансы больного на выздоровление.
Внутримозговое кровоизлияние и геморрагическая трансформация ишемического инсульта: обнадеживающие результаты лечения
Виничук С.М., Волосовец А.А., Национальный медицинский университет им. А.А. Богомольца, г. Киев; Пустовая О.А., Луганский государственный медицинский университет; Трепет Л.Н., Александровская клиническая больница, г. Киев; Сафонова Е.Ф., Лошак А.М., Луганская областная клиническая больница
Как известно, церебральная геморрагия наиболее часто проявляется внутримозговым кровоизлиянием (ВМК) и геморрагической трансформацией ишемического инсульта (ГТИИ). Результаты проведенных международных исследований показали, что эффективность консервативных и хирургических методов лечения больных с этой патологией явно недостаточна и не может удовлетворять практических врачей. Целью исследования являлось определение эффективности и безопасности применения высоких доз Цераксона и Актовегина в лечении спонтанного ВМК и ГТИИ. Обследованы 62 пациента с гипертензивным ВМК и 10 пациентов с ГТИИ. В зависимости от применяемой терапии выделены две группы: 1-я – 27 больных, которым назначали внутривенно Цераксон (2 г/сут) + Актовегин (1 г/сут), из них 10 пациентов получали Цераксон с догоспитального этапа; 2-я группа включала 22 больных, которым назначали традиционную терапию. Анализировались также клиническое течение и исход ВМК (13 пациентов) после хирургического лечения (объем гематомы более 40 см3) и ГТИИ (10 больных) в группе пациентов, получавших Цераксон и Актовегин. Эффективность лечения оценивалась по современным неврологическим шкалам, состоянию окислительно-антиоксидантного гомеостаза и данным методов нейровизуализации. Результаты исследования показали, что лечение ВМК с использованием нейропротекторной и антиоксидантной терапии начиная с догоспитального этапа ускоряло темпы регрессирования неврологического дефицита; при курсовой терапии на 21-е сутки выявлена высокая эффективность лечения по показателям шкалы NIHSS и мШР у 73,1 % пациентов; на фоне традиционной терапии – у 30,0 %. У больных с ВМК и объемом гематомы более 40 см3 после хирургического лечения с последующим приемом нейропротекторов высокая эффективность терапии наблюдалась у 66,6 %. Более эффективным было лечение больных с ГТИИ, получавших Цераксон и Актовегин (80,0 %). Проведенное исследование показало перспективность более раннего назначения нейропротекторной и антиоксидантной терапии больным с ВМК и ГТИИ – начиная с догоспитального этапа.
Внутримозговое кровоизлияние, геморрагическая трансформация ишемического инсульта, лечение, Цераксон, цитиколин, Актовегин.
Мозговой инсульт с его непредвиденным клиническим течением и прогнозом ложится тяжелым бременем на больных, членов их семей и общество в целом. На лечение этих пациентов тратится значительная часть бюджета. Высокие экономические затраты определяются также необходимостью обеспечения длительного ухода, трудовой, бытовой и социальной реадаптации больных. Наиболее тяжелой и инвалидизирующей формой острых нарушений мозгового кровообращения геморрагического характера являются внутримозговые кровоизлияния (ВМК). Выделяют такие основные подтипы ВМК: первичное внутримозговое кровоизлияние (ПВМК) в ткань головного мозга (внутримозговая гематома (ВМГ), микрокровотечения); вторичное кровоизлияние, обусловленное сосудистой мальформацией, разрывом аневризмы, коагулопатией, опухолью; геморрагическая трансформация ишемического инсульта (ГТИИ), которая при определенных условиях может возникать как этап естественного течения заболевания, а также вследствие проведения реперфузионной терапии. ГТИИ – это общий термин для всех случаев ишемического инсульта с вторичным интракраниальным кровоизлиянием, в рамках которого выделяют два основных типа геморрагии: геморрагический инфаркт и инфаркт-гематома или паренхиматозная гематома.
Таким образом, церебральная геморрагия может проявляться спонтанным внутримозговым кровоизлиянием и геморрагическим инфарктом или инфарктом-гематомой, которые являются как бы противоположными сторонами единого патофизиологического процесса [22].
Первичная гематома – это относительно большое гомогенное скопление крови, которое занимает определенный объем, вызывая деструкцию клеток, смещая и разрушая окружающую ее ткань головного мозга. Она отличается более правильной округлой формой и окружена зоной отека большего размера по сравнению с инфарктом-гематомой. Локализация первичной гематомы не обязательно соответствует зонам кровообращения определенного сосудистого бассейна.
Инфаркт-гематома проявляется гомогенным очагом высокой плотности, по форме напоминающим озерцо, и занимает определенный участок инфаркта мозга.
Геморрагический инфаркт характеризуется пропитыванием кровью ишемизированной ткани мозга без смещения и обязательной деструкции клеток головного мозга [15, 16].
Методы лечения ВМК и ГТИИ
Лечение острого ВМК
ВМК – это критическое состояние с частым и ранним продолжением кровотечения и увеличением гематомы, прогрессирующим ухудшением, поэтому такие больные требуют оказания неотложной помощи и экстренной госпитализации.
Основные направления лечения острых ВМК сформулированы в рекомендациях Европейской инсульт-инициативы [29] и Американских ассоциаций сердца и инсульта [17].
С учетом описанных концепций повторного кровотечения и увеличения гематомы рекомендации включают остановку или замедление кровотечения в течение первых часов после начала заболевания, удаление крови из тканей или желудочков головного мозга, лечение мозговых осложнений, прежде всего повышенного внутричерепного давления, сниженную церебральную перфузию и др.
Специфические методы лечения спонтанного ВМК включают два основных подхода:
Среди методов консервативной терапии обоснованным является применение в острейшем периоде (первые 3- 4 ч) гемостатической терапии. Однако применяемые ранее в клинической практике гемостатические препараты (транексаминовая кислота, эпсилон-аминокапроновая кислота, апротинин, этамзилат натрия) не доказали свою эффективность в лечении острых ВМК. Не отмечено благоприятного эффекта в лечении данного заболевания и в случаях применения рекомбинантного активированного фактора VII.
Результаты рандомизированного двойного слепого плацебо-контролируемого исследования ІІІ фазы FAST (Factor Seven for Acute Haemorragic Stroke trial – Исследование фактора VII при остром геморрагическом инсульте), включавшего 821 больного с острым ВМК, которых лечили активированным рекомбинантным фактором свертывания VII (rF VIIa) в первые 4 ч от начала инсульта, подтвердили факт уменьшения распространения гематомы, но не выявили каких-либо преимуществ по выживаемости или функциональному исходу по сравнению с группой плацебо через 90 дней после начала заболевания. К тому же применение rF VIIa в дозе 80 мкг/кг было связано с 5% увеличением частоты тромбоэмболических осложнений [23].
Распространенным методом лечения ВМК при нарастании гематомы является хирургическое лечение. Однако анализ результатов недавно проведенного международного исследования STICH (Surgical Trial in Intracerebral Haemorrage – Хирургическое исследование при интрацеребральном кровоизлиянии) по определению эффективности консервативных и хирургических методов лечения, в которое были включены 1033 больных с острым ВМК, не выявил преимущества хирургического удаления глубоких внутримозговых гематом по сравнению с консервативной терапией ни по показателю летальности, ни по функциональным исходам [23].
Лечение ишемического инсульта с геморрагической трансформацией ишемического очага
Современные направления терапии острого ишемического инсульта базируются на основных рекомендациях Европейской инсультной инициативы (ЕІІ) и Европейского авторского комитета [20] по ведению больных с данной патологией. Однако в них не нашли отражения подходы к лечению больных с ГТИИ. Вместе с тем внедрение в клиническую практику тромболизиса, который увеличивает риск возникновения вторичной интракраниальной геморрагии, повышает интерес к данной проблеме.
Сложность выработки оптимальных методов терапии ГТИИ состоит в том, что при такой клинической ситуации необходимо учитывать наличие в ишемическом очаге разных по характеру участков пораженной ткани мозга – ишемических и геморрагических, патогенетически тесно связанных между собой. Именно поэтому комплексная терапия должна обеспечить, с одной стороны, восстановление перфузии в зоне ишемии, а с другой – устранение условий, способствующих развитию геморрагического компонента [2].
Анализ данных литературы показывает, что вопросы терапии ГТИИ разработаны недостаточно. Этой проблеме посвящены лишь единичные публикации прошлых лет, в которых анализируется эффективность применения гепарина, аспирина, высоких доз пирацетама в лечении острого ишемического инсульта с ГТ очага инфаркта [19, 25, 28]. Приоритетным направлением терапии является разработанный способ лечения ишемического инсульта в зависимости от типа ГТ ишемического очага [1].
Как бы там ни было, разработка альтернативных подходов в лечении острого ВМК и ГТИИ является актуальной для клинической неврологии. Поэтому существует настоятельная необходимость усовершенствования адекватной стратегии защиты мозговой ткани перигематомы, а также ишемизированной ткани в случае ГТ очага инфаркта. При таких клинических ситуациях перспективным может быть применение высоких доз нейропротекторных препаратов нового поколения и антиоксидантов в первые часы после развития заболевания.
Цель исследования – определить эффективность и безопасность применения высоких доз Цераксона и Актовегина в лечении острого спонтанного внутримозгового кровоизлияния и геморрагической трансформации ишемического инсульта.
Соответственно поставленной цели ставились задачи оценить:
Материал и методы исследования
В исследование были включены 62 пациента с гипертензивным ВМК (33 мужчины и 29 женщин) в возрасте от 34 до 78 лет (средний возраст – 58,0 ± 11,2 года), а также 10 пациентов с геморрагической трансформацией ишемического инсульта (4 мужчины и 6 женщин) в возрасте от 39 до 72 лет (средний возраст – 57,3 ± 10,7 года). Пациентов набирали в исследование в 2 центрах: неврологическом центре Александровской клинической больницы (г. Киев) и клинике нервных болезней Луганской областной клинической больницы. Отбору подлежали лица старше 18 лет с завершенным мозговым инсультом (продолжительностью 60 мин и более) и клиническими диагнозами ВМК и ГТИИ. Уточнялось относительно четкое распределение времени начала инсульта. Больные, которым можно было начать предусмотренное рандомизацией лечение не позднее 6 ч от начала заболевания, поступали в клинику в первые 1-6 ч после развития инсульта.
Критерии включения: клинические проявления завершенного инсульта, верифицированный диагноз ПВМК или ГТИИ по данным КТ/МРТ-исследования; тяжесть неврологического дефицита по шкале NIHSS ≥ 9 и ≤ 22 баллов; терапевтическое окно ≤ 6 ч; согласие пациента или его законного представителя.
Критерии исключения: кровоизлияние в мозжечок; тяжесть неврологического дефицита по шкале NIHSS 22 баллов; тяжелые декомпенсированные соматические заболевания; терминальные состояния; наличие преморбидной функциональной несостоятельности (> 3 баллов по модифицированной шкале Рэнкина); выраженные нарушения сознания (оценка по балльной шкале комы Глазго 3-5 баллов, что свидетельствует о глубокой коме).
Протокол исследования одобрен соответствующим этическим комитетом на каждой из клинических баз, принимавших участие в обследовании больных.
Пациенты с первичным ВМК и объемом гематомы 40 см3, которым до и после хирургического удаления гематомы назначали Цераксон и Актовегин; симптомной ГТИИ – 10 пациентов (средний возраст – 57,3 ± 10,7 года), которые получали Цераксон в сочетании с Актовегином, из них у 2 больных диагностирован инфаркт-гематома, у 8 – геморрагический инфаркт.
Схема лечения была стандартизирована. Больным с ВМК и объемом гематомы 4 баллов и восстановление жизнедеятельности по мШР > 1 балла; умеренная – уменьшение соответственно на 4 и 1 балл; отсутствие эффекта – уменьшение неврологического дефицита Результаты и их обсуждение
Исходные демографические, клинические характеристики и медиана времени от начала заболевания до рандомизации (около 4,5 ч) были сходными во всех сравниваемых группах.
Между группами больных с ВМК и ГТИИ, которые лечились Цераксоном в сочетании с Актовегином, а также группой пациентов традиционной терапии не было явных различий по исходному уровню системного АД. Вместе с тем различия между группой хирургического лечения и группами консервативной терапии по уровню САД и среднего АД были статистически значимыми (р 0,05). Вместе с тем данные исходного сканирования головного мозга показывают, что в подгруппе пациентов интенсивного лечения с догоспитального этапа объем церебральной гематомы был ниже (11,4 ± 3,6 см3) по сравнению с объемом гематомы лиц подгруппы, в которой терапия начата на госпитальном этапе (13,7 ± 9,4 см3; р 0,05). Объем неврологического дефицита по шкале NIHSS у них соответствовал тяжелому инсульту, а уровень функциональной несостоятельности по мШР – умеренно тяжелой инвалидности.
Таким образом, тяжесть неврологического дефицита по шкале NIHSS и степень инвалидности, оцениваемая по модифицированной шкале Рэнкина, у больных с гипертензивным ВМК до лечения определялась по объему церебральной гематомы и перифокальным изменениям зоны перигематомы, прорыву крови в желудочки. Несомненно, имела значение и локализация ВМГ.
При увеличении объема ВМГ > 40 см3 в группе хирургического лечения тяжесть неврологических нарушений по шкале NIHSS существенно повышалась – до 17,0 ± 3,0 балла (р 0,05).
Применение нейропротектора Цераксона и антиоксиданта Актовегина в комплексной терапии ВМК значительно повышало активность основных внутриклеточных антиоксидантных ферментов – СОД до 47,07 ± 2,53 усл ед. (р 0,05), что не обеспечивало завершения процесса окисления гидроксильных радикалов до воды.
Таким образом, положительная динамика свободнорадикальных процессов, коррелирующая с позитивными изменениями неврологического статуса и восстановлением неврологических функций у больных с ВМК, получавших с первых часов госпитализации внутривенные инфузии Цераксона и Актовегина, является весьма убедительным доказательством значимости ПОЛ в механизме геморрагического повреждения ткани мозга и, несомненно, обосновывает патогенетическое действие применяемых антиоксидантов и нейропротекторов в лечении ВМК.
Проведенное исследование показало перспективность и целесообразность возможно более раннего назначения нейропротекторной и антиоксидантной терапии больным с ВМК и ГТИИ, начиная с догоспитального этапа, что создает реальные предпосылки для достижения более высокой эффективности последующего лечения в условиях стационара.
Клиническое исследование и статистический анализ показали, что внутривенное применение Цераксона (2 г/сут) в лечении больных с гипертензивным супратенториальным ВМК уже с догоспитального этапа достоверно ускоряло темпы регрессирования неврологического дефицита у больных по шкале NIHSS на 7-й день, вызывало высокую эффективность восстановления неврологических функций у 80,0 % пациентов по комбинации показателей шкал NIHSS и мШР на 21-й день. Использование препарата в курсовом лечении с момента госпитализации статистически значимое регрессирование неврологического дефицита вызывало лишь на 14-й день, а высокую эффективность лечения – на 21-й день у 68,8 % обследованных.
Применение в качестве средств коррекции сосудистых нарушений внутривенных инфузий Цераксона (2 г/сут) и Актовегина (1 г/сут) при курсовом лечении спонтанного ВМК и ГТИИ чаще вызывало высокую эффективность восстановления неврологических функций по комбинации показателей шкал NIHSS и мШР на 21-е сутки по сравнению с традиционной терапией:
Уровень функциональной независимости больных по индексу Бартел на 21-й день лечения ВМК с использованием инфузий Цераксона и Актовегина за счет суммации фармакологических эффектов более чем в 5 раз превышал таковой у пациентов, получавших традиционную терапию: у 26,1 % пациентов, получавших нейропротекторы и антиоксиданты на до- и госпитальном этапе, и, соответственно, у 5 % больных, получавших традиционную терапию.
У больных после хирургического удаления церебральной гематомы с последующей комплексной нейропротекцией и у пациентов с ГТИИ не достигалась минимальная степень дезадаптации по индексу Бартел. Функциональный исход у пациентов с ВМК небольших размеров, получавших Цераксон и Актовегин, лучший, чем у больных с ГТИИ, а также в случаях после хирургического удаления церебральной гематомы.
Нейропротекторная и антиоксидантная терапия гипертензивного ВМК с использованием внутривенных инфузий Цераксона и Актовегина на 10-й день лечения эффективно снижала уровень продуктов ПОЛ (содержание в крови ДК и ТБК-активных продуктов – MДA), что обеспечивало меньшую степень их участия в свободнорадикальном окислении в отличие от традиционного лечения. Об антиоксидантных свойствах Цераксона и Актовегина свидетельствует статистически значимое нарастание на 10-е сутки лечения уровня внутриклеточных АО-ферментов системы “COД – каталаза” и содержания неферментного фактора АО-защиты – глутатиона восстановленного, что снижало пероксидное напряжение.
Фармакологические эффекты Цераксона и Актовегина при лечении ВМК и ГТИИ более многогранные, чем просто влияние на молекулярные механизмы сосудистого повреждения, разные звенья патобиохимических реакций постгеморрагического воспалительного и ишемического каскада. Нейропротекторное и антиоксидантное действие препаратов опосредовано плейотропными эффектами, прямым и косвенным синергизмом действия, что обеспечивает суммацию эффектов каждого из компонентов, более эффективное восстановление неврологических функций и выгодно отличает их от других препаратов с заявленной нейропротекторной активностью.
Комбинированная нейропротекторная и антиоксидантная терапия ВМК и ГТИИ с внутривенным применением с первых часов заболевания препаратов Цераксона и Актовегина за счет эффекта синергизма их действия на разные механизмы сосудистого повреждения в большинстве случаев уменьшала размеры церебральной гематомы и перифокального отека, изменения ткани перигематомы, выраженность ишемического и геморрагического повреждения ткани головного мозга по данным КТ/МРТ-исследования.
Побочных явлений и осложнений, требующих отмены препаратов, не отмечалось. Безопасность и переносимость Цераксона и Актовегина – важный аспект назначения этих препаратов как можно раньше, на догоспитальном этапе, до точной верификации вида мозгового инсульта, что создаст реальные предпосылки для достижения более высокой эффективности лечения больных в условиях стационара.
Прогнозирование клинического исхода геморрагической трансформации инфаркта головного мозга

ПРОГНОЗИРОВАНИЕ КЛИНИЧЕСКОГО ИСХОДА ГЕМОРРАГИЧЕСКОЙ ТРАНСФОРМАЦИИ
ИНФАРКТА ГОЛОВНОГО МОЗГА.
Геморрагическая трансформация (ГТ) инфаркта головного мозга на сегодняшний день – это клинический и радиологический диагноз, который более точно, чем геморрагический инфаркт (ГИ), отражает свершившуюся последовательность патофизиологических процессов
Все ГТ подразделяются в зависимости от их связи с появлением остро возникшей клинической симптоматики на симптомные и асимптомные, либо в зависимости от вида их томографической проявляемости на ГИ и паренхимальные гематомы (ПГ). По данным клинических исследований около 70% симптомных ГТ состоят из паренхимальных гематом [14, 18, 19].
Зачастую любая ГТ, выявляемая во время нейровизуализации, рассматривается как серьезное неблагоприятное явление, с которым связывается нарастание симптомов инсульта, не принимая во внимание тот факт, действительно ли этот тип ГТ может вызывать обнаруживаемые симптомы. Изменение в состоянии пациента вполне могло быть вызвано естественным развитием инсульта, независимо от сопровождающей его ГТ, особенно, если ГТ составляла меньшую часть территории, пораженной обширным инфарктом. Проблема определения того, насколько неврологическое ухудшение зависит непосредственно от случившейся ГТ, или оно является результатом обширного инфаркта и ишемического отека с одновременной ГТ, остается решающей в исследовательской и клинической практике [7].
Группа исследователей во главе с Fiorelli на основе данных, полученных в ходе исследования ECASS I, продемонстрировали, что и в группе с плацебо, и в группе, получавшей rt-PA, только у пациентов с ПГ, занимающей >30% зоны инфаркта (ПГ-2), в последующем наблюдался неблагоприятный исход (смерть или полная недееспособность через три месяца от дебюта инсульта) [7, 12, 18]. Такой же результат был получен в ходе анализа результатов MAST-I [24, 25].
Интересно отметить, что особенностью ПГ-1, как правило, является их ранняя клиническая проявляемость, но не повышенный риск недееспособности или летального исхода в течение 3 месяцев [7, 17]. Этот факт увеличивает вероятность того, что не все «симптомные» кровоизлияния имеют неблагоприятный клинический прогноз. На сегодняшний день многие исследователи используют только ПГ-2 как паттерн будущего неудовлетворительного прогноза и стандартизированной безопасности конечного результата терапии [17].
Оригинальную точку зрения высказывают Cristina Motto et al. [24], которые указывают, что неблагоприятный исход у пациентов, имеющих гематомы, происходит из-за сопутствующего наличия крови в экстрапаренхимальном пространстве. 17 из 21 обследованных ими пациентов, имеющих такое осложнение, умерли в течение 10 дней. Daverat et al. [9] обнаружили, что интравентрикулярное распространение кровоизлияния при развитии ГТ инфаркта головного мозга было единственным независимым предвестником смертельного исхода в течение 30 дней. Другие источники [11] подтверждают, что отсутствие сопутствующего трансформации интравентрикулярного кровоизлияния – это ключ к выживанию. Эти утверждения соответствуют выводам по результатам исследований, посвященных прогнозу первичного внутричерепного кровоизлияния (ВЧК). Они показывают, что сопровождающее ВЧК экстрапаренхимальное кровотечение значительно увеличивает число летальных исходов [8, 9, 10, 11,15].
Исследователи ECASS-I специально не оценивали влияние интравентрикулярного или субарахноидального кровоизлияния на прогноз. Тем не менее, в выборке ECASS-I 48% пациентов с паренхимальными гематомами в первый день уже имели сопутствующее экстрапаренхимальное кровотечение (ЭПК). Через 3 месяца исход у данной группы определялся как неудовлетворительный в противоположность пациентам, имевшим ПГ, но не имевшим ЭПК [12]. По мнению других авторов масс-эффект, созданный ПГ, более, чем ЭПК, – абсолютный предвестник неблагоприятного исхода [25]. Существуют данные, что экстрапаренхимальное кровотечение и церебральный отек – основные прогностически неблагоприятные томографические показатели в острой фазе ишемического инсульта. Причем, если в наличии имеется обширная гематома, отрицательный эффект создается главным образом за счет сопутствующего экстрапаренхимального кровотечения, а когда наблюдается ГИ ведущую отрицательную роль играет наличие церебрального отека [6, 13, 21, 24].
Общепризнано утверждение о том, что более обширные ишемические поражения предполагают более неблагоприятный прогноз [1, 2, 6, 12, 13, 25]. По утверждению некоторых исследователей наличие выраженного неврологического дефицита в дебюте заболевания, обширной гиподенсивности или масс-эффекта на предварительных томограммах было связано со значительно возросшим риском недееспособности и летального исхода в течение 3 месяцев от дебюта инсульта [22, 28]. К примеру, выраженное увеличение случаев функциональной зависимости и летальных исходов происходит при значении по шкале ASPECTS ≤ 7 [4]. Следовательно, все вышеуказанные факторы мешают определению избирательного влияния ГТ на исход [7] и являются ведущими в предопределении неудовлетворительного прогноза [12, 13, 14].
Если роль ПГ-2 в окончательном клиническом исходе заболевания достаточно определена, то эффект, создаваемый ГИ, и их прогностическая значимость в настоящее время остаются дискутабельными и до конца не установленными. [6, 7, 12, 23]. Большинство исследователей все же рассматривают ГИ в контексте асимптомных ГТ. А так как основные предвестники ГТ считаются также указателями плохого исхода (особенно, определяемая в соответствии со Шкалой, тяжесть инсульта), оценить прогностическую значимость асимптомной ГТ в отдельности очень трудно [16]. Многие считают, что ГИ являются частью естественной истории острого ишемического инсульта и клинически безвредны, что это «явление, видимое на томограммах», без каких-либо последствий, и соответственно, асимптомно [26]. Действительно, в нескольких работах, посвященных этой проблеме, так и не удалось определить эффект, оказываемый ГИ на общий прогноз, так как выявлялись другие факторы, которые самостоятельно могли бы вызвать ухудшение исхода [16, 24].
Результаты исследований в NINDS и ECASS-II, а также обобщенный анализ данных, проведенных в NINDS и Atlantis A и B, не выявлили какого-либо влияния асимптомных ГТ на 3-х месячные клинические результаты [19]. Оказалось, что ГИ-1 и ГИ-2 чаще даже были связаны с клиническим улучшением [7]. Некоторые исследователи полагают, что наличие ГИ может указывать на эффективную раннюю реперфузию, и называют их маркером благоприятного прогноза [12, 22]. Так в группе пациентов с инсультом в количестве 32 человек, имеющих закупорку проксимального отдела СМA, в течение 3 часов от развития симптомов использовали в терапии rt-PA. В последующем те больные, у которых были обнаружены ГИ 1 и 2 типа, перенесли более легкие инфаркты и имели лучшие клинические результаты, чем те, у которых ГИ отсутствовал или те, у которых были обнаружены ПГ 1 и 2 типов [22]. Распространенность ГИ в группах плацебо часто даже оказывалась выше, чем в rt-PA группах, возможно, за счет спонтанной поздней реканализации или острой конверсии ГИ в ПГ под воздействием rt-PA [18, 19]. Возросшая частота асимптомных ГТ, приводимая в некоторых публикациях, может служить показателем более успешного и своевременного применения реперфузионной терапии [17, 22].
Факторами последующего неблагоприятного прогноза считаются также более пожилой возраст и повышенный уровень сахара крови в течение острого периода инсульта [18, 28].
Лечение с помощью rt-PA, хотя и связано с большей частотой возникновения ПГ-2 по сравнению с группами плацебо, но уменьшает общий риск недееспособности и летального исхода в течение 3 месяцев [18, 19] из-за снижения числа смертельных исходов, не связанных с кровоизлиянием [14]. Все указанные заключения базируются на результатах крупных испытаний по использованию тромболитических препаратов. Прогностическое значение ГТ и ее отдельных видов вне тромболитического лечения на данный момент остается неопределенным.
Для уточнения влияния спонтанных ГТ на ранний клинический исход заболевания проведено комплексное обследование 239 человек с ишемическим инсультом головного мозга в остром периоде, находившихся на лечении в Национальном центре патологии мозгового кровообращения ФГУ НМХЦ им. (г. Москва) и неврологическом отделении ОКБ Святителя Иоасафа (г. Белгород) с 2004 по 2007 годы. Для анализа полученных данных все обследуемые больные (n=239) были разделены на две группы: пациенты, имеющие ишемический инсульт головного мозга – Группа А (n=164) и пациенты, перенесшие ГТ ишемического очага – Группа Б (n=75). Всему обследованному контингенту на 1-е и 21–е сутки заболевания, а при ухудшении состояния внепланово, проводили оценку тяжести клинического и функционального состояния, для чего использовали стандартизированные Шкалы NIHSS, Глазго и Ранкина.
Нейровизуализацию (СКТ и/или МРТ) выполняли на 1-ый, 2-ой и 21-ый дни заболевания, а при ухудшении состояния – внепланово. СКТ проводили на аппаратуре Somatom Sensation (Siemens), Hi Speed NX/ I (General Electric). Использовали стандартное сканирование в аксиальной плоскости. Для МР-исследования пользовались оборудованием Giroscan INTERA NOVA (Toshiba), Signa Infinity (General Electric) с напряжением магнитного поля 1,5 и 1 Тесла. В определении размеров ИИ мы пользовались классификацией ГУ Научного центра неврологии РАМН.
Томографический характер развившейся вторичной геморрагии устанавливали согласно ECASS-I и ECASS-II классификации (European Cooperative Acute Stroke Study Group) с подразделением на: 1) ГИ 1 типа (ГИ-1) – маленькие петехии вдоль границы инфаркта; 2) ГИ 2 типа (ГИ-2) – более расплывчатые сливные петехии в ишемической зоне без масс-эффекта; 3) ПГ 1 типа (ПГ-1) – гематома, занимающая менее 30% зоны инфаркта с небольшим масс-эффектом; 4) ПГ 2 типа (ПГ-2) – плотная гематома, занимающая более 30% зоны инфаркта с существенным масс-эффектом, либо любое геморрагическое повреждение вне зоны инфаркта.
С использованием модели logit- регрессии среди всего обследованного контингента больных (n=239) проведен анализ факторов, которые могут оказывать влияние на формирование раннего неудовлетворительного исхода заболевания к 21 суткам инсульта (летальный исход или значение шкалы Ранкина ≥ 4). В качестве зависимой переменной мы рассматривали вероятность развития неудовлетворительного исхода, а в качестве независимых переменных следующие факторы:
1. Возраст (х1). Цифровое выражение возраста пациента.
2. NIHSS (х2) – цифровое выражение тяжести неврологического дефицита, измеренное по Шкале NIHSS.
3. Наличие симптомного характера ГТ (бинарная) (х3). За «1» принимали симптомный характер ГТ, за «0» – асимптомный характер ГТ.
4. Развитие ГТ в виде ПГ-2 (бинарная) (х4). За «1» принимали имеющийся радиологический характер геморрагии в виде ПГ-2, за «0» – остальные виды ГТ (ГИ-1,ГИ-2,ПГ-1).
5. Наличие экстрапаренхимальной геморрагии (ЭПГ) (бинарная) (х5). За «1» принимали течение ГТ в сопровождении экстрапаренхимального кровотечения, за «0» – без такового.
6. Размер зоны ИИ (бинарная) (х6). За «1» принимали обширный размер инфарктной зоны у пациента, за «0» – меньшие размеры инфарктов.
Полученная в результате данной logit-регрессии математическая модель позволяет в 90% случаев верно предсказать удовлетворительный ранний клинический исход заболевания и в 97,1% случаев верно спрогнозировать формирование неудовлетворительного клинического исхода.

Рисунок 1. Графическое выражение вероятности развития неудовлетворительного исхода.
По итогам статистического анализа можно сделать вывод, что возраст и клинико-томографический вариант развития ГТ не оказывают влияния на ранний исход при возникновении вторичной геморрагии. Основными прогностически неблагоприятными факторами являются обширный размер области ишемического повреждения и тяжесть неврологического дефицита в дебюте инсульта. Причем обширность ишемии существенно влияет на вероятность возникновения неудовлетворительного исхода при значениях NIHSS, находящихся в интервале от 5 до 18 единиц. Если значение Шкалы NIHSS меньше 5, то независимо от размера инфаркта наблюдается вероятность результата «0» (т. е положительный исход в любом случае), а если значение NIHSS больше 19, то вероятность развития неудовлетворительного исхода близка к 100% при всех размерах инфарктной зоны.
С учетом вышесказанного для определения непосредственной роли вторичной интраишемической геморрагии в клиническом течении инфаркта мозга и формировании раннего исхода заболевания, нами произведено сопоставление группы больных, имеющих ГТ инфаркта головного мозга (n=75) с выборочной группой сравнения (n=64) c ишемическим инсультом головного мозга без ГТ, равновеликих по тяжести инсульта в дебюте и величине инфарктной зоны (Таб. 1).
Таблица 1. Характеристика обширности ишемической области и тяжести инфаркта на 1-е и 21-е сутки среди обследованных больных.
Больные, перенесшие ишемический инсульт с ГТ
Группа сравнения с ишемическим инсультом без ГТ
Прогнозирование клинического исхода геморрагической трансформации инфаркта головного мозга






| Название | Прогнозирование клинического исхода геморрагической трансформации инфаркта головного мозга |
| Дата конвертации | 27.02.2013 |
| Размер | 138.19 Kb. |
| Тип | Документы |
| ПРОГНОЗИРОВАНИЕ КЛИНИЧЕСКОГО ИСХОДА ГЕМОРРАГИЧЕСКОЙ ТРАНСФОРМАЦИИ
ИНФАРКТА ГОЛОВНОГО МОЗГА. А.Н. Кузнецов, Е.И. Батищева Геморрагическая трансформация (ГТ) инфаркта головного мозга на сегодняшний день – это клинический и радиологический диагноз, который более точно, чем геморрагический инфаркт (ГИ), отражает свершившуюся последовательность патофизиологических процессов Все ГТ подразделяются в зависимости от их связи с появлением остро возникшей клинической симптоматики на симптомные и асимптомные, либо в зависимости от вида их томографической проявляемости на ГИ и паренхимальные гематомы (ПГ). По данным клинических исследований около 70% симптомных ГТ состоят из паренхимальных гематом [14, 18, 19]. Зачастую любая ГТ, выявляемая во время нейровизуализации, рассматривается как серьезное неблагоприятное явление, с которым связывается нарастание симптомов инсульта, не принимая во внимание тот факт, действительно ли этот тип ГТ может вызывать обнаруживаемые симптомы. Изменение в состоянии пациента вполне могло быть вызвано естественным развитием инсульта, независимо от сопровождающей его ГТ, особенно, если ГТ составляла меньшую часть территории, пораженной обширным инфарктом. Проблема определения того, насколько неврологическое ухудшение зависит непосредственно от случившейся ГТ, или оно является результатом обширного инфаркта и ишемического отека с одновременной ГТ, остается решающей в исследовательской и клинической практике [7]. Группа исследователей во главе с Fiorelli на основе данных, полученных в ходе исследования ECASS I, продемонстрировали, что и в группе с плацебо, и в группе, получавшей rt-PA, только у пациентов с ПГ, занимающей >30% зоны инфаркта (ПГ-2), в последующем наблюдался неблагоприятный исход (смерть или полная недееспособность через три месяца от дебюта инсульта) [7, 12, 18]. Такой же результат был получен в ходе анализа результатов MAST-I [24, 25]. Интересно отметить, что особенностью ПГ-1, как правило, является их ранняя клиническая проявляемость, но не повышенный риск недееспособности или летального исхода в течение 3 месяцев [7, 17]. Этот факт увеличивает вероятность того, что не все «симптомные» кровоизлияния имеют неблагоприятный клинический прогноз. На сегодняшний день многие исследователи используют только ПГ-2 как паттерн будущего неудовлетворительного прогноза и стандартизированной безопасности конечного результата терапии [17]. Оригинальную точку зрения высказывают Cristina Motto et al. [24], которые указывают, что неблагоприятный исход у пациентов, имеющих гематомы, происходит из-за сопутствующего наличия крови в экстрапаренхимальном пространстве. 17 из 21 обследованных ими пациентов, имеющих такое осложнение, умерли в течение 10 дней. Daverat et al. [9] обнаружили, что интравентрикулярное распространение кровоизлияния при развитии ГТ инфаркта головного мозга было единственным независимым предвестником смертельного исхода в течение 30 дней. Другие источники [11] подтверждают, что отсутствие сопутствующего трансформации интравентрикулярного кровоизлияния – это ключ к выживанию. Эти утверждения соответствуют выводам по результатам исследований, посвященных прогнозу первичного внутричерепного кровоизлияния (ВЧК). Они показывают, что сопровождающее ВЧК экстрапаренхимальное кровотечение значительно увеличивает число летальных исходов [8, 9, 10, 11,15]. Исследователи ECASS-I специально не оценивали влияние интравентрикулярного или субарахноидального кровоизлияния на прогноз. Тем не менее, в выборке ECASS-I 48% пациентов с паренхимальными гематомами в первый день уже имели сопутствующее экстрапаренхимальное кровотечение (ЭПК). Через 3 месяца исход у данной группы определялся как неудовлетворительный в противоположность пациентам, имевшим ПГ, но не имевшим ЭПК [12]. По мнению других авторов масс-эффект, созданный ПГ, более, чем ЭПК, – абсолютный предвестник неблагоприятного исхода [25]. Существуют данные, что экстрапаренхимальное кровотечение и церебральный отек – основные прогностически неблагоприятные томографические показатели в острой фазе ишемического инсульта. Причем, если в наличии имеется обширная гематома, отрицательный эффект создается главным образом за счет сопутствующего экстрапаренхимального кровотечения, а когда наблюдается ГИ ведущую отрицательную роль играет наличие церебрального отека [6, 13, 21, 24]. Общепризнано утверждение о том, что более обширные ишемические поражения предполагают более неблагоприятный прогноз [1, 2, 6, 12, 13, 25]. По утверждению некоторых исследователей наличие выраженного неврологического дефицита в дебюте заболевания, обширной гиподенсивности или масс-эффекта на предварительных томограммах было связано со значительно возросшим риском недееспособности и летального исхода в течение 3 месяцев от дебюта инсульта [22, 28]. К примеру, выраженное увеличение случаев функциональной зависимости и летальных исходов происходит при значении по шкале ASPECTS ≤ 7 [4]. Следовательно, все вышеуказанные факторы мешают определению избирательного влияния ГТ на исход [7] и являются ведущими в предопределении неудовлетворительного прогноза [12, 13, 14]. Если роль ПГ-2 в окончательном клиническом исходе заболевания достаточно определена, то эффект, создаваемый ГИ, и их прогностическая значимость в настоящее время остаются дискутабельными и до конца не установленными. [6, 7, 12, 23]. Большинство исследователей все же рассматривают ГИ в контексте асимптомных ГТ. А так как основные предвестники ГТ считаются также указателями плохого исхода (особенно, определяемая в соответствии со Шкалой, тяжесть инсульта), оценить прогностическую значимость асимптомной ГТ в отдельности очень трудно [16]. Многие считают, что ГИ являются частью естественной истории острого ишемического инсульта и клинически безвредны, что это «явление, видимое на томограммах», без каких-либо последствий, и соответственно, асимптомно [26]. Действительно, в нескольких работах, посвященных этой проблеме, так и не удалось определить эффект, оказываемый ГИ на общий прогноз, так как выявлялись другие факторы, которые самостоятельно могли бы вызвать ухудшение исхода [16, 24]. Результаты исследований в NINDS и ECASS-II, а также обобщенный анализ данных, проведенных в NINDS и Atlantis A и B, не выявлили какого-либо влияния асимптомных ГТ на 3-х месячные клинические результаты [19]. Оказалось, что ГИ-1 и ГИ-2 чаще даже были связаны с клиническим улучшением [7]. Некоторые исследователи полагают, что наличие ГИ может указывать на эффективную раннюю реперфузию, и называют их маркером благоприятного прогноза [12, 22]. Так в группе пациентов с инсультом в количестве 32 человек, имеющих закупорку проксимального отдела СМA, в течение 3 часов от развития симптомов использовали в терапии rt-PA. В последующем те больные, у которых были обнаружены ГИ 1 и 2 типа, перенесли более легкие инфаркты и имели лучшие клинические результаты, чем те, у которых ГИ отсутствовал или те, у которых были обнаружены ПГ 1 и 2 типов [22]. Распространенность ГИ в группах плацебо часто даже оказывалась выше, чем в rt-PA группах, возможно, за счет спонтанной поздней реканализации или острой конверсии ГИ в ПГ под воздействием rt-PA [18, 19]. Возросшая частота асимптомных ГТ, приводимая в некоторых публикациях, может служить показателем более успешного и своевременного применения реперфузионной терапии [17, 22]. Факторами последующего неблагоприятного прогноза считаются также более пожилой возраст и повышенный уровень сахара крови в течение острого периода инсульта [18, 28]. Лечение с помощью rt-PA, хотя и связано с большей частотой возникновения ПГ-2 по сравнению с группами плацебо, но уменьшает общий риск недееспособности и летального исхода в течение 3 месяцев [18, 19] из-за снижения числа смертельных исходов, не связанных с кровоизлиянием [14]. Все указанные заключения базируются на результатах крупных испытаний по использованию тромболитических препаратов. Прогностическое значение ГТ и ее отдельных видов вне тромболитического лечения на данный момент остается неопределенным. Для уточнения влияния спонтанных ГТ на ранний клинический исход заболевания проведено комплексное обследование 239 человек с ишемическим инсультом головного мозга в остром периоде, находившихся на лечении в Национальном центре патологии мозгового кровообращения ФГУ НМХЦ им. Н.И.Пирогова (г. Москва) и неврологическом отделении ОКБ Святителя Иоасафа (г. Белгород) с 2004 по 2007 годы. Для анализа полученных данных все обследуемые больные (n=239) были разделены на две группы: пациенты, имеющие ишемический инсульт головного мозга – Группа А (n=164) и пациенты, перенесшие ГТ ишемического очага – Группа Б (n=75). Всему обследованному контингенту на 1-е и 21–е сутки заболевания, а при ухудшении состояния внепланово, проводили оценку тяжести клинического и функционального состояния, для чего использовали стандартизированные Шкалы NIHSS, Глазго и Ранкина. Нейровизуализацию (СКТ и/или МРТ) выполняли на 1-ый, 2-ой и 21-ый дни заболевания, а при ухудшении состояния – внепланово. СКТ проводили на аппаратуре Somatom Sensation (Siemens), Hi Speed NX/ I (General Electric). Использовали стандартное сканирование в аксиальной плоскости. Для МР-исследования пользовались оборудованием Giroscan INTERA NOVA (Toshiba), Signa Infinity (General Electric) с напряжением магнитного поля 1,5 и 1 Тесла. В определении размеров ИИ мы пользовались классификацией ГУ Научного центра неврологии РАМН. Томографический характер развившейся вторичной геморрагии устанавливали согласно ECASS-I и ECASS-II классификации (European Cooperative Acute Stroke Study Group) с подразделением на: 1) ГИ 1 типа (ГИ-1) – маленькие петехии вдоль границы инфаркта; 2) ГИ 2 типа (ГИ-2) – более расплывчатые сливные петехии в ишемической зоне без масс-эффекта; 3) ПГ 1 типа (ПГ-1) – гематома, занимающая менее 30% зоны инфаркта с небольшим масс-эффектом; 4) ПГ 2 типа (ПГ-2) – плотная гематома, занимающая более 30% зоны инфаркта с существенным масс-эффектом, либо любое геморрагическое повреждение вне зоны инфаркта. С использованием модели logit- регрессии среди всего обследованного контингента больных (n=239) проведен анализ факторов, которые могут оказывать влияние на формирование раннего неудовлетворительного исхода заболевания к 21 суткам инсульта (летальный исход или значение шкалы Ранкина ≥ 4). В качестве зависимой переменной мы рассматривали вероятность развития неудовлетворительного исхода, а в качестве независимых переменных следующие факторы:
Полученная в результате данной logit-регрессии математическая модель позволяет в 90% случаев верно предсказать удовлетворительный ранний клинический исход заболевания и в 97,1% случаев верно спрогнозировать формирование неудовлетворительного клинического исхода.
Рисунок 1. Графическое выражение вероятности развития неудовлетворительного исхода. По итогам статистического анализа можно сделать вывод, что возраст и клинико-томографический вариант развития ГТ не оказывают влияния на ранний исход при возникновении вторичной геморрагии. Основными прогностически неблагоприятными факторами являются обширный размер области ишемического повреждения и тяжесть неврологического дефицита в дебюте инсульта. Причем обширность ишемии существенно влияет на вероятность возникновения неудовлетворительного исхода при значениях NIHSS, находящихся в интервале от 5 до 18 единиц. Если значение Шкалы NIHSS меньше 5, то независимо от размера инфаркта наблюдается вероятность результата «0» (т.е положительный исход в любом случае), а если значение NIHSS больше 19, то вероятность развития неудовлетворительного исхода близка к 100% при всех размерах инфарктной зоны. С учетом вышесказанного для определения непосредственной роли вторичной интраишемической геморрагии в клиническом течении инфаркта мозга и формировании раннего исхода заболевания, нами произведено сопоставление группы больных, имеющих ГТ инфаркта головного мозга (n=75) с выборочной группой сравнения (n=64) c ишемическим инсультом головного мозга без ГТ, равновеликих по тяжести инсульта в дебюте и величине инфарктной зоны (Таб. 1). Таблица 1. Характеристика обширности ишемической области и тяжести инфаркта на 1-е и 21-е сутки среди обследованных больных. |