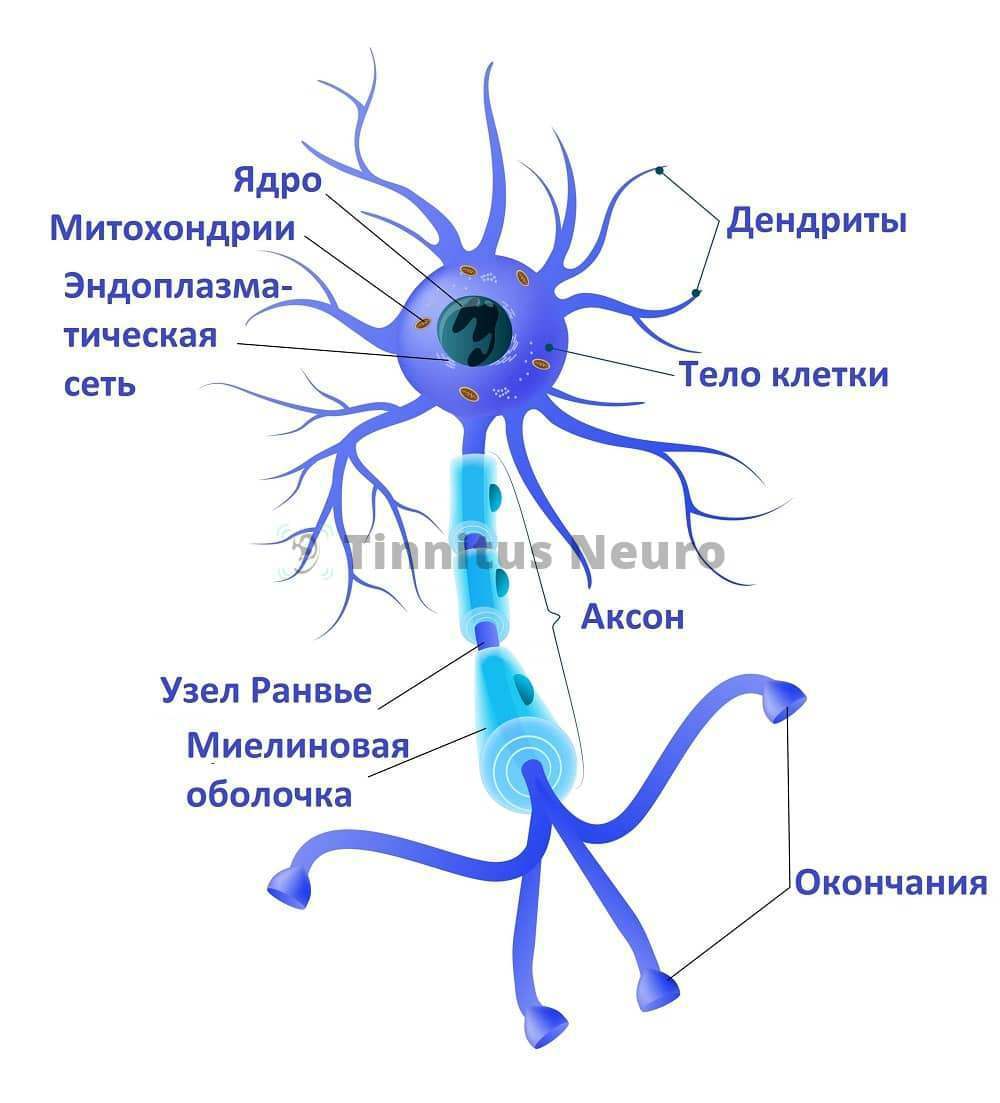
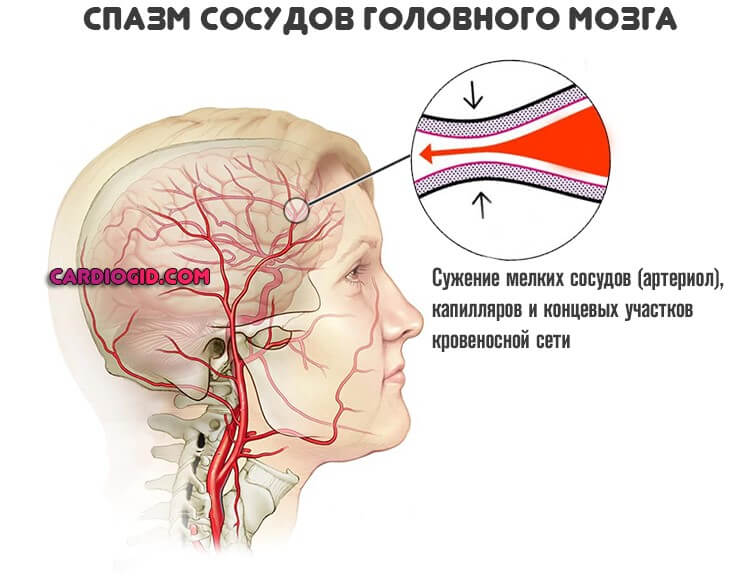
Рассеянный склероз: причины возникновения, клинические признаки

Рассеянный склероз (РС, множественный склероз, диссеминированный склероз, sclerosis disseminata, SD) – это хроническое заболевание нервной системы, при котором нервная ткань местами замещается соединительной с формированием бляшек. Замена ткани становится причиной нарушения функций нервной системы, что проявляется различными симптомами. Обычно течение рассеянного склероза носит волнообразно-прогрессирующий характер. Недуг постепенно приводит к ограничению жизнедеятельности и может сокращать продолжительность жизни больного. Из этой статьи Вы сможете узнать, как и почему развивается рассеянный склероз, чем он проявляется и как влияет на длительность жизни.
Рассеянный склероз рассматривается, как аутоиммунно-воспалительный процесс. При этом заболевании разрушается миелиновая оболочка нервных клеток под действием собственных антител. Это явление называется демиелинизацией. Однако это происходит не у каждого человека, для запуска процесса нужны предпосылки.
Причины возникновения

Согласно современным представлениям, рассеянный склероз относится к мультифакториальным заболеваниям, т. е. имеет в основе комбинацию из нескольких причин одновременно.
Самыми главными считаются следующие факторы:
- вирусная инфекция;
- наследственная (генетическая) предрасположенность иммунной системы;
- географические особенности места постоянного проживания.
Вирусная инфекция
Считается, что рассеянный склероз является следствием так называемых медленных инфекций. Характерными особенностями медленных инфекций являются: длительный период без каких-либо симптомов (латентный), избирательность поражения (т.е. одних и тех же органов и систем), развитие только у конкретного вида животных или человека, постоянно прогрессирующее течение.
Определенная специфическая инфекция, вызывающая развитие рассеянного склероза, пока не обнаружена, но роль многих вирусов подтверждена различными фактами: связь начала заболевания или обострения с перенесенной вирусной инфекцией, наличие высокого титра противовирусных антител в крови больных рассеянным склерозом, вызывание рассеянного склероза в эксперименте в лабораторных условиях у животных под влиянием вирусов.
Среди возбудителей инфекций, которые предположительно могут служить пусковым моментом в развитии рассеянного склероза, следует отметить ретровирусы, вирусы кори, герпеса, краснухи, эпидемического паротита, Эпштейна-Барра. Вероятнее всего, что возбудитель проникает в организм еще в детском возрасте, а затем, при наличии других факторов, провоцирует иммунные нарушения на поверхности нервных клеток. Иммунная система начинает выработку антител против этих вирусов. Однако антитела атакуют не самого возбудителя, а нервные клетки, которые воспринимаются ею, как опасность. В результате происходит разрушение нервной ткани. Для реализации такого механизма необходима особая наследственная предрасположенность.
Наследственная предрасположенность
На сегодняшний день установлено, что заболевание встречается в семьях, где есть больной рассеянным склерозом, в 20-50 раз чаще, чем в общей популяции. Особенно это характерно для родственников первой, второй линии родства (дети, братья, сестры). Случаи семейного рассеянного склероза составляют до 10% от общего числа.
Выявлено, что некоторые гены 6-й хромосомы обусловливают своеобразие иммунного ответа, характерное для рассеянного склероза. Другие гены, отвечающие за строение и функции неспецифических ферментов, иммуноглобулинов, белка миелина, также участвуют в развитии заболевания. Т. е. для того, чтобы болезнь возникла, у человека должно совпасть сочетание нескольких генов. Считается, что даже особенности течения рассеянного склероза кодируются определенными наследственными структурами.
Географические особенности
Статистические исследования выявили, что распространенность рассеянного склероза выше в местностях с повышенной влажностью и прохладным климатом, в долинах рек, с меньшим количеством солнечного света (коротким световым днем).
Содержание в почве и природных водах меди, цинка, кобальта, особенности питания определенных регионов (повышение содержания белка и животного жира в развитых странах) также влияют на распространенность рассеянного склероза.
Отмечено, что в северных странах, более удаленных от экватора (этот феномен называется градиент широты), у людей европеоидной расы риск заболевания существенно выше. Распространенность рассеянного склероза в Германии, Австрии, Швейцарии, Южной Австралии, на севере США значительно выше, чем в других странах мира.
Выявлена такая интересная закономерность: если человек проживал в местности с высоким риском развития рассеянного склероза в детском возрасте, и до достижения 15 лет сменил регион обитания, переехав туда, где заболеваемость в разы меньше, то для него риск заболеть существенно снижается. Если же миграция осуществляется после 15 лет, то смена жительства никаким образом не сказывается, и риск остается высоким. Предполагают, что это связано с особенностями формирования иммунной системы до достижения подросткового периода.
Как возникает рассеянный склероз?
При случайном совпадении у человека генетических особенностей реагирования иммунной системы с факторами внешней среды(зоной проживания, особенностями экологии и питания и т. д.) в ответ на перенесенную вирусную инфекцию в организме запускается целый каскад иммунных нарушений.
Антигены вирусов, проникая в нервную систему, прикрепляются к поверхности нервных клеток, в частности к миелину (белковая оболочка нервных волокон). Иммунная система атакует чужеродные образования, воспринимая их, как опасность. Атака состоит в образовании антител против вирусных частиц, но поскольку последние связываются с миелином, то антитела вырабатываются и против него. Развивается неправильный иммунный ответ (аутоиммунный) – организм борется против своих же структур. В последующем миелин воспринимается как чужеродный, и антитела вырабатываются постоянно.
Производство антител сопровождается выбросом различных образований, стимулирующих воспалительный процесс. Результатом таких событий становится демиелинизация (разрушение миелина) и повреждение структуры нервного волокна (аксональная дегенерация). Вместо разрушенных структур развивается соединительная ткань, и образуются так называемые бляшки, которые разбросаны по всей нервной системе. Поэтому заболевание и получило название рассеянный склероз (склероз в этом случае означает формирование соединительнотканного рубца вместо нормальной нервной ткани).
Клинические признаки

Рассеянный склероз обычно поражает молодых людей – от 18 до 45 лет. Женщины страдают чаще мужчин. Если заболевание возникает после 50 лет, то межполовое соотношение уравнивается.
Рассеянный склероз – многоликое заболевание. Он проявляет себя самыми разнообразными симптомами потому, что в его основе лежит образование склеротических бляшек по всей центральной нервной системе.
Следует отметить, что не существует специфичных клинических симптомов, характерных только для рассеянного склероза. Поэтому диагностика этого заболевания очень сложна.
К типичным проявлениям рассеянного склероза относят:
- двигательные нарушения;
- расстройства координации (атактический синдром);
- расстройства чувствительности;
- симптомы поражения ствола мозга и черепно-мозговых нервов;
- вегетативные нарушения функции тазовых органов;
- неполадки в психоэмоциональной сфере.
Двигательные нарушения проявляются в виде мышечной слабости (парезов) в разных частях тела. Чаще развиваются парезы нижних конечностей, более выраженные в мышцах голени и бедра, т. е. в крупных мышечных массивах. Со временем мышечная слабость усугубляется, парезы распространяются и на руки, вовлеченными оказываются все 4 конечности – тетрапарез. Обычно слабость в мышцах сочетается с повышением мышечного тонуса. Это называют спастическим парезом. В положении лежа тонус менее выражен, при ходьбе становится более заметным. При рассеянном склерозе парезы могут сочетаться и со снижением мышечного тонуса. Сухожильные рефлексы повышаются (сгибательно-локтевой, разгибательно-локтевой, карпо-радиальный, коленный, ахиллов), а зона, с которой вызывается рефлекс, расширяется. Поверхностные рефлексы (со слизистых оболочек, кожные брюшные, подошвенный), наоборот, утрачиваются. При осмотре выявляют патологические стопные знаки: симптом Бабинского (медленное разгибание большого пальца стопы при штриховом раздражении наружного края подошвы), Россолимо, Жуковского, Гордона и др. Все эти симптомы свидетельствуют о поражении нервных проводников, идущих от коры больших полушарий к двигательным нейронам спинного мозга.
Атактический синдром заключается в нарушении устойчивости. У больного появляются шаткость при ходьбе, а позже и при стоянии. Шаткость может быть настолько выраженной, что приводит к падениям. Нарушается точность координации движений: появляется промахивание при попытке что-то взять, мимопопадание при выполнении даже самых простых движений (расчесывание, чистка зубов). Особенно трудными становятся действия, требующие быстрой смены противоположных движений в суставах кистей. Не застегиваются пуговицы, не вдеваются шнурки, не попадает нитка в иголку и т.д. Возможно появление дрожания в конечностях при выполнении движений (интенционный тремор). Из-за нарушения согласованного сокращения и расслабления мышц языка, гортани и глотки может нарушаться речь: она становится замедленной, как бы толчкообразной, с разделением слов на слоги, с несколькими ударениями в одном слове. Еще один характерный признак атактического синдрома — нистагм. Это ритмичные колебательные движения одного или обоих глаз, которые возникают непроизвольно, чаще при максимальном взгляде в сторону или вверх.
Нарушения чувствительности представляют собой различные симптомы. Больной жалуется на ползание мурашек в различных частях тела, онемение, жжение, зуд, покалывание. Иногда могут беспокоить боли приступообразного характера: по ходу нервных стволов, вдоль позвоночника, в голове. Больные их описывают, как прострелы, сравнивают с прохождением тока от головы к ногам (симптом Лермитта). Возможны боли в мышцах из-за повышения тонуса. При осмотре выявляются нарушения болевой, температурной чувствительности, не ощущаются прикосновения в каких-либо частях тела. Характерна потеря суставно-мышечного чувства: когда больной с закрытыми глазами не может определить, к какому пальцу прикасается врач и в какую сторону совершает пассивное движение этим пальцем (сгибает, разгибает, отводит в сторону). По мере прогрессирования болезни подобные нарушения появляются даже в крупных суставах: голеностопном, лучезапястном.
Из-за атактического синдрома, двигательных и чувствительных расстройств у больных меняется походка. Она становится неуверенной, как бы «ощупывающей» поверхность под ногами, с избыточным выбрасыванием ног вперед. Иногда больному нужно смотреть под ноги, чтобы не упасть. Если такого больного попросить пройтись с закрытыми глазами, то все эти проявления резко усиливаются. Больному трудно резко повернуться или внезапно остановиться.
Симптомы поражения ствола мозга и черепно-мозговых нервов часто встречаются уже на ранних стадиях рассеянного склероза, а по мере развития болезни только прогрессируют. К ним относят ощущение двоения в глазах, головокружение, шум в ушах. Чаще поражаются зрительный, глазодвигательный, отводящий, тройничный, лицевой нервы, реже — вестибулокохлеарный нерв. Это проявляется нарушением зрения, косоглазием, слабостью мимических мышц лица, приступообразными выраженными болями в области лица, нарушением слуха. К симптомам поражения ствола мозга относятся насильственный смех и плач (беспричинный и неконтролируемый), выявляемые врачом при осмотре рефлексы орального автоматизма (например, при прикосновении к губам возникают сосательные движения, постукивание по спинке носа вызывает вытягивание губ трубочкой).
Функции тазовых органов нарушаются у большинства больных. Чаще это происходит на более поздних стадиях болезни, но может быть и первым признаком. Возможны задержка мочеиспускания или недержание мочи. Конечно, максимальная выраженность данных симптомов возникает не сразу. Вначале больному приходится просто сильнее тужиться, чтобы осуществить акт мочеиспускания; или позывы к мочеиспусканию становятся настолько выраженными, что требуют немедленного удовлетворения. В противном случае больной не в состоянии удержать мочу. Уже на более поздних стадиях болезни похожие ситуации развиваются и при акте дефекации. В финале болезни большинство больных не контролируют физиологические отправления. Из других вегетативных нарушений у больных рассеянным склерозом наблюдаются импотенция и нарушение менструального цикла.
Психоэмоциональные нарушения начинаются исподволь, развивается астенический синдром. Ухудшается память, внимание, постепенно формируется снижение интеллектуальных показателей и мышления. Появляется избыточная эмоциональность, плаксивость или, наоборот, эйфория. Иногда больные объективно не в состоянии оценить имеющиеся у них симптомы. У части больных формируется депрессия, изредка возможны шизофреноподобные психозы. Характерен синдром хронической усталости.
У рассеянного склероза есть некоторые особенности развития симптомов, которые помогают диагностировать это заболевание. Особенно хорошо эти симптомы выражены на начальных стадиях болезни:
- клиническая диссоциация или расщепление – несоответствие между выраженностью симптомов поражения одной или нескольких функциональных систем. Например, при значительном снижении зрения при осмотре глазного дна патологических изменений не выявляют вообще. Или у больного одновременно имеется сочетанное поражение разных функциональных систем: например, высокие рефлексы и парезы в ногах из-за поражения центрального двигательного нейрона и низкий мышечный тонус из-за поражения мозжечка (хотя при поражении центрального двигательного нейрона тонус обычно повышается);
- симптом горячей ванны (симптом Утхоффа) заключается во временном усилении выраженности отдельных проявлений после принятия ванны, после приема горячей еды, при повышении температуры тела или окружающей среды (жара в летний день). Через небольшой промежуток времени (обычно около 30 минут) симптомы вновь возвращаются на исходный уровень. Это связано с повышением чувствительности нервных волокон, оставшихся без миелиновой оболочки;
- феномен мерцания симптомов: в течение какого-то небольшого промежутка времени колеблется выраженность симптомов. Это может быть даже в течение дня. Например, утром слабость в ногах была такой, что затрудняла самостоятельное передвижение, а к вечеру силы в ногах вновь предостаточно. Это связывают с чувствительностью пораженных структур к колебаниям показателей внутренней среды (гомеостаза).
Выделяют несколько типов течения рассеянного склероза:
- дебют заболевания;
- рецидивирующе-ремиттирующее течение;
- первично-прогрессирующее;
- вторично-прогрессирующее.
Тип течения играет роль в отношении прогноза заболевания и назначении лечения.
Дебют – это впервые выявленный достоверный рассеянный склероз.
Рецидивирующе-ремиттирующий тип характеризуется волнообразным течением заболевания с четкими периодами обострений (когда состояние ухудшается, появляются новые симптомы) и ремиссий (восстановление нарушенных функций).
Первично-прогрессирующее течение характеризуется неуклонным ухудшением состояния без «светлых» промежутков с самого начала заболевания.
Вторично-прогрессирующая форма возникает, когда при рецидивирующе-ремиттирующем типе течения заканчиваются периоды ремиссии и улучшение больше не наступает. В течение 10 лет такое превращение происходит у 50% больных, через 25 лет – у 80%.
Первично- и вторично-прогрессирующие типы течения характеризуются худшим прогнозом для трудоспособности и жизни.
Срок жизни больных с рассеянным склерозом
Продолжительность жизни больного рассеянным склерозом зависит от многих причин:
- возраста начала заболевания;
- своевременной диагностики;
- типа течения;
- получает ли больной превентивную терапию (об этом виде лечения Вы можете узнать из одноименной статьи);
- развития осложнений рассеянного склероза (пролежни, инфекции мочевыводящих путей и легких и др.);
- сопутствующей патологии, то есть наличия других заболеваний.
На срок жизни пациента с рассеянным склерозом оказывает влияние своевременность диагностики больше, чем при многих других заболеваниях. Это настолько коварное заболевание, что его первые симптомы могут быть не замечены или проигнорированы больным, и он не станет обращаться за медицинской помощью. А значит, не получит столь актуальное лечение. Ведь, если терапия начата еще в дебюте болезни, то это значительным образом улучшает качество жизни, во многих случаях останавливает прогрессирование болезни, способствует предотвращению инвалидности и продлению срока жизни.
В начале XX века больные с диагнозом рассеянный склероз жили максимум 30 лет в случае благоприятного течения болезни. В XXI веке срок жизни значительно удлинился.
Статистические данные свидетельствуют, что при ранней диагностике заболевания, рецидивирующе-ремиттирующем типе течения, полноценном лечении в среднем больные живут на 7 лет меньше, чем их ровесники, не имеющие такого диагноза.
Больные, у которых болезнь была диагностирована после 50 лет, при качественном лечении в среднем живут 70 лет. Больные с наличием осложнений в этом случае живут до 60 лет. Однако у каждого правила есть исключения, поэтому точно предсказать, как поведет себя заболевание и сколько проживет конкретный больной, весьма сложно.
Рассеянный склероз – это аутоиммунно-воспалительное заболевание, поражающее нервную систему человека, причины которого до сих пор полностью не изучены. Клинические симптомы при РС очень разнообразны и неспецифичны, что затрудняет диагностику. На продолжительность жизни таких больных влияют многие факторы, в том числе и своевременное обращение за медицинской помощью.
Видео версия статьи:
Рассеянный склероз ( Бляшечный склероз , Множественный склероз , Пятнистый склерозрассеянный склерозирующий периаксиальный энцефаломиелит )
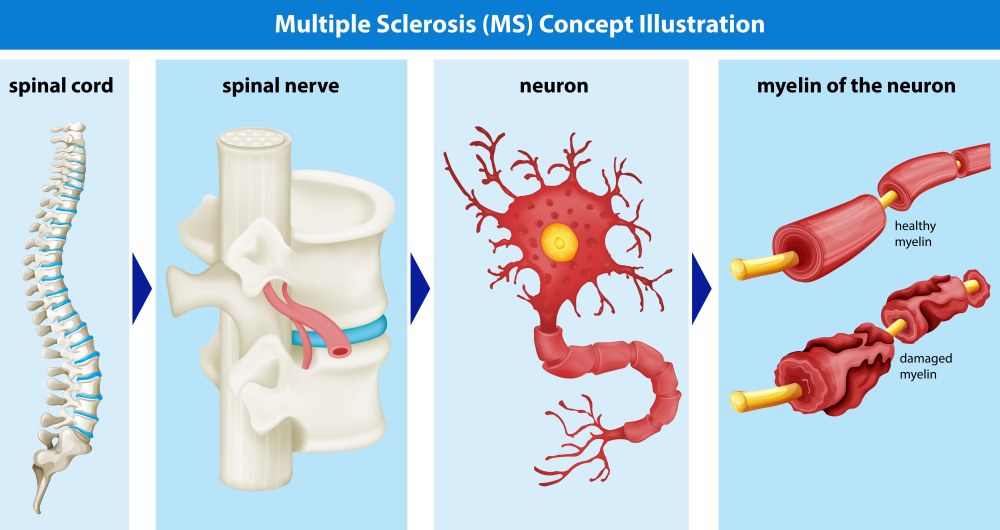
Рассеянный склероз – неврологическая патология с прогредиентным течением, вызванная демиелинизацией проводящих путей с последующим формированием склеротических бляшек в очагах деструкции миелина. Среди симптомов рассеянного склероза преобладают двигательные нарушения, расстройства чувствительности, неврит зрительного нерва, нарушения функции тазовых органов, нейропсихические изменения. Диагноз подтверждается с помощью МРТ головного мозга, электрофизиологических исследований, неврологического и офтальмологического обследования. Медикаментозная патогенетическая терапия рассеянного склероза проводится глюкокортикоидами, иммуномодуляторами, иммунодепрессантами
МКБ-10


Общие сведения
Рассеянный склероз — хроническое прогрессирующее заболевание, характеризующееся множественными очагами поражения в центральной и в меньшей степени периферической нервной системе. Понятию «рассеянный склероз» в неврологии также соответствуют: бляшечный склероз, множественный склероз, пятнистый склероз, рассеянный склерозирующий периаксиальный энцефаломиелит.
Дебют заболевания обычно приходится на молодой, активный возраст (20-45 лет); в большинстве случаев рассеянный склероз развивается у лиц, занятых в интеллектуальной сфере. Рассеянным склерозом чаще страдают жители стран с умеренным климатом, где показатель заболеваемости может достигать 50-100 случаев на 100 тыс. населения.

Причины и патогенез
Развитие рассеянного склероза, относящегося к мультифокальным заболеваниям, обусловлено взаимодействием факторов внешней среды (географических, экологических, вирусов и иных микроорганизмов) и наследственной предрасположенности, которая реализуется полигенной системой, определяющей особенности иммунного ответа и метаболизма. Ведущую роль в патогенезе рассеянного склероза играют иммунопатологические реакции.
Одно из первых событий в патогенезе этого заболевания — активация анергичных аутореактивных по отношению к антигенам миелина CD4+ Т-клеток на периферии (вне ЦНС). Во время этого процесса происходит взаимодействие рецептора Т-клетки и антигена, связанного с молекулами II класса главного комплекса гистосовестимости на антиген-презентующих клетках, в качестве которых выступают дендритные клетки. При этом антигеном может быть персистирующий инфекционный агент.
В результате Т-клетки пролиферируют и дифференцируются преимущественно в Т-хелперы типа 1, которые продуцируют провоспалительные цитокины, что способствует активации других иммунных клеток. На следующем этапе Т-хелперы мигрируют через гематоэнцефалитичекий барьер. В ЦНС происходит реактивация Т-клеток антиген-презентирующими клетками (микроглия, макрофаги).
Развивается воспалительная реакция, вызванная повышением уровня провоспалительных цитокинов. Проницаемость гематоэнцефалитического барьера усиливается. Нарушается В-клеточная толерантность с возрастанием титров антител к различным структурам олигодендроглии и миелина. Повышается уровень активных форм кислорода, активность системы комплемента. В результате этих событий развивается демиелинизация с повреждением нервного волокна уже на ранних стадиях патологического процесса, гибель олигодендроглиоцитов и формирование бляшки.
Классификация
В настоящее время рассеянный склероз классифицируют по типу течения заболевания. Выделяют основные и редкие варианты развития болезни. К первым относятся: ремитирующее течение, вторично-прогрессирующее (с обострениями или без таковых), первично-прогрессирующие.
- Ремитирующее течение рассеянного склероза наиболее типично (до 90% случаев). Выделяют период появления первых симптомов или существенного усиления существующих длительностью не менее суток (экзацербация) и период их регресса (ремиссия). Первая ремиссия чаще бывает более длительной относительно последующих, поэтому этот период обозначают как этап стабилизации.
- Вторично-прогрессирующее течение рассеянного склероза наступает после ремитирующего течения, длительность которого индивидуальна для каждого пациента. Наступает стадия хронического прогрессирования с периодами обострения и стабилизации. Нарастание неврологического дефицита обусловлено прогрессирующей дегенерацией аксонов и снижением компенсаторных возможностей мозга.
- При первично-прогрессирующем течении рассеянного склероза (12-15% случаев) отмечается неуклонное нарастание признаков поражения нервной системы без обострений и ремиссий на протяжении всей болезни. Такое течение заболевание обусловлено преимущественно нейродегенеративным характером развития патологического процесса. Спинальная форма рассеянного склероза встречается крайне редко, с возможным дебютом до 16 лет или после 50 лет.

Симптомы рассеянного склероза
Клиническая картина рассеянного склероза отличается чрезвычайным полиморфизмом, особенно в дебюте заболевания, которое может быть и поли-, и моносимптомным. Часто заболевание начинается со слабости в ногах, реже с чувствительных и зрительных нарушений. Расстройства чувствительности проявляются чувством онемения в различных частях тела, парестезиями, радикулярными болями, симптомом Лермитта, а зрительные — оптическим невритом с выраженным снижением зрения, которое позднее, как правило, восстанавливается.
В некоторых случаях рассеянный склероз дебютирует с шаткой походки, головокружения, рвоты, нистагма. Иногда в начале заболевания может быть нарушена функция тазовых органов в виде задержек или частых позывов на мочеиспускание. Для ранних этапов рассеянного склероза типична дробность появления отдельных симптомов.
С развитием рассеянного склероза в клинической картине чаще всего выявляют разной степени выраженности симптомы поражения пирамидных, мозжечковых и чувствительных путей, отдельных ЧН и нарушение функций тазовых органов. Выраженность отдельных симптомов может варьироваться не только в течение нескольких дней, но даже часов. Среди типичных клинических проявлений рассеянного склероза ведущее место занимают парезы. Особенно часто наблюдают нижний спастический парапарез, реже — тетрапарез. Выраженность спастичности зависит от позы пациента. Так, в положении лежа гипертонус мышц менее интенсивен, чем в вертикальной позе, что особенно заметно при ходьбе.
Признаки, обусловленные поражением мозжечка и его связей — динамическая и статическая атаксия, дисметрия, асинергия, интенционное дрожание, мегалография, скандированная речь. При поражении зубчато-красноядерных путей интенционный тремор принимает характер гиперкинеза, резко усиливающегося при перенаправлении движения, а в тяжелых случаях распространяется на голову и туловище. У большинства пациентов вызываются стопные патологические рефлексы сгибательного и разгибательного типов, в редких случаях кистевые патологические рефлексы, клонус стоп и надколенников. В 30% случаев выявляются рефлексы орального автоматизма. Нередко наблюдается патология ЧН в виде оптического неврита и межъядерной офтальмоплегии.
Отличительной особенностью рассеянного склероза является т. н. синдром «диссоциации», который отражает несоответствие между симптомами поражения одной или нескольких систем. Например, существенное снижение зрения в отсутствие изменений глазного дна при наличии оптического неврита или, наоборот, существенные изменения глазного дна, изменение полей зрения и наличие скотомы при нормальной остроте зрения. В ряде случаев на поздних стадиях заболевания выявляют вовлечение в процесс периферической нервной системы в виде радикулопатии и полиневропатии. Среди нейропсихологических нарушений наиболее часто встречаются аффективные нарушения (эйфория, депрессивный синдром), своеобразное органическое слабоумие, неврозоподобные состояния (истерические и истероформные реакции, астенический синдром).
Диагностика
Существуют определенные критерии диагностирования рассеянного склероза:
- наличие признаков многоочагового поражения ЦНС (преимущественно белого вещества головного и спинного мозга)
- постепенное появление различных симптомов болезни
- нестойкость некоторых симптомов
- ремитирующее или прогрессирующее течение заболевания
- данные дополнительных исследований
Лабораторные и инструментальные методы диагностики используют для выявления субклинических очагов поражения, а также для оценки активности патологического процесса. Основным методом, подтверждающим диагноз «рассеянный склероз», является МРТ головного мозга, которая позволяет выявить наличие и топографическое распределение предполагаемых очагов демиелинизации.
При вовлечении в процесс на субклиническом уровне соответствующих афферентных систем проводят исследования ССВП, ЗВП и слуховых вызванных потенциалов. Для регистрации клинически выраженных нарушений статики, а также слуха и нистагма проводят соответственно стабилографию и аудиометрию. На ранних стадиях рассеянного склероза для идентификации нарушений, типичных для оптического неврита, обязательно проводят офтальмологическое исследование.

Дифференциальный диагноз
Рассеянный склероз необходимо дифференцировать прежде всего от заболеваний, сопровождающихся многоочаговым поражением ЦНС — коллагенозов и системных васкулитов (синдром Шегрена и болезнь Бехчета, системная красная волчанка (СКВ), узелковый периартериит, гранулематоз Вегенера) и инфекционных заболеваний с первичным мультисистемным поражением (ВИЧ-инфекция, бруцеллез, сифилис). Следует помнить, что для всех вышеуказанных заболеваний типично сочетание с патологией иных органов и систем. Кроме того, при рассеянном склерозе проводят дифференциальную диагностику с заболеваниями нервной системы — болезнь Вильсона, различные типы атаксий, семейный спастический паралич, которые отличаются от рассеянного склероза вялым прогрессированием или длительной стабилизацией патологического процесса.
Лечение рассеянного склероза
Пациентам с рассеянным склерозом следует постоянно находиться под постоянным наблюдением невролога. Цели лечение при рассеянном склерозе включают: купирование и профилактику обострений, замедление прогрессирования патологического процесса.
Для купирования обострений рассеянного склероза чаще всего используют пульс-терапию метилпреднизолоном в течение 4-7 дней. При малой эффективности данной пульс-терапии после ее завершения назначают метилпреднизолон перорально через день с постепенным снижением дозы в течение месяца. Перед началом лечения необходимо исключить противопоказания к использованию глюкокортикоидов, а в процессе лечения добавить и сопроводительную терапию (препараты калия, гастропротекторы). В случае обострения возможно проведение плазмофереза (от 3 до 5 сеансов) с последующим введением метилпреднизолона.
Важнейшим направлением патогенетической терапии рассеянного склероза является модулирование течения заболевания с целью предупреждения обострений, стабилизировать состояние пациента и по возможности предотвратить трансформацию ремитирующего течения заболевания в прогрессирующее. Составляющие патогенетической терапии рассеянного склероза — иммуносупрессанты и иммуномодуляторы — имеют единое название «ПИТРС» (препараты, изменяющие течение рассеянного склероза). используют иммуномодуляторы, содержащие интерферон бета (интерферон бета-1а для п/к и в/м введения) и глатирамера ацетат. Данные препараты изменяют иммунный баланс в направлении противовоспалительного ответа.
Препараты второй линии — иммуносупрессанты — блокируют многие иммунные реакции и препятствуют проникновению лимфоцитов через гематоэнцефалитический барьер. Клиническую эффективность иммуномодуляторов оценивают не реже одного раза в З месяца. Показано ежегодное проведение МРТ. При использовании интерферонов бета необходимо регулярное проведение анализов крови (тромбоциты, лейкоциты) и функциональных проб печени (АЛТ, АСТ, билирубин). Из группы иммунодепрессантов, помимо натализумаба и митоксантрона, в ряде случаев используют циклоспорин, азатиоприн.
Целью симптоматической терапии является купирование и ослабление основных проявлений рассеянного склероза. Для купирования хронической усталости применяют антидепрессанты (флуоксетин), амантадин и средства, стимулирующие ЦНС. При постуральном треморе применяют неселективные бета-адреноблокаторы (пропранолол) и барбитураты (фенобарбитал, примидон), при интенционном треморе — карбамазепин, клоназепам, при треморе покоя — препараты леводопы. Для купирования параксизмальных симптомов используют карбамазепин или иные антиконвульсанты и барбитураты.
Депрессия хорошо поддается лечению амитриптилином (трициклический антидепрессант). Однако следует помнить о способности амитриптилина к задержке мочеиспускания. Тазовые нарушения при рассеянном склерозе обусловлены изменение характера мочеиспускания. При недержании мочи используют антихолинергические препараты, антагонисты кальциевых каналов. В случае нарушения опорожнения мочевого пузыря применяют миорелаксанты, стимуляторы сократительной активности детрузора мочевого пузыря, холинергические средства и интермиттирующую катетеризацию.
Прогноз и профилактика
При рассеянном склерозе прогноз на дальнейшую жизнь в целом благоприятный. Возможность летального исхода можно свести к минимуму с помощью адекватного лечения основного заболевания и своевременных реанимационных мероприятий (в том числе ИВЛ). Естественное течение рассеянного склероза подразумевает инвалидизацию пациентов в течение первых 8-10 лет заболевания.
Методов первичной профилактики рассеянного склероза на сегодня не существует. Основной составляющей вторичной профилактики рассеянного склероза является продолжительная иммуномодулирующая терапия.
Демиелинизирующее заболевание ЦНС: классификация, симптомы и причины
1. Определение 2. Бытовые аналогии 3. Этиология и причины процесса 4. Классификация 5. Патогенез 6. Клиника 7. Рассеянный склероз 8. Оптикомиелит Девика 9. Концентрический склероз Бало, или периаксиальный концентрический лейкоэнцефалит 10. ОРЭМ, он же острый рассеянный энцефаломиелит, или болезнь Марбурга 11. Синдром Гийена – Барре 12. Лечение
История изучения демиелинизирующих заболеваний восходит к выдающемуся французскому неврологу Жану – Мартену Шарко. Незадолго до отмены крепостного права в Российской империи, в 1856 году, он выделил особые признаки заболевания, которое получило название «рассеянный склероз». Позже выяснилось, что в основе этого и целого ряда других болезней лежат особые изменения белого вещества.

Это поражение получило название «демиелинизация». Что это такое? Это патологический процесс, при котором начинается разрушение миелиновой оболочки проводящих путей центральной нервной системы. Главным заболеванием из этой группы с наибольшей частотой встречаемости был и остается рассеянный склероз. Его распространенность в мире и характер поражения нервной системы являются объектом изучения во многих странах. Расскажем о том, что такое демиелинизирующая патология центральной нервной системы, как она начинается, какими заболеваниями она представлена у взрослых и детей, и как она лечится.
Определение
Как было сказано выше, демиелинизирущие заболевания – это группа болезней, вызванные разрушением белого вещества головного и спинного мозга (точнее, миелиновой оболочки нервных клеток), и связанного с ним многообразия клинических признаков, вызванных ухудшением проведения нервного импульса.
Эти изменения касаются только миелиновой оболочки нервных волокон. Нужно не забывать, что проводящие пути головного и спинного мозга, по сути – это биологические провода. Они нуждаются в надежной изоляции.
Бытовые аналогии
Представьте, что толстый кабель, состоящий из нескольких сотен отдельных проводов, питающий целый квартал или микрорайон, в нескольких местах утратил изоляцию, например, был «проеден мышами». В результате во многих квартирах будут различные «симптомы» поражения. Иногда будет гаснуть свет, отключаться телевизоры, холодильники, кондиционеры. В других квартирах просто будет темно, не будут включаться электропечи, и обогреватели. В подвале поднимется вода, поскольку отключится насос, а из трансформаторной будки будет слышен треск, и пахнуть озоном.

Эти множественные признаки, которые на первый взгляд, никак не связаны в месте и во времени между собой, тем не менее, имеют общую природу и точную локализацию поражения, которое заключается в «очаговом» отсутствии изоляции в одном кабеле. Именно в этом и заключается патология центральной нервной системы, которая носит демиелинизирующий характер.
Процесс же разобщения признаков болезни в месте и времени называется «диссеминацией». Этот термин также ввел Шарко, пытаясь понять, как строится поражения нервной системы при рассеянном склерозе. Поэтому современное название рассеянного склероза – SD (sclerosis disseminatus). Наличие диссеминации является очень важным, так как помогает поставить правильный диагноз.
Этиология и причины процесса
Причины развития демиелинизирующих заболеваний до конца не изучены. Главный «столп», рассеянный склероз, может вызваться как иммунными нарушениями, так и разными инфекциями, экологической обстановкой, географической широтой проживания, а также генетической предрасположенностью к «сбоям» в системе иммунитета, когда поражен «наследственный код».
Интересно, что такая патология, как рассеянный склероз, «любит» северные широты. Чем дальше от экватора, тем выше частота заболеваемости. Иногда провоцирующим фактором называют сильный и продолжительный стресс, долгий стаж курения, и даже вакцинации от вирусных гепатитов.
Иногда изменения белого вещества наступают в пожилом возрасте, по типу деменции. В других случаях дебютом заболевания может быть аутоиммунное заболевание, в таком случае возникает вторичная демиелинизация, как при болезни Девика.

Более явно прослеживается связь с перенесенной инфекцией (кишечной, респираторной) при тяжелом поражении всей нервной системы – восходящем остром энцефаломиелополирадикулоневрите, или синдроме Гийена – Барре, которое может протекать по типу восходящего паралича Ландри.
Отмечено повышение частоты этого заболевания у лиц, страдающих хроническим алкоголизмом, видимо, за счет токсического поражения нервов.
Наконец, есть болезни, при которых разрушение волокон белого вещества протекает без всяких видимых причин, например, при концентрическом склерозе Бало.
Кроме того процесс разрушения миелина активно происходит при третичном периоде сифилиса, при возникновении спинной сухотки и прогрессивного паралича.
Из этого можно сделать вывод, что диагностика демиелинизирующих заболеваний по анамнестическим данным почти невозможна, и можно ориентироваться только на симптомы, характер поражения нервной системы, и на инструментальные способы. И только в редких случаях инфекция, или иммунные нарушения могут способствовать развитию этих полиэтиологичных и мультифакторных болезней.
Классификация
Многочисленное, в том числе многоочаговое поражение миелина в разных отделах, а так же разнообразие клинических признаков, потребовало нового подхода. Современная классификация по МКБ-10 располагает эту группу в разделе нервных заболеваний, но особо выделяет рассеянный склероз «G35», как наиболее частое заболевание, этот код так же используется чаще других. Остальные болезни МКБ располагает в отдельной подгруппе, но даже в специализированных неврологических стационарах эти диагнозы используют очень редко. И вообще, специалисты знают, что МКБ-10 достаточно несовершенна.

Отдельная классификация главного «представителя» – рассеянного склероза – также очень обширна. Настолько, что есть классификация классификаций, посвященная только этому заболеванию. Судите сами: можно найти сходные группы признаков по морфологии и локализации изменения в веществе мозга, степени разрушения миелиновой оболочки (стадии тяжести). Можно классифицировать по течению (ремитирующее, интермиттирующее, прогредиентное, другие виды). Наконец, существует очень большая шкала инвалидизации EDSS при рассеянном склерозе, которая оценивает почти все (равновесие, самообслуживание, параличи, походку, тазовые расстройства), и для работы с этой шкалой врачу нужно сдавать специальный экзамен.
Патогенез
Разрушение миелина лежит в основе патогенеза всех заболеваний. Эти изменения накапливаются постепенно, приводя к клиническим проявлениям. Тем не менее, есть определенные и обязательные звенья в развитии всех заболеваний этой группы, но мы рассмотрим патогенез на примере РС:

Что интересно, при этих заболеваниях возможен обратный процесс наработки миелина – ремиелинизация, или постепенное восстановление оболочки нервного волокна. Но он происходит очень медленно, и совсем останавливается при длительном течении заболевания.
Клиника
Симптомы демиелинизирующих заболеваний настолько разнообразны, что подробное их изложение займет чрезвычайно большой объем. Кроме того, у взрослых и детей возможны существенные различия характера течения заболеваний. Поэтому ограничимся простым перечислением групп симптомов, характерных для различных болезней.
Рассеянный склероз
Начальные признаки определил «первооткрыватель» заболевания. Они известны, как «триада Шарко»: нистагм, скандированная речь, интенционный тремор. Глазодвигательные симптомы в виде двоения в глазах, наружной и внутренней офтальмоплегии бывают заметны уже на ранних этапах заболевания. Пациенты замечают изменения функции тазовых органов: возникают императивные позывы, или задержка мочеиспускания.

Также в неврологической классике выделяют дополнение к «триаде Шарко» – побледнение височных половин дисков зрительных нервов, и отсутствие брюшных рефлексов.
При дальнейшем развитии появляются самые разные признаки:
- парез лицевого нерва, или невралгия тройничного нерва;
- расстройства равновесия, слуха, головокружения;
- мозжечковые расстройства: асинергия Бабинского, адиадохокинез, интенционный тремор, нарушение в позе Ромберга,
- пирамидная симптоматика: разнообразные параличи и парезы, слабость в конечностях, повышение тонуса по пирамидному типу;
- расстройства чувствительности (тактильной, болевой, температурной).
Изредка наблюдаются расстройства психики, в виде эйфории, плаксивости. Часто развивается депрессия, которая достоверно ухудшает течение заболевания.
Важно, что при поражении белого вещества никогда не возникает эпиприпадков. Поэтому, если у пациента с демиелинизирующим заболеванием есть эписиндром, то, возможно, имеется вторичный энцефалит с вовлечением коры мозга.
На томограмме МРТ представлена характерная картина очагов демиелинизации, по которой и выставляется окончательный диагноз. Видно характерное перивентрикулярное расположение (рядом с желудочками).

Оптикомиелит Девика
Симптомы при этом заболевании говорят о том, что поражение оболочки нервных волокон происходит в области зрительных нервов. Вначале наступает снижение остроты зрения, даже может быть, до полной потери. Через некоторое время (год – два) возникают тяжелые поражения спинного мозга, по типу миелита, с параличом ниже места поражения, тазовыми расстройствами и глубокой инвалидизацией. В редких случаях может происходить некроз спинного мозга без возможности восстановления. Заболевание редкое, диагностировано только у взрослых, случаев заболевания детей отмечено не было.

Концентрический склероз Бало, или периаксиальный концентрический лейкоэнцефалит
В отличие от болезни Девика, происходит поражение волокон в полушариях, заболевание протекает «зловеще», и довольно быстро приводит к смерти. Болеют малайцы, филлипинцы. За всю историю выявлено не более 70 случаев. Что интересно, ствол мозга не поражается.
Начинается остро, с лихорадки. Затем быстро развиваются параличи и парезы, эпилепсия, психические нарушения, снижается острота зрения, появляется слепота, грубые изменения личности. Смерть наступает через несколько месяцев. Код МКБ-10 G37.5

На МРТ отчетливо видны концентрические круги, похожие на срез древесного сучка.
ОРЭМ, он же острый рассеянный энцефаломиелит, или болезнь Марбурга
В некоторых случаях ОРЭМ и болезнь Марбурга считают разными заболеваниями: ОРЭМ может протекать более благоприятно, но иметь хронически – рецидивирующий характер.

Как видно по МРТ, видны большие, сливные очаги с хорошим накоплением контраста. При Рассеянном склерозе, как правило, нет тенденции к их слиянию. На этом феномене, а также на течении болезни основана диагностика.
Синдром Гийена – Барре
Лечение
Терапия этих заболеваний сложная и длительная. Так, лечение синдрома Гийена – Барре включает в себя плазмаферез, введение иммуноглобулинов. Наиболее всего разработано лечение при рассеянном склерозе. Применяются следующие виды терапии:
Кроме того, требуется лечение симптоматическое: параличей и парезов, нарушений спастики, требуется лечение и профилактика нарушений мочеиспускания и мочевой инфекции. Важная роль отводится реабилитации, активизации пациента.
Современное понятие о рассеянном склерозе – это заболевание, которое неизбежно ведет к инвалидности. Но срок длительной ремиссии, на которую можно задержать развитие инвалидности, если своевременно начато правильное лечение, может составлять десятки лет. Это означает, что при развитии признаков заболевания в 20 лет можно сохранить порой активную и полноценную жизнь до 60 лет с минимальными признаками инвалидности (например, невозможность быстро бегать).
В заключение можно сказать, что группа демиелинизирующих заболеваний очень разнообразна. Очень интересная перспектива по активизации процесса ремиелинизации с применением клеточных технологий. Так, по современным исследованиям, аутотрансплантация стволовых клеток может полностью вылечить лабораторное животное от признаков рассеянного склероза. Наступает время людей.
Неврологические проявления сахарного диабета

Вряд ли можно назвать болезнь, при которой в патологический процесс не вовлекалась бы нервная система. Поражение нервной системы занимает ведущее место и в клинической картине сахарного диабета (СД). По выражению А.Васильева: «СД не всегда следствие сладкой жизни». Термин СД объединяет метаболические нарушения различной этиологии, характеризующиеся наличием хронической гипергликемии с последующим нарушением жирового, углеводного и белкового обменов, развивающихся в результате дефектов секреции и/или действия инсулина [1].
Опасность СД
В настоящее время Всемирная организация здравоохранения определяет ситуацию с сахарным диабетом как эпидемию неинфекционного заболевания. Так, в Российской Федерации, по данным ряда исследователей, страдают СД около 6–8 млн человек (или примерно 4,2% населения). СД является одной из десяти главных причин смертности. Общая смертность больных СД в 2,3 раза выше смертности среди остального населения. При этом в 80% случаев смертность обусловлена сердечнососудистыми заболеваниями (в первую очередь, инфарктом миокарда и мозговым инсультом), в то время как от самого СД (диабетических ком) умирают не более 1% больных. Вследствие этого ряд западных кардиологов причисляют СД к сердечно-сосудистым заболеваниям. Инвалидизация вследствие сахарного диабета составляет 2,6% в структуре общей инвалидности.
В большинстве европейских стран СД поглощает до 10% средств национальных фондов здравоохранения. Так, например, в Германии ежегодные расходы, связанные с СД, составляют 12,44 млрд евро. По данным Российской академии медицинских наук, в нашей стране расходы на лечение больных СД должны составлять 30–40 млрд. дол. США (т.е. 5 тыс. дол. на 1 больного).
СД как хроническое заболевание влияет на качество жизни больных. При этом главным фактором, определяющим качество жизни пациента, является степень поражения нервной системы (развитие диабетической нейропатии). В этом плане весьма драматична жизнь известного художника Поля Сезанна, который страдал СД. Сезанн писал: «Мой возраст и мое здоровье не дадут мне осуществить мечту, к которой я стремился всю мою жизнь». Считают, что его «расплывчатый» стиль – это следствие осложнений СД на глаза (рис. 1, 2).
Рис. 1. Гора святой Виктории (1904 г.).

Рис. 2. Черный замок (1904 г.).
.jpeg)
В конце жизни художник из-за диабета уже не мог далеко ходить пешком, но каждый день в любую погоду, невзирая на болезнь, отправлялся на этюды в повозке. На рис. 3 изображена последняя работа художника, во время написания которой он попал под сильный дождь и вскоре умер от воспаления легких.
Рис. 3. Хижина Журдена (1906 г.).

Диабетическая нейропатия
Диабетическая нейропатия – комплекс патологических изменений со стороны разных отделов и структур нервной системы, развивающийся в результате метаболических нарушений, характерных для больных СД. Она развивается вследствие распространенного поражения нейронов и их отростков как в периферической, так и центральной нервной системе [2]. Ниже представлена современная классификация диабетической нейропатии.
I. Центральная диабетическая нейропатия (энцефалопатия, миелопатия и др.).
II. Периферическая диабетическая нейропатия:
1. Дистальная симметричная нейропатия
– с преимущественным поражением чувствительных нервов (сенсорная форма),
– с преимущественным поражением двигательных нервов (моторная форма),
– с комбинированным поражением нервов (сенсомоторная форма),
2. Диффузная автономная нейропатия
– сердечно-сосудистой системы (безболевой инфаркт миокарда, ортостатическая гипотензия, нарушение ритма сердца),
– желудочно-кишечного тракта (атония желудка, атония желчного пузыря, диабетическая энтеропатия – ночная диарея),
– мочеполовой системы («нервный мочевой пузырь», половая дисфункция),
– других органов и систем (нарушение зрачкового рефлекса, нарушение потоотделения, бессимптомные гипогликемии);
III. Очаговая нейропатия (черепных нервов, мононейропатия – верхних или нижних конечностей, множественная мононейропатия, полирадикулопатия, плексопатия).
Развитие диабетической нейропатии может предшествовать клинической манифестации основного заболевания. При длительности заболевания более 5–7 лет различные проявления диабетической нейропатии обнаруживаются практически у каждого пациента (даже несмотря на полноценность гипогликемической терапии). В связи с этим некоторые авторы рассматривают нейропатию не как осложнение, а как неврологическое проявление СД. В патогенезе диабетической нейропатии наиболее важную роль играют микроангиопатия и метаболические нарушения.
Диабетическая энцефалопатия
Среди центральной диабетической нейропатии внимание заслуживает диабетическая энцефалопатия. Термин «диабетическая энцефалопатия» предложил R. de Jong в 1950 г. По данным литературы, частота этой патологии колеблется от 2,5 до 78% (такие расхождения в частоте обнаружения обусловлены неоднородными контингентами обследованных больных и методами диагностики болезни) [3]. Диабетическую энцефалопатию различают по степени проявления, темпам их развития (течению) и особенностям патогенеза.
Основными клиническими проявлениями диабетической энцефалопатии являются неврозоподобные состояния, нарушение когнитивных функций и органическая неврологическая симптоматика. В настоящее время выделяют 4 этапа психологического кризиса: первый связан с развитием сахарного диабета, второй – с развитием осложнений, третий – с назначением инсулинотерапии и четвертый – со стационарным лечением. М.Bleuler (1948 г.) объединил психические нарушения, перекрывающиеся с эндокринной патологией, понятием «эндокринный психосиндром».
Развитие неврозоподобных нарушений (в первую очередь, депрессии) обусловлено действием как соматогенных факторов (гипогликемические реакции, поражение внутренних органов и др.), так и психогенных (необходимость постоянного соблюдения диеты и медикаментозного лечения, вероятность тяжелых инвалидизирующих осложнений, импотенция, бесплодие и др.). На момент первичного осмотра депрессивная симптоматика выявляется у 35,4% больных. При этом о наличии депрессивных нарушений за период болезни сообщает 64,6% больных СД.
Основными признаками развития психических расстройств при СД являются: акцентуации личности, психогенная природа СД, неблагоприятная микросоциальная среда, неудовлетворительная компенсация СД, длительность болезни более 10 лет, наличие инвалидизирующих осложнений.
На начальных этапах диабетической энцефалопатии выявляются микросимптомы рассеянного органического поражения мозга, свидетельствующие о его диффузном поражении. По мере прогрессирования заболевания возможно развитие грубой органической симптоматики, указывающей на наличие очага поражения головного мозга.
И.А.Волчегорским и соавт. (2006 г.) разработаны предикторы диабетической энцефалопатии и алгоритм выявления данной патологии:
где а – возраст (годы), б – индекс массы тела (кг/м2), в – диеновые конъюгаты (е.и.о.), г – холестерин липопротеидов низкой плотнсоти (ммоль/л), д – уровень сахара в крови (ммоль/л) на 23.00 ч, е – на 7.00 ч.
Величина F больше критического значения 0,0245 свидетельствует о наличии ДЭ.
По темпам развития ДЭ делят на быстро и медленно прогрессирующие. На течение заболевания наибольшее влияние оказывают гипогликемические эпизоды (в результате неадекватной коррекции гипергликемии). По данным литературы, «в чистом виде» ДЭ встречается лишь у больных СД типа 1 (в 80,7% случаев), поскольку ее развитие обусловлено преимущественно неэффективным метаболическим контролем. Смешанная энцефалопатия диагностируется у 82,7% больных СД типа 2 в связи с преобладающим патогенетическим влиянием дисгемических факторов (гиперлипидемия и артериальная гипертония – АГ).
Сопутствующие поражения при СД
Сдвиги липидного обмена при СД (особенно типа 2) настолько характерны, что получили название «диабетическая дислипидемия», она развивается в 69% случаев. Компонентами диабетической дислипидемии являются повышенное содержание триглицеридов и липопротеидов низкой плотности, а также снижение уровня липопротеидов высокой плотности. Вследствие этого, по данным ряда исследователей, у больных СД отмечается раннее (на 10–15 лет раньше) развитие атеросклероза.
Что касается АГ, то она встречается в 1,5–2 раза чаще по сравнению с лицами без нарушения углеводного обмена. По данным литературы, около 80% больных СД страдают АГ, которая является причиной смерти более чем у 50% пациентов. Так, доказано, что повышение систолического артериального давления (АД) на каждые 10 мм рт. ст. сопряжено с увеличением смертности на 15%. Основной причиной развития (80%) АГ у больных СД типа 1 является диабетическая нефропатия. При этом наиболее часто она встречается спустя 15 20 лет от начала заболевания. При СД типа 2 в 70–80% случаев выявляется эссенциальная гипертония, которая нередко предшествует развитию самого СД.
СД является одним из главных факторов риска возникновения сосудистой деменции, которая встречается при данной патологии в 8,9% случаев. При этом гипогликемия оказывает более негативное влияние на когнитивные функции, чем гипергликемия. Так, доказано, что пациенты с частыми эпизодами гипогликемии имеют высокий риск развития деменции спустя 4–7 лет.
На данный момент остается открытым вопрос о включении мозговых инсультов, развившихся на фоне СД, в классификацию диабетической нейропатии. Тем не менее некоторые неврологи рассматривают инсульт как проявление центральной диабетической нейропатии. Другие же считают острые нарушения мозгового кровообращения клиническим синдромом макроангиопатии, который развивается при длительности нарушений углеводного обмена более 5–7 лет [4]. По образному выражению А.С.Ефимова, «…начинается диабет, как болезнь обмена, а заканчивается, как сосудистая патология». Однако канадские исследователи по архивным данным собрали группу приблизительно 12 200 взрослых старше 30 лет, которым недавно был поставлен диагноз СД типа 2. В течение ближайших 5 лет 9,1% пациентов были госпитализированы с разными типами инсульта. Авторы пишут, что результаты их исследования «рассеивают мнение о том, что макрососудистые последствия СД наступают только в долгосрочной перспективе» [5].
Рис. 4. Пациентка Б. с выраженным двигательным дефектом.

При СД чаще развиваются ишемические инсульты, которые имеют ряд особенностей:
часто развиваются на фоне повышенного АД;
формируются обширные очаги поражения;
нередко сопровождаются расстройствами сознания, явлениями декомпенсации углеводного обмена, застойными пневмониями, цереброкардиальным синдромом (в сочетании с инфарктом миокарда);
неврологические симптомы исчезают медленно;
утраченные функции, как правило, восстанавливаются частично;
летальность составляет 40,3–59,3% [6].
Диабетическая полинейропатия
Среди периферической диабетической нейропатии первое место (70%) занимает дистальная симметричная сенсомоторная нейропатия (в последующем диабетическая полинейропатия). Диабетическая полинейропатия (ДПН) встречается в среднем в 40–60% случаев (и имеет тенденцию роста в зависимости от длительности СД). ДПН значительно снижает качество жизни больных и является одним из основных факторов риска развития синдрома диабетической стопы.
Синдром диабетической стопы – инфекция, язва и/или деструкция глубоких тканей стопы, связанная с неврологическими нарушениями и/или снижением магистрального кровотока в артериях нижних конечностей различной степени тяжести.
Рис. 5. Синдром диабетической стопы.

Несмотря на то, что распространенность синдрома диабетической стопы среди больных СД составляет в среднем 4–10%, на его долю приходится 40–60% всех ампутаций нижних конечностей нетравматического характера. Так, в России ежегодно производится 12 тыс. высоких ампутаций в связи с диабетической гангреной.
Клинические стадии
Клиническая картина ДПН зависит от стадии заболевания. Так, на субклинической стадии отсутствуют жалобы больного, нет изменений при проведении простых клинических исследований. В основном диагноз ставится на основании данных, полученных при электромиографии (определяется уменьшение скорости распространения возбуждения по нервам). На начальных стадиях заболевания доминируют симптомы раздражения чувствительных волокон: дизестезии, парестезии, гипестезии, чувство «жжения» стоп (burning feet), недомогание типа «беспокойных ног» (restless legs), боли в конечностях различной степени выраженности (нередко усиливаются в ночное время, вызывая нарушение сна, часто сочетаются с возникновением болезненных тонических судорог в икроножных мышцах (crampi), постепенно нарастающие нарушения вибрационной, температурной, болевой и тактильной чувствительности). Это так называемые «позитивные симптомы», свидетельствующие о начальной стадии ДПН и возможности оказания эффективной помощи пациентам. По данным большинства авторов, при ДПН в 18–20% случаев встречается нейропатическая боль.
Вторая стадия ДПН характеризуется преобладанием симптомов выпадения различных видов чувствительности. При этом количество жалоб, активно предъявляемых пациентом, парадоксально снижается. Больше всего таких больных беспокоит чувство онемения, наиболее сильно выраженного в дистальных отделах конечностей (синдром «ватных ног»). При прогрессивной потере функций периферических нервных волокон развивается слабость мышц стопы (парезы стоп выявляются в 2 4% случаев) – «негативные симптомы». Для третьей стадии заболевания характерны осложнения (в первую очередь развитие синдрома диабетической стопы) [7].
Исследования
Для исследования ДПН используют следующие методики:
оценка тактильной чувствительности: при помощи 10 г (5,07 Semmes-Weinstein) монофиламента;
оценка порога болевой чувствительности: с помощью неврологической ручки (Neuropen) или зубчатого колеса (Pin-wheel);
оценка температурной чувствительности: при помощи специального прибора – термического наконечника (Thip-term);
оценка порога вибрационной чувствительности (с помощью градуированного неврологического камертона (tuning fork), вибрирующего с частотой 128 Гц, или биотезиометра).
Медикаментозная терапия
Лечение диабетической нейропатии предусматривает воздействия, направленные на основное заболевание (сахароснижающие препараты) и нормализацию метаболических процессов (антиоксиданты). Однако при лечении ДПН важное место также занимает активация невральной регенерации (реиннервации) и лечение болевого синдрома. При этом большая роль в лечении отводится нейротропным витаминам группы В, которые обладают полимодальным действием. Так, тиамин активирует углеводный обмен, улучшает проведение нервного импульса, обладает антиоксидантным действием. Пиридоксин активирует белковый обмен, участвует в биосинтезе нейромедиаторов, обеспечивает процессы торможения в центральной нервной системе. Цианокобаламин необходим для синтеза миелина, снижает болевые ощущения, связанные с поражением периферической нервной системы.
КомплигамВ
В настоящее время в качестве комбинированного препарата, содержащего витамины группы В, широко применяют КомплигамВ. Одна ампула (2 мл) препарата содержит в качестве активного вещества: тиамина гидрохлорид 100 мг, пиридоксина гидрохлорид 100 мг, цианокобаламина 1 мг в сочетании с 20 мг лидокаина гидрохлорид. По данным А.Б.Данилова (2010 г.), применение КомплигамаВ при лечении нейропатической боли достоверно приводит к уменьшению болевого синдрома.
Эффективность лечения ДПН значительно повышается при сочетании КомплигамаВ с ипидакрином [8]. Именно такая комбинированная терапия в наибольшей степени способствует восстановлению проведения нервных импульсов по пораженным нервам. Лечение целесообразно начинать с внутримышечного введения 2 мл КомплигамаВ и 1 мл 0,5% раствора ипидакрина ежедневно в течение 10 дней с переходом в дальнейшем на более редкие инъекции КомплигамаВ (2–3 раза в неделю) в сочетании с приемом ипидакрина в форме таблеток в суточной дозе 60 мг на протяжении 3 нед. В течение года необходимо проведение не менее 3 курсов комбинированной терапии.
Таким образом, поражение нервной системы является ведущей причиной снижения качества жизни больных СД. Включение препарата КомплигамВ в комплексное лечение ДПН является перспективным в плане снижения риска развития тяжелых осложнений со стороны нервной системы.
Литература
1. Балаболкин М.И., Чернышова Т.Е. Диабетическая нейропатия. Учебное пособие. М., 2003.
2. Редькин Ю.А., Богомолов В.В. Диабетическая нейропатия: диагностика, лечение, профилактика. Качество жизни. Медицина. 2003; 1: 42–7.
3. Дривотинов Б.В., Клебанов М.З. Поражения нервной системы при эндокринных болезнях. Минск, 1989.
4. Шубина А.Т., Карпов Ю.А. Возможности предотвращения сердечно-сосудистых осложнений у больных сахарным диабетом 2-го типа. Рус. мед. журн. 2003; 19: 1097–101.
6. Маркин С.П. Восстановительное лечение больных, перенесших инсульт. М., 2009.
7. Маркин С.П. Восстановительное лечение больных с заболеваниями нервной системы. М., 2010.
8. Строков И.А., Баринов А.Н., новосадова М.В. Лечение диабетической полинейропатии. Рус. мед. журн. 2001; 7–8: 314–7.
9. Маркин С.П. Поражение нервной системы при сахарном диабете. Методическое пособие. М., 2008.
Клиника
Когнитивные нарушения
Ведущим клиническим синдромом дисциркуляторной энцефалопатии являются когнитивные нарушения, на основании которых определяется стадия (степень тяжести) заболевания. Не существует нейропсихологических нарушений, патогномоничных для дисциркуляторной энцефалопатии. Функциональные возможности пациентов определяются больше общим состоянием пациента и подвержены колебаниями в течение времени. Н. И. Пироговым описана метеозависимость пациентов с травматическими органическими поражениями головного мозга (метеопатический симптом Пирогова). Влияние внешних и внутренних неблагоприятных факторов на сосудистых пациентов сходно с классическим описанием. Выделяется три стадии ДЭП.
I стадия (лёгкая)
Повышенная утомляемость от умственной работы, умеренное снижение оперативной памяти и объема восприятия. Преобладают субъективные симптомы (головная боль, головокружение, шум в голове, повышенная утомляемость, снижение внимания, неустойчивость при ходьбе, раздражительность, нарушение сна). При осмотре можно отметить лишь легкие псевдобульбарные проявления, оживление сухожильных рефлексов, анизорефлексию, снижение постуральной устойчивости, замедление ходьбы. При нейропсихологическом исследовании выявляются умеренные когнитивные нарушения лобно-подкоркового характера (нарушения памяти, внимания, познавательной активности) или неврозоподобные расстройства, главным образом астенического типа. У некоторых больных наблюдается снижение работоспособности.
В отечественной практике выделяются лёгкие когнитивные нарушения. Часть пациентов предъявляют когнитивные жалобы, при этом, если выполнение задания не предполагает учёта времени, пациенты справляются с ним. Нарушения памяти и внимания не оказывают влияния на способность пациентов ориентироваться в пространстве и времени. Профессиональная и бытовая деятельность не страдают.
Более лёгкой формой являются субклинические когнитивные нарушения (также обозначаются, как субъективные, латентные), когда их признаки ограничиваются жалобами пациентов, но не подтверждаются результатами тестирования. Важным замечанием является возможность связи жалоб на снижение памяти с депрессивным расстройством. Степень сосудистого поражения головного мозга на первой стадии ДЭ не предполагает наличия очаговых неврологических нарушений, но допускает присутствие рассеянной микроочаговой симптоматики.
II стадия (умеренная)
Формирование клинических синдромов, существенно снижающих функциональные возможности больного: когнитивных нарушений, связанных с дисфункцией лобных долей и выражающихся в снижении памяти, замедлении психических процессов, нарушении внимания, мышления, способности планировать и контролировать свои действия, выраженных вестибуломозжечковых расстройств, псевдобульбарного синдрома, постуральной неустойчивости и нарушения ходьбы. В клинической картине выявляется так называемый синдром умеренных когнитивных расстройств (УКР). Первоначально термин (mild cognitive impairment) имел отношение к нарушениям памяти и использовался для обозначения состояния, предшествующего развитию болезни Альцгеймера (БА). В настоящее время в зарубежной литературе существует термин для обозначения умеренных когнитивных нарушений, связанных с цереброваскулярным заболеванием – ‘vascular cognitive impairment, no dementia’ (VCIND) (УКР – промежуточное состояние между нормальным когнитивным статусом и деменцией, не сопровождающееся нарушениями повседневной активности). По результатам мета-анализа нескольких исследований распространённость когнитивных нарушений у лиц старше 70 лет оценивается приблизительно в 20%. [1].
УКР неоднородны по клиническим проявлениям, этиологии и прогнозу. На основании этиологии, выделяют как минимум три основных варианта цереброваскулярного УКР (О. С. Левин, 2010):
- Постинсультное (выявляется примерно у половины пациентов, перенесших ишемический инсульт).
- Связанное с патологией мелких мозговых сосудов.
- Возникающее на фоне стенозирующего атеросклероза магистральных артерий головного мозга.
На основании нейропсихологического профиля выделяется несколько вариантов умеренного когнитивного расстройства (R. C. Petersen (2001,2004)):
- Амнестический тип с характерным дефектом эпизодической памяти, связанным с нарушением запоминания (в том числе опосредованного) и узнавания (мнестическим синдромом «гиппокампального типа»).
- Дизрегулярторный (лобный) тип, характеризующийся преобладанием дисфункции лобных долей, которая может быть связана с первичной патологией лобной коры или является вторичной по отношению к патологии глубинных структур (подкорково-лобный синдром); при этом типе возможно вторичное снижение памяти с дефектом воспроизведения, но сохранным узнаванием и опосредованным воспоминанием; характерно также снижение речевой активности (особенно уменьшение числа фонетически опосредованных ассоциаций). Этот вариант наиболее часто встречается хронических цереброваскулярных заболеваниях. Сходные нарушения отмечаются у пациентов с депрессией и другими аффективными нарушениями, черепно-мозговой травмой, на ранней стадии алкогольной энцефалопатии, при нейродегенеративных заболеваниях.
- Комбинированный (мультифункциональный) тип, характеризующийся сочетанием амнестического синдрома гиппокампального типа (с нарушением опосредованного запоминания и узнавания) с расстройством регуляторных и других когнитивных функций.
- УКР с преобладанием нарушением какой-либо иной когнитивной сферы, например зрительно-пространственных или речевых (дисфатических) нарушений.
Первый вариант УКР связан с развитием БА и рассматривается как ранняя, «продромальная» фаза заболевания, последующие два не обладают нозологической специфичностью, последний — при дальнейшем развитии может траснформироваться в деменцию с тельцами Леви (ДТЛ).
Сочетание наиболее часто встречающихся нейродегенеративных заболеваний (БА и болезни Паркинсона) с распространёнными поражениями белого вещества головного мозга делает затруднительным нозологический диагноз у пациентов с УКР.
МР-картина головного мозга у пациентов с сочетанием нейродегенеративных заболеваний и хронических сосудистых изменений головного мозга не отличается от таковых у пациентов, имеющих только сосудистое поражение головного мозга. Данные визуализации не помогают в установлении причины развития УКР. Для проведения дифференциального диагноза необходимы дополнительные данные (анамнез, динамическое наблюдение за пациентом).
Синдром умеренного когнитивного расстройства необходимо дифференцировать с другими состояниями:
- психическими заболеваниями (при депрессии у пациентов могут преобладать когнитивные жалобы, а не жалобы на нарушения настроения; тестирование также может выявлять когнитивное снижение, которое исчезает на фоне успешного лечения депрессии),
- нежелательными явлениями при приёме препаратов (антихолинергических, антигистаминных);
- нарушениями сна;
- (синдром обструктивного апноэ сна, другие диссомнии);
Ввиду «перекрытия» клинической картины УКР, вызванной различными этиологическими факторами, выявление у пациента умеренного когнитивного расстройства требует подробной клинической оценки, с целью выявления корригируемых причин состояния. Прогностическая значимость выявления синдрома УКР однозначно не определена.
В качестве факторов риска трансформации УКР в деменцию выделяются:
- атеросклероз церебральных артерий,
- гиперхолестеринемия,
- сахарный диабет,
- артериальная гипертензия,
- курение,
- метаболический синдром.
К развитию деменции приводит совокупность нескольких, часто связанных между собой, патологических процессов, включая атрофию, дегенеративные и воспалительные изменения, инсульт и генетические факторы. С учётом большого значения для развития деменции потенциально обратимых сосудистых механизмов [7], предполагается, что коррекция факторов риска у лиц в возрасте 65 лет и старше приводит в дальнейшем к снижению распространённости деменции на 50%[6].
Таким образом, при выявлении у пациентов, когнитивных нарушений, не достигающих уровня деменции в сочетании с клиническими и/или визуализационными признаками цереброваскулярного заболевания необходимо проведение полноценного обследования. Требуется выявление корригируемых факторов риска сердечно-сосудистых заболеваний (артериальная гипертензия, сахарный диабет и метаболический синдром, курение). По результатам проводится модификация образа жизни и внимательный подбор терапии, контролирующей артериальное давление, холестериновый и углеводный обмен. В настоящее время не выявлено методов лечения, улучшающих исходы УКР. На основании результатов исследований, проведённых к настоящему времени, назначение антихолинэстеразных препаратов на стадии УКР не рекомендуется (уровень доказательности 1В) [10]
III стадия (тяжёлая)
Выраженные когнитивные нарушения(эвфемизм, который используется отечественными неврологами для обозначения деменции). Когнитивные нарушения достигают степени умеренной или тяжелой деменции и сопровождаются грубыми аффективными и поведенческими нарушениями (грубым снижением критики, апатико-абулическим синдромом, расторможенностью, вспыльчивостью). Развиваются грубые нарушения ходьбы и постурального равновесия с частыми падениями, выраженные мозжечковые расстройства, тяжелый паркинсонизм, недержание мочи.
Как правило, отмечается сочетание нескольких основных синдромов. Нарушается социальная адаптация, больные постепенно утрачивают способность обслуживать себя и нуждаются в постороннем уходе. При деменции отмечаются когнитивные нарушения в нескольких сферах с затруднениями в профессиональной деятельности и повседневной активности. Пациенты с лёгкой деменцией могут сохранять навыки самообслуживания, затрудняясь только при выполнении сложных задач, особенно, если требуется обрести новые навыки. В отличии от деменции при болезни Альцгеймера (БА), для определения сосудистой деменции (СД) не было создано единых критериев диагностики. Существует несколько подходов, которые плохо валидизированы, и не согласуются между собой.
СД является вторым по распространённости типом деменции после БА. Данные о частоте встречаемости отличаются ввиду отсутствия общепринятых критериев диагностики состояния, доля таких пациентов среди больных с деменцией составляет 10–33% [35]. У лиц старше 65 лет данное состояние встречается с частотой 1,2 — 4,2% [16]. Деменция, связанная с ДЭП составляет, по-видимому, до 70–80% случаев СД, остальные случаи связаны с постинсультной деменцией. Особенностями этого вида деменции являются:
- постепенное развитие, часто со ступенчатым прогрессированием,
- раннее нарушение регуляторных функций,
- развитие аффективных нарушений (депрессии и апатии) с относительной сохранностью личности (возможно обострение личностных черт),
- сочетание с двигательными нарушениями — подкорково-лобной дисбазией, постуральной неустойчивостью, реже с паркинсонизмом;
- развитие псевдобульбарного синдрома с дизартрией и рефлексами орального автоматизма,
- признаки пирамидной недостаточности (патологические стопные и кистевые рефлексы, патологическое расширение рефлексогенных зон на конечностях)
Двигательные нарушения
Хотя пирамидные знаки (оживление сухожильных рефлексов, анизорефлексия) встречаются у больных ДЭП довольно часто, если у больного отсутствуют эпизоды инсультов с острым развитием пирамидных нарушений, парезы и спастичность наблюдаются сравнительно редко. Постепенное развитие спастического пареза у больного с предполагаемой ДЭП требует исключения иного заболевания (спондилогенная шейная миелопатия, опухоли и т. д. ). Тем не менее подострое (в течение нескольких недель) развитие гемипареза может быть связано с развитием стеноза или тромбоза внутренней сонной артерии (так называемый медленный инсульт). Мозжечковые и экстрапирамидные нарушения встречаются в структуре клинических проявлений ДЭП нечасто. Гораздо чаще двигательные возможности пациента ограничиваются нарушениями ходьбы и равновесия, которые могут иметь комбинированный генез. Они бывают следствием поражения пирамидных, экстрапирамидных, мозжечковых систем, но нередко носят первичный характер и отражают нарушения функционирования сложных систем двигательного контроля, замыкающихся через лобную кору и включающих ее связи с подкорковыми и стволовыми структурами. Первичные нарушения ходьбы и равновесия, в зависимости от локализации и обширности поражения, могут быть представлены подкорковой (лобно-подкорковой) дисбазией, подкорковой или лобной астазией. Именно сложные нарушения двигательного контроля наряду с псевдобульбарным синдромом и тазовыми нарушениями лучше всего коррелируют с выраженностью когнитивных нарушений [2].
Оценка степени инвалидности при рассеянном склерозе с помощью шкалы ЕДСС
Рассеянный склероз является хроническим заболеванием, вызванным поражением миелиновой оболочки головного и спинного мозга. Это неврологическое заболевание, возникающее в возрасте от 15 до 50 лет, которое в сжатые сроки приводит к инвалидности человека. Популярная среди врачей шкала EDSS при рассеянном склерозе в медицинской практике используется для оценки степени инвалидности пациента.
Методика оценки функций организма
Шкала EDSS была предложена американским эпидемиологом Джоном Куртцке в 1983 году как методика, позволяющая оценить степень инвалидности человека, основываясь на функциональности семи основных систем организма.
- зрительная функция;
- мыслительная функция;
- мозжечковый отдел;
- пирамидная система;
- тазовые органы;
- сенсорные отделы мозга;
- системы ствола головного мозга.
На основе осмотра пациента, каждой из приведенных выше систем, устанавливается конкретная оценка, далее с помощью калькулятора edss врач присваивает больному определенный балл. Условно шкала едсс разделяет исследуемых на две группы: баллы по EDSS с 1 по 4.5 присваиваются больным с полностью сохраненной подвижностью, а с 5 по 9.5 индивидам, подвижность которых частично или полностью нарушена.
Трактовка результатов оценки
На основе полученного значения результаты интерпретируются в соответствии с таблицей:
| 0 | неврологические патологии не выявлены, пациент считается здоровым; |
| 1.0 | инвалидность не обнаружена, но присутствуют отклонения в одной из систем; |
| 1.5 | инвалидность пациента не обнаружена, однако присутствуют дефекты в нескольких функциональных системах; |
| 2.0 | присутствует незначительная инвалидизация, которая не приносит дискомфорта пациенту; |
| 2.5 | наблюдается «мягкая» инвалидизация в одной системе либо присутствуют минимальные отклонения в нескольких системах головного или спинного мозга больного; |
| 3.0 | наблюдается умеренная инвалидизация в одной или незначительная инвалидизация в 3-4 системах. Индивид не нуждается в стационарном лечении; |
| 3.5 | проявление симптомов продолжает нарастать, пациент не нуждается в стационарном лечении; |
| 4.0 | больной получает лечение, ведет обычную активную жизнь, способен самостоятельно пройти более 500 метров; |
| 4.5 | пациент получает лечение, ведет обычную жизнь, способен пройти самостоятельно до 300 метров; |
| 5.0 | качество жизни человека заметно снижается, индивид способен преодолеть до 200 метров, необходимо уменьшение продолжительности трудового дня; |
| 6.0 | для перемещения на расстояние до 100 метров пациенту необходимо использовать палку; |
| 6.5 | больному необходимо использовать ходунки или костыли для преодоления дистанции в 20 метров; |
| 7.0 | пациент практически не в состоянии передвигаться на короткие расстояния до 7 метров; |
| 7.5 | больной нуждается в использовании коляски для инвалида; |
| 8.0 | большую часть дня больной проводит в кровати, передвижение практически невозможно, пациент способен на самоуход; |
| 8.5 | в течение дня больной находится в постели и теряет способность к самоуходу; |
| 9.0 | пациент пребывает исключительно в постели, сохранена способность коммуникации; |
| 9.5 | человек теряет способность общаться; |
| 10.0 | смерть в связи с развитием рассеянного склероза. |
Присваивание степени инвалидности

Согласно протоколу, в зависимости от результата проверки, больному рассеянным склерозом присваивается категория инвалидности. III группа инвалидности присваивается при показателе от 3 до 4.5, показатели от 5 до 7 соответствуют II группе инвалидности, а к I группе инвалидности относят больных с показателем EDSS от 7.5 до 9.5 баллов.
Несмотря на то что данная методика оценки широко применяется в неврологии, ряд экспертов подвергают её критике. Критики считают, что методика исследования больного не является полноценной и чрезмерное внимание уделяется способности человека передвигаться самостоятельно. При этом методика игнорирует когнитивную дисфункцию, которая в первую очередь снижает качество жизни человека.
Обратите внимание, что данная шкала должна применяться исключительно врачами-неврологами и не подходит для самостоятельной установки диагноза.