Фактор свертывания крови VIII + Фактор Виллебранда (Coagulation Factor VIII + Willebrand factor)
Содержание
Русское название
Латинское название веществ Фактор свертывания крови VIII + Фактор Виллебранда
Фармакологическая группа веществ Фактор свертывания крови VIII + Фактор Виллебранда
Типовая клинико-фармакологическая статья 1
Характеристика. Эффективность фактора свертывания VIII определяется на основании Международного стандарта для концентрата (ФVIII:С), эффективность фактора Виллебранда определяется на основании определения эффективности ристоцетинового кофактора (ФВ:РК), на основании Международного стандарта для концентрата в соответствии с Европейской Фармакопеей. Специфическая активность препарата не менее 60 ME ФVIII:С/мг и не менее 53 ME ФВ:РК/мг общего белка. Количество единиц фактора свертывания крови VIII выражается в MЕ, соответствующих стандартам ВОЗ для этих препаратов. Активность выражается или в процентном соотношении (относительно нормального содержания фактора в плазме), или в Международных Единицах (относительно Международного Стандарта для фактора свертывания VIII в плазме). 1 MЕ фактора свертывания крови VIII эквивалентна количеству фактора свертывания VIII в 1 мл нормальной человеческой плазмы.
Фармдействие. Фактор свертывания крови VШ связывается с фактором Виллебранда; активированный фактор VШ является кофактором к активированному фактору IХ, ускоряя переход фактора свертывания X в активную форму; активированный фактор Х активирует переход протромбина в тромбин, тромбин, в свою очередь активирует переход фибриногена в фибрин, с последующим формированием тромба. Препарат содержит фактор Виллебранда, который является нормальным компонентом человеческой плазмы и действует так же, как эндогенный, и корригирует нарушения гемостаза у пациентов с болезнью Виллебранда: восстанавливает адгезию тромбоцитов к сосудистому субэндотелию в месте повреждения сосуда (прикрепляется к сосудистому субэндотелию и к мембране тромбоцитов, обеспечивает первичный гемостаз, уменьшает время свертывания, при этом эффект проявляется немедленно и зависит от степени полимеризации белка); нормализует сопутствующий дефицит фактора VIII (при в/в введении связывает эндогенный фактор VШ и стабилизирует его, замедляя его быструю деградацию), восстанавливает уровень фактора VIII:C до нормального. Заместительная терапия препаратом у больных гемофилией А повышает содержание фактора свертывания крови VШ, оказывая временную коррекцию дефицита фактора и снижая риск кровотечений. Кроме того, фактор Виллебранда способствует адгезии тромбоцитов в зоне повреждения сосудов и играет значительную роль в процессе агрегации тромбоцитов.
Фармакокинетика. Болезнь Виллебранда 3 типа: среднее восстановление ФВ:РК и ФВ:Аг — 68–99% соответственно, что соответствует среднему повышению концентрации в плазме на 1,5 и 2,1% на замещенную МЕ/кг массы тела. T1/2 ФВ:РК — 17,5 ч, клиренс — 3,9 мл/ч/кг. Гемофилия А: концентрация фактора VIII:C—80–120% от предполагаемого. T1/2 VIII:C — 14,8 ч, что соответствует биологическому T1/2 , клиренс — 2,9 мл/ч/кг.
Показания. Лечение и профилактика кровотечений у пациентов с болезнью Виллебранда (при количественном и/или качественном дефиците фактора Виллебранда), врожденной гемофилией А или приобретенным дефицитом фактора свертывания крови VIII.
Противопоказания. Гиперчувствительность, возраст до 6 лет (эффективность и безопасность не установлены).
С осторожностью. Беременность, период лактации.
Дозирование. В/в , после растворения прилагаемым растворителем; полученный раствор содержит 90 ME фактора свертывания крови VIII и 80 ME фактора Виллебранда в 1 мл.
Болезнь Виллебранда: доза и продолжительность заместительной терапии зависит от клинического состояния пациента, типа и тяжести кровотечения, уровня ФVIII:С и ФВ:РК.
Соотношение между ФVIII:С и ФВ:РК 1:1, в среднем 1 МЕ/кг. ФVIII:С и ФВ:РК повышают плазменный уровень на 1,5–2% от нормальной активности соответствующего белка. Обычная доза препарата 20–50 МЕ/кг, что повышает уровень ФVIII:С и ФВ:РК до 30–100%. Начальная доза может быть повышена до 50–80 МЕ/кг, особенно у пациентов с болезнью Виллебранда 3 типа, с желудочно-кишечными кровотечениями.
Для профилактики кровотечения необходимо начинать введение препарата за 30 мин до начала хирургического вмешательства. В случае планового хирургического вмешательства препарат вводят за 12–24 ч и за 1 час до начала хирургического вмешательства, при этом ожидаемая концентрация ФВ:РК 60 МЕ/дл и более (60% и более) и ФVIII:С 50 МЕ/дл и более (50% и более). Доза вводится каждые 12–24 ч. Продолжительное лечение может вызвать избыточное повышение уровня ФVIII:С. После 24–48 ч лечения, во избежание избыточного повышения уровня ФVIII:C необходимо уменьшить дозу, или увеличить интервал между введениями.
Гемофилия А: 1 ME фактора свертывания VIII:С/кг повышает фактор в плазме на 1,5–2% от нормального содержания. Определение необходимой дозы: масса тела (кг)×желаемое повышение уровня фактора свертывания VIII (%)×0,5 МЕ/кг.
В случае описываемых ниже случаев кровотечений, уровень активности ФVIII:C не должен опускаться ниже исходного уровня в плазме (% от нормального содержания) в соответствующий период времени.
Умеренные кровотечения (ранние гемартрозы, в/м кровотечения, носовые кровотечения, кровотечения ротовой полости и иные малые повреждения) — необходимая концентрация фактора свертывания VIII — 20–40 МЕ/дл (20–40%), введение повторяют каждые 12–24 ч, по крайней мере, в течение 1 суток, до стихания боли или заживления источника кровотечения.
Более обширные кровотечения (в/м кровотечения или гематомы) — необходимая концентрация фактора свертывания VIII — 30–60 МЕ/дл (30–60%) каждые 12–24 ч в течение 3–4 дней, до стихания боли и восстановления трудоспособности.
Опасные для жизни кровотечения (внутричерепное, интраперитонеальное, в области шеи, при тупых травмах, без видимого источника кровотечения) — необходимая концентрация фактора свертывания VIII — 60–100 МЕ/дл (60–100%) каждые 8–24 ч, до полного исчезновения угрозы.
Малые хирургические вмешательства ( в т.ч. удаление зубов) — необходимая концентрация фактора свертывания VIII — 30–60 МЕ/дл (30–60%) каждые 24 ч, по крайней мере, в течение 1 суток, до заживления.
Большие хирургические вмешательства — необходимая уровень фактора свертывания VIII (до и после операции) — 80–100 МЕ/дл (80–100%) каждые 8–24 ч, до адекватного заживления раны, затем как минимум 7 дней для поддержания активности фактора свертывания VIII на уровне 30–60%.
Для продолжительной профилактики кровотечений у больных с тяжелой формой гемофилии А, необходимо вводить 20–40 МЕ/кг каждые 2–3 дня. В некоторых случаях, особенно у молодых пациентов, может возникнуть необходимость уменьшения интервала между введениями или увеличение дозы.
При отсутствии эффекта от адекватной дозы или при невозможности достичь желаемой концентрации фактора свертывания VIII в плазме при адекватном его введении, необходимо провести тест Бетесда на наличие ингибиторных антител к фактору свертывания VIII. У пациентов с высоким уровнем ингибиторов лечение фактором свертывания VIII может быть неэффективным, и потребовать проведения других лечебных мероприятий.
Побочное действие. Аллергические реакции (крапивница, кожная сыпь, озноб, ощущение сдавления в грудной клетке, одышка, снижение АД , редко — анафилактический шок), жжение в месте введения, гипертермия, «приливы», головная боль, сонливость, апатия, тошнота, рвота, беспокойство. Развитие ингибиторных антител к фактору Виллебранда — при болезни Виллебранда, при гемофилии А — к фактору свертывания крови VIII (как правило, IgG), что приводит к неадекватному клиническому ответу на введение препарата; ингибиторные антитела могут вызывать преципитацию и способствовать развитию анафилактических реакций.
У пациентов, получающих препараты фактора Виллебранда, содержащие фактор свертывания VIII, длительное повышение плазменного уровня фактор VIII:С повышает риск развития тромбоза (необходим контроль пациентов из группы риска).
У больных гемофилией А возможно развитие ингибиторных антител, при этом отмечается неадекватный клинический ответ на введение препарата.
Взаимодействие. Не следует смешивать с др. ЛС или вводить одновременно, используя один и тот же инфузионный набор.
Особые указания. При введении препарата необходимо тщательно контролировать состояние пациентов. Ранними признаками реакции гиперчувствительности являются крапивница, генерализованная сыпь, чувство сдавления в грудной клетке, одышка, снижение АД и анафилаксия. В случае возникновения этих симптомов следует немедленно прекратить введение препарата. При развитии анафилактических реакций пациентов необходимо обследовать на наличие ингибиторных антител.
При применении ЛС , полученных из человеческой крови или плазмы, возможность передачи инфекционных агентов не может быть полностью исключена, поэтому рекомендуется профилактическая вакцинация против гепатитов А и В.
Продолжительное лечение пациентов с болезнью Виллебранда препаратом, содержащим фактор Виллебранда и фактор свертывания крови VIII может вызвать избыточное повышение фактора свертывания VIII:С, что повышает риск тромбообразования (необходим контроль концентрации фактора свертывания VIII:С).
Риск развития ингибиторных антител при гемофилии А достигает максимума в течение первых 20 дней после назначения, реже после первых 100 дней применения препарата. Возможность использования препарата при наличии ингибиторных антител к фактору свертывания VIII не установлена.
Для введения препарата следует применять только предоставляемый в комплекте набор для растворения и в/в введения. Другие приспособления способны адсорбировать факторы свертывания крови на своей внутренней поверхности, приводя к снижению эффективности лечения.
Если для согревания растворителя используется водяная баня, ее температура не должна превышать 37 °C. Допустимо введение только прозрачного или слегка опалесцирующего раствора, без осадка.
[1] Государственный реестр лекарственных средств. Официальное издание: в 2 т.- М.: Медицинский совет, 2009. – Т.2, ч.1 – 568 с.; ч.2 – 560 с.
Фактор свертывания крови VIII

Фактор VIII или антигемофильный глобулин — лабораторный диагностический маркер гемофилии А и риска тромбозов.
Синонимы: FVIII, F8, антигемофильный фактор A, антигемофильный глобулин, тромбоцитарный кофактор I, FVIII:C (коагуляционная активность фактора VIII)
Антигемофильный глобулин или фактор свертывания крови VIII — это
— плазматический гликопротеин и, одновременно, фактор свертывания крови.
Синтезируется преимущественно в печени, меньше в селезенке, поджелудочной железе, почках и мышечной ткани. Состоит из 2-х цепей (легкой и тяжелой), ионы кальция и меди стабилизируют его структуру.
Относится к не ферментативным коагуляционным факторам (как и фактор V — проакцелерин). Одновременно белок острой фазы воспаления, т.е. его концентрация растет при любом воспалительном процессе (вместе с С-реактивным белком, СОЭ).
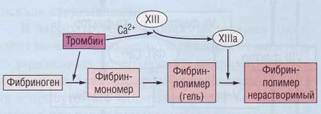
Антигемофильный глобулин легко разрушают ферменты плазмы, поэтому в кровяном русле циркулирует в связанной форме с фактором фон Виллебранда в соотношении 1:1. При контакте с негативно заряженной поверхностью фосфолипидов (при нарушении целостности эндотелия) фактор VIII высвобождается от переносчика. Под влиянием тромбина (фактор IIa) или фактора Xa свободный фактор VIII переходит в активную форму — VIIIа и формирует комплекс (внутренняя теназа) с фактором IXa, мембранными фосфолипидами и ионами кальция Ca 2+ . Фактор VIII в данной коалиции выполняет функции кофактора и в 10 000 раз ускоряет активацию фактора X (X→ Xa).
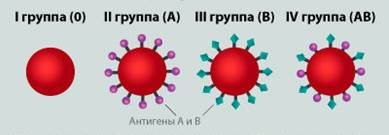
Группа крови на 30% определяет активность фактора VIII: у I (αβ) группы крови — наименьший, постепенно повышается у II (Аβ) и III (Вα), достигая максимума у IV (АВ) группы.

Ген антигемофильного фактора расположен на половой X-хромосоме (Xq28). У женщин две половые X-хромосомы и если ген фактора VIII на одной из них не «работает», то другая полностью компенсирует развившийся дефицит. В таком случае сама женщина будет без каких-либо симптомов или повышенной кровоточивости, но может передать «больную» хромосому своим детям.
У мужчин половых хромосом также две, одна Y и одна X. Если Х-хромосома будет нести поврежденный ген антигемофильного глобулина, то в таком случае говорят о заболевании гемофилией.
Гемофилия А
Гемофилия А – наследственное заболевание системы свертывания крови, в результате врожденного недостатка фактора VIII. Ген гемофилии А расположен на Х-хромосоме. Болеют гемофилией А мужчины, заболевание у женщин встречается крайне редко (фатально при наступлении половой зрелости).
У 75% гемофиликов есть родственники с гемофилией, но у 25% — нет, что может быть связано возникновением новой мутации или с «перескакиванием» заболевания через поколение, поскольку передают заболевание женщины, которые сами остаются здоровыми.
Симптомы
- гемартрозы — спонтанные кровоизлияния в суставы — коленные, локтевые, голеностопные, что ведет к реактивному воспалению их внутренней выстелки, разрушению хряща, а затем и кости; хрящ «заростает» соединительной тканью и становится неподвижным (анкилоз)
- суставы постоянно болезненны, отекшие
- атрофия мышц, мышечные контрактуры, отклонения суставной оси
- кровотечение может быть самопроизвольным, без какого либо провоцирующего фактора в любой орган — желудочно-кишечний тракт, почки, кровотечения из носа
- наиболее опасны кровоизлияния в головной и спинной мозг, в забрюшинное и заглоточное пространство
- анемия в результате постоянных кровепотерь
- при легкой форме гемофилии А кровотечения появляются только после травм или операций

Женщины-носительницы гена гемофилии также могут иметь повышенную кровоточивость, если активность фактора VIII менее 40-50%. При гемофилии категорически запрещены внутримышечные инъекции.
Уровень фактора VIII в крови – прямой диагностический показатель гемофилии. Другие параметры свертывания крови могут оставаться в пределах нормы. Симптомы гемофилии А и В полностью идентичны, поэтому для постановки диагноза одновременно проводят анализ фактора VIII и IX.
Степень тяжести гемофилии в зависимости от активности фактора VIII:
- тяжелая – меньше 1%
- средне тяжелая – 1-5%
- легкая 5-40%
Для пренатальной диагностики гемофилии проводится у женщины носительницы биопсия ворсин хориона (11-14 неделя беременности) или амниоцентез (15-18 неделя беременности).
Показания
- кровоизлияние в сустав или любой другой орган без явной причины (например, травмы)
- быстрое образования обширных синяков у ребенка
- выявление гемофилии у кровного родственника
- сильное послеоперационное кровотечение, которое не поддается стандартному лечению
- через 6 месяцев после эпизода тромбоза глубоких вен нижних конечностей или тромбоэмболии легочной артерии
- диагностированное ретроперитонеальное или ретрофарингеальное кровотечение
Норма
Существует два способа оценки антигемофильного фактора в крови.
- фактор VIII в МО/л, норма 0,6-1,5 МО/л — оценивает количество глобулина
- фактор VIII в % — покажет именно активность белка, что более важно в диагностике
- 0-1 день — 60-140
- 1-28 день — 60-125
- 2-12 месяцев — 55-100
- 1-6 лет — 75-150
— дети старше 6 лет и взрослые — 50-150
Дополнительные исследования
- общий анализ крови
- биохимический анализ крови
- печеночные пробы — билирубин, АСТ, АЛТ, ГГТ, щелочная фосфазата
- почечные пробы — креатинин, мочевая кислота, мочевина
- общий анализ мочи – повышенная вероятность гематурии (крови в моче)
- анализы свертываемости крови — АЧТВ, МНО, D-димеры, антитромбин III, протеин C, протеин S, протромбиновое время, протромбиновый индекс, фибриноген
- волчаночный антикоагулянт
- фактор фон Виллебранда
- антифосфолипидные антитела
Что влияет на результат?
- снижает активность фактора VIII — взятие меньшего обьема крови или неправильный сбор крови (активируется процесс коагуляции и фактор VIII потребляется), повышенный гематокрит, позднее перемешивание образца, взятие пробы из канюли, I группа крови, дабигатран, ривароксабан
- повышает уровень антигемофильного фактора — несоблюдение соотношений между кровью а антикоагулянтом в пробирке, гемолизированная плазма, сниженный гематокрит, беременность, роды, физическая нагрузка перед взятием пробы, алкоголь, стресс, гормональные противозачаточные препараты, кортикостероиды, десмопресин
Расшифровка
Причины повышения
- острое воспаление — паратонзиллярный абсцесс, пневмония, синусит, фарингит
- хронические заболевания — туберкулез, болезнь Крона, язвенный колит, ревматоидный артрит
- тиреотоксикоз — повышение функции щитовидной железы
- внутрисосудистый гемолиз — гемолитическая анемия
- заболевания почек — острый гломерулонефрит, хронический гломерулонефрит, пиелонефрит, хроническая почечная недостаточность
- дисфункция эндотелия и ее причины/последствия — атеросклероз, инфаркт миокарда, инсульт, ожирение, сахарный диабет, дислипидемия
- заболевания печени — хронический вирусный гепатит, аутоиммунный гепатит, холангит
- хирургические вмешательства
- злокачественные новообразования
При повышении активности фактора VIII более чем 150% — растет риск тромбоза. В такой ситуации необходимо взвесить все за и против применения антикоагулянтов, ведь каждый шестой пациент с тромбозом уже имел повышенный антигемофильный глобулин.
Фактор VIII-тест
ФС-1 Цена набора – 1890 руб.

Набор реагентов для определения активности фактора VIII свертывания крови (Фактор VIII-тест) по ТУ 9398-020-05595541-2009
Предназначен для определения активности фактора VIII (ф. VIII) свертывания крови одностадийным клоттинговым методом в плазме крови пациентов с целью диагностики гемофилии А и тромбофилии, в свежезамороженной донорской плазме (СЗП), криопреципитате и препаратах фактора VIII с целью определения их качества.
Фактор VIII-тест предназначен для работы ручным методом, а также на автоматических и полуавтоматических коагулометрах, способных регистрировать образование сгустка в присутствии каолина.
Фактор VIII – это гликопротеид с молекулярной массой приблизительно 280000 дальтон, локализованный кроме плазмы в печени, селезенке и лимфоцитах. В плазме фактор VIII циркулирует в нековалентно связанном комплексе с фактором фон Виллебранда. Фактор VIII активируется тромбином и фактором Xa, и является кофактором фактора IХa в процессе активации фактора X в присутствии фосфолипидов и ионов кальция.
Дефицит фактора VIII вызывает гемофилию А. Гемофилия А – тяжелое наследственное заболевание, характеризуется спонтанными, нередко смертельными кровотечениями, кровоизлияниями в суставы, ведущими к ранней инвалидности. Уже при снижении дефицитного фактора до 30% (норма – 50-150%) заболевание проявляется в скрытой форме и обнаруживается после оперативных вмешательств в виде профузных кровотечений. Эти больные в течение всей жизни нуждаются в заместительной терапии препаратами плазмы.
Набор предназначен для измерения активности фактора VIII в плазме пациентов с гемофилией А, пациентов с ингибиторной формой гемофилии А, пациентов с тромбофилическими состояниями, обусловленными высоким уровнем активности фактора VIII, наблюдения за результатами лечения и для контрольного тестирования антигемофильных лекарственных препаратов (криопреципитат).
Принцип метода:
При добавлении к разведенной исследуемой плазме субстратной дефицитной плазмы происходит коррекция всех факторов свертывания кроме ф.VIII. Поэтому время свертывания в тесте АЧТВ смеси разведенной исследуемой и субстратной дефицитной по ф.VIII плазм зависит только от активности ф.VIII в исследуемой плазме. Активность ф.VIII определяют по калибровочному графику разведений плазмы-калибратора с установленной активностью ф.VIII.
Состав набора:
- Эрилид, лиофильно высушенный аналог кефалина – 1 флакон;
- Каолин, суспензия в 0,9%-ом растворе натрия хлористого (5 мл/фл.) -1 флакон;
- 0,025М раствор кальция хлористого (5 мл/фл.) – 1 флакон;
- Плазма субстратная VIII, лиофильно высушенная (1 мл/фл.) – 1 флакон;
- Плазма-калибратор лиофильно высушенная (1 мл/фл.) – 1 флакон;
- Буфер имидазоловый концентрированный (5 мл/фл.) – 1 флакон.
Один набор предназначен для проведения 20 анализов при расходе 0,05 мл реагента на один анализ.
Нормальные и патологические значения активности фактора VIII в плазме пациентов следует контролировать с помощью Плазмы контрольной, код КМ-2. Высокую активность фактора VIII в криопреципитате следует контролировать с помощью Патоплазмы VIII, код КМ-8/9.
Мультикалибратор, код КМ-16, может быть использован для построения калибровочного графика.
Интерпретация результатов:
Уровень активности фактора VIII в плазме в норме и патологии.
| Активность фактора VIII в % | Заболевание |
| Больше 200 | |
| От 50 до 200 | Норма |
| От 25 до 49 | Гемофилия А, скрытая форма |
| От 5 до 24 | Гемофилия А, легкая форма |
| От 1 до 5 | Гемофилия А средней тяжести |
| Меньше 1 | Гемофилия А, тяжелая форма |
За единицу активности принимается активность фактора VIII, содержащегося в пуле донорской плазмы, взятой не менее чем от 300 здоровых доноров мужчин. Активность фактора VIII выражается в международных единицах (МЕ) или в процентах, причем 1 МЕ/мл соответствует 100% активности.
Фактор свертывания VIII
Фармакологические свойства
Хроматографически очищенная лиофилизированная фракция плазмы крови человека, содержащая фактор VIII свертывания крови. Антигемофильный глобулин, восполняет дефицит фактора свертывания VIII, временно компенсирует коагуляционный дефект у больных гемофилией А. Находится в естественном сочетании с белком С фактора VIII, фактором Виллебранда. Включается в процессы свертывания крови, способствует переходу протромбина в тромбин и образованию фибринового сгустка. Сразу после введения повышает коагуляционный потенциал крови. Снижение активности антигемофильного фактора носит двухфазный характер: ранняя фаза быстрое снижение активности, характеризует время уравновешивания с внесосудистым пространством, вторая фаза медленная, отражает биологический период полураспада введенного антигемофильного фактора и составляет 914 ч. Специфическая активность (после добавления альбумина человека) 922 МЕ протеина. 1 МЕ (по определению стандарта фактора VIII свертывающей системы крови ВОЗ) приблизительно равна уровню антигемофильного фактора, присутствующего в 1 мл свежей донорской плазмы человека.
Время достижения максимальной концентрации в плазме крови после в/в введения от 10 мин до 2 ч. Период полувыведения 8,419,3 ч. Активность фактора свертывания VIII снижается постепенно на 15% в течение 12 ч. При гипертермии период полувыведения фактора свертывания VIII может уменьшаться.
Показания
Гемофилия А, болезнь Виллебранда (лечение и профилактика кровотечений, в том числе во время хирургических вмешательств); приобретенный дефицит фактора VIII, заболевания, сопровождающиеся образованием антител к фактору VIII.
Применение
В/в. Для профилактики спонтанного кровотечения или при легком кровотечении 10 МЕ/кг (содержание фактора VIII, необходимого для предупреждения спонтанного кровотечения 5% нормального уровня); при умеренном кровотечении и проведении небольшого по объему хирургического вмешательства (например экстракция зуба) 1525 МЕ/кг (содержание фактора VIII 3080% нормы) с последующей поддерживающей дозой 1015 МЕ/кг каждые 1224 ч в течение 3 сут или до получения достаточного клинического эффекта; при остром кровотечении, угрожающем жизни 4050 МЕ/кг (содержание фактора VIII 60100% нормы) с последующей поддерживающей дозой 2025 МЕ/кг каждые 824 ч; при обширных хирургических вмешательствах 4050 МЕ/кг за 1 ч до процедуры и 2025 МЕ/кг через 5 ч после первой дозы (то есть 80100% нормы до и после операции), затем повторяют каждые 824 ч до получения достаточного клинического эффекта. Для длительной профилактики кровотечений при тяжелой гемофилии А 1225 МЕ/ кг каждые 23 дня.
Криопреципитат применяют с учетом совместимости по АВ0-группам крови. Емкость с замороженным криопреципитатом помещают для оттаивания и полного растворения на водяную баню при температуре не выше 3537 °С и выдерживают не более 7 мин. Образующийся при этом прозрачный желтоватого цвета р-р, который не должен содержать хлопьев, применяют сразу после приготовления. Вводят в/в струйно с помощью шприца или системы для переливания с фильтром одноразового пользования. Доза зависит от исходного содержания фактора VIII в крови больного гемофилией, характера и локализации кровотечений, степени риска хирургического вмешательства, наличия в крови больного специфического ингибитора, способного нейтрализовать активность фактора VIII (выражается в единицах активности фактора VIII). Для обеспечения эффективного гемостаза при наиболее частых осложнениях гемофилии (гемартрозы, почечные, десневые и носовые кровотечения), а также удалении зубов содержание фактора VIII в плазме должно быть не ниже 20%; при межмышечных гематомах, желудочно-кишечных кровотечениях, переломах и других травмах не ниже 40%; при большинстве хирургических вмешательств не менее 70%. При введении фактора VIII из расчета 1 ЕД на 1 кг массы тела его содержание в крови увеличивается в среднем на 1%. Исходя из этого, количество доз, необходимое для повышения концентрации фактора VIII в крови до заданного уровня вычисляют по формуле: массу тела больного (в кг) умножить на необходимое содержание фактора VIII в крови больного и разделить на 200 (минимальное содержание фактора VIII в единицах активности в 1 дозе криопреципитата). После полной остановки кровотечения введение фактора VIII больным гемофилией осуществляют с интервалом 1224 ч в дозе, обеспечивающей повышение содержания фактора VIII не менее чем на 20%. Лечение продолжают в течение нескольких дней до видимого уменьшения размеров гематомы. При хирургических вмешательствах гемостатическую дозу вводят за 30 мин до операции. При массивном кровотечении восполняют кровопотерю, в конце операции криопреципитат вводят повторно ( 1 /2 дозы от первоначальной). Через 35 дней после операции необходимо поддерживать концентрацию фактора VIII в крови больного в тех же пределах, что и во время операции. В послеоперационный период в дальнейшем для поддержания гемостаза достаточно повысить содержание фактора VIII до 20%. Длительность гемостатической терапии 714 дней и зависит от характера, локализации кровотечения, репаративных особенностей ткани. Лечение больного гемофилией криопреципитатом целесообразно сочетать с одновременным назначением антифибринолитических средств и ГКС в профилактических и средних терапевтических дозах.
Противопоказания
Побочные эффекты
Аллергические и трансфузионные реакции (крапивница, сыпь, стридорозное дыхание, снижение АД, озноб, гипертермия, анафилаксия), преходящая парестезия слизистой оболочки полости рта, тошнота, рвота, головная боль.
Особые указания
С осторожностью применяют в период беременности и кормления грудью. Необходимо осуществлять контроль ЧСС до и во время терапии: при значительном повышении ЧСС замедляют скорость инфузии или прекращают введение. Во время и после окончания курса терапии необходимо контролировать содержание фактора VIII в крови. Для выявления признаков прогрессирующей гемолитической анемии необходимо осуществлять контроль за гематокритом и прямой реакцией Кумбса. Изменения иммунного статуса у больных асимптоматической гемофилией обусловлены многократным воздействием вирусных возбудителей и/или возможным наличием примесей в препаратах фактора VIII (например IgG). Для достижения удовлетворительных клинических результатов помимо первоначально рассчитанной дозы возможно введение дополнительной дозы. При отсутствии клинического эффекта необходимо провести тест на выявление ингибитора и определить его количество в нейтрализованных антигемофильных единицах на 1 мл или общий объем плазмы. Для снижения риска развития побочных эффектов рекомендуется использовать не позднее 1 ч после разведения, вводить только в/в, в течение не менее 3 ч (со скоростью 10 мл/мин), р-р не замораживать и не использовать вторично. Возможно развитие антител к фактору свертывания VIII, в таких случаях эффективность терапии обычно снижается, что может потребовать повышения дозы фактора свертывания VIII. Возможно повышение скорости снижения показателей CD4-клеточного анализа у ВИЧ-сероположительных больных гемофилией.
Взаимодействия
даназол повышает активность фактора свертывания VIII.
Предрасположенность к повышенной свертываемости крови
Подробнее об исследовании
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание ее нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свертывающей, естественной антикоагулянтной и фибринолитической систем крови. В норме процессы в ней уравновешены, что обеспечивает жидкое состояние крови. Смещение этого равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений и тромбообразования, то есть тромбофилии.
Наследственная тромбофилия (патология, обуславливающая повышенную склонность к тромбообразованию) – одно из самых распространенных генетических нарушений. Она часто остается недиагностированной и проявляется обычно в форме тромбоза глубоких вен и венозной тромбоэмболии. Нарушение свертываемости крови при наследственной тромбофилии в большинстве случаев вызывается изменениями в генах факторов свертывания крови II и V, связанными с известными генетическими маркерами (F2 G20210A, F5 G1691A). Именно они играют главную роль в развитии тромбофилии и ассоциированных с ней заболеваний.
Протромбин, или коагуляционный фактор II, – один из основных компонентов свертывающей системы крови. При мутации гена протромбина усиливается его экспрессия, что в свою очередь повышает уровень протромбина в плазме. При мутации в гене фактора V развивается устойчивость к активированному протеину С, что приводит к относительной гиперкоагуляции. Соответственно, риск образования тромбов увеличивается.
Проявление тромбофилических генетических мутаций зависит также от возраста, факторов окружающей среды и наличия других мутаций. У носителей аллеля, предрасполагающего к тромбофилии, заболевание может не проявляться до воздействия провоцирующих факторов, таких как беременность, прием оральных контрацептивов, гормональная заместительная терапия, длительная иммобилизация, курение.
Сочетание мутаций гена протромбина и гена фактора Лейден увеличивает риск тромбофилии в раннем возрасте, частоту рецидивов и способствует более тяжелым тромбозам.
Также риск тромбоза повышается при совместном носительстве мутации в гене F5 и по генетическому маркеру MTHFR (C677T). Характерными клиническими проявлениями тромбофилии, обусловленной фактором V Лейден, являются тромбозы глубоких вен и тромбоэмболия легочной артерии.
Наряду с повышенным риском тромбозов наследственная тромбофилия может увеличивать вероятность развития акушерских и гинекологических осложнений (привычное невынашивание, задержка внутриутробного развития плода, гестозы и др.).
Наследственный дефект коагуляции особенно вероятен при тромбозе до 45 лет при отсутствии дополнительных факторов риска (например, хирургического вмешательства или иммобилизации), при частых тромбозах у взрослых или тромбозе у детей. Генетическое исследование будет иметь профилактическое значение для человека в случае, если у его кровных родственников были тромботические заболевания в молодом возрасте.
Мутации в генах F2 и F5 наследуются по аутосомно-доминантному типу, поэтому патологический эффект реализуется даже при наличии одной копии поврежденного гена.
Своевременная диагностика генетической предрасположенности к повышенной свертываемости крови и ранние профилактические и/или лечебные мероприятия помогут избежать серьезных последствий для сердечно-сосудистой системы и ассоциированных тяжелых заболеваний.
Кроме того, профилактика тромбоэмболических осложнений важна для безопасного течения беременности при наличии наследственной тромбофилии.
Факторы риска развития повышенной свертываемости крови:
- заболевания крови (антифосфолипидный синдром, тромбоцитозы),
- атеросклероз,
- варикозное расширение вен нижних конечностей,
- артериальная гипертензия,
- злокачественные новообразования,
- ожирение,
- беременность и послеродовый период (до 6 недель),
- химиотерапия,
- курение,
- гиподинамия,
- травмы и хирургические вмешательства,
- постельный режим (более 3 суток),
- длительные статические нагрузки,
- длительная иммобилизации после операции,
- применение пероральных контрацептивов, содержащих эстрогены,
гормональная заместительная терапия, - катетер в центральной вене.
Когда назначается исследование?
- При венозном тромбозе до 50 лет.
- При венозном тромбозе в нетипичных местах (портальные, мезентериальные, церебральные вены).
- При рецидивирующем венозном тромбозе.
- При венозном тромбозе во время беременности.
- При венозном тромбозе у женщин, принимающих оральные контрацептивы или гормонзаместительные препараты.
- При самопроизвольном прерывании беременности на 10-й неделе и позднее.
- При осложненном акушерском анамнезе (тяжелая преэклампсия, отслойка плаценты, плацентарная недостаточность, задержка развития плода).
- При досимптоматическом выявлении групп пациенток с высоким риском развития тромбофилических осложнений при беременности.
- При венозном тромбозе в семейном анамнезе, досимптоматическом определении предрасположенности к повышенной свертываемости крови.
- Когда известно, что кто-либо из родственников пациента был носителем мутации G1691A в гене фактора 5 и/или G20210A в гене фактора 2, в том числе при отсутствии симптомов заболеваний (особенно при планировании беременности и перед началом приема оральных контрацептивов).
- При венозном тромбозе, связанном с использованием тамоксифена или других селективных модуляторов рецепторов эстрогена.
- В случае инфаркта миокарда или инсульта у курящих женщин до 50 лет.
- При артериальном тромбозе, а также при идиопатической венозной тромбоэмболии, не связанной с катетеризацией вен или инсультом, у детей.
- Подготовка к большой полостной операции (миома матки, кесарево сечение, кисты яичников и пр.).
- Рекомендуется проводить анализ на предрасположенность к тромбофилии всем женщинам, планирующим беременность (рекомендация ВОЗ от 8 декабря 2005 года).
Тромбофилия. всем кто планирует, всем у кого были неудачи ознакомиться нужно! Она бывает скрытой!
Тромбофилия — патологическое состояние кровеносной системы, возникающее на фоне нарушения свойств и состава крови и ведущее к возникновению тромбоэмболий кровеносных сосудов (преимущественно венозных) и рецидивирующих тромбозов различной локализации, часто возникающее в связи с беременностью, после хирургического вмешательства, травмы или физического перенапряжения. Заболевание обусловлено генетической (у 30–50% — с тромботическим состоянием) или приобретенной патологией клеток, а также дефектами свертывающей системы крови.
Наследственная тромбофилия представляет собой предрасположенность к тромбозу вследствие генетических дефектов как свертывающей, так и противосвертывающей (антикоагулянтной и фибринолитической) систем крови.
Генетический анализ позволяет выявить полиморфизмы генов факторов и компонентов системы гемостаза, которые приводят к их аномальному синтезу или нарушению функциональной активности. Это позволяет оценить риски развития патологии и осложнений, тромбоэмболии, венозных и артериальных тромбозов. Скрининг генетических особенностей тромбофилий помогает на раннем этапе выявить группу риска и внести соответствующие коррективы в тактику ведения пациентов.
Данный тест даёт возможность выявить риск развития заболеваний, обусловленных полиморфизмом генов следующих факторов и компонентов системы гемостаза:
(фактор II свертывания крови). Ген протромбина кодирует белок (протромбин), который является одним из главных факторов системы свертывания. Повышение уровня протромбина в плазме на 30%. Потеря плода в I триместре, невынашивание беременности, фетоплацентарная недостаточность, гестозы, задержка развития плода, отслойка плаценты. Венозные тромбозы, повышение риска послеоперационной смерти. Ишемический инсульт, увеличение риска развития тромбоэмболии в 3 раза.
F5 (фактор V свертывания крови). Резистентность к активированному протеину C. Потеря плода во II и III триместрах, тромбоз вен нижних конечностей, ТЭЛА, тромбозы церебральных сосудов и ишемический инсульт, артериальные тромбозы в молодом возрасте. При приеме гормональных контрацептивов риск тромбозов повышается в 6–9 раз.
F7 (фактор VII свертывания крови). Понижение уровня фактора VII в. крови на 30%. Двухкратное снижение риска инфаркта миокарда. У новорожденных — геморрагический диатез, кровотечение из пупочной ранки, слизистой оболочки носа, тракта.
F13A1 (фактор XIII свертывания крови). Снижение уровня фактора XIII в. крови. Уменьшение риска венозного тромбоза. Повышенный риск на фоне антикоагулянтной терапии. Геморрагический синдром, олигоспермия у гомозиготных мужчин, гемартрозы.
FGB — фибриноген (фактор I свертывания крови). Повышение уровня фибриногена в крови на 10–30%. Повышенный в 2,6 раза риск инсульта с многоочаговостью поражений. Привычное невынашивание беременности, фетоплацентарная недостаточность, гипоксия плода.
Серпин 1 () — антагонист тканевого активатора плазминогена. Повышение уровня в крови, снижение фибринолитической активности крови. Привычное невынашивание беременности, увеличение риска развития тяжелого гестоза в 2–4 раза. Гипоксия, задержка развития и внутриутробная смерть плода. Повышение риска коронарных нарушений в 1,3 раза.
ITGA2-α2 интегрин (тромбоцитарный рецептор к коллагену). Ген ITGA2 кодирует аминокислотную последовательность α интегринов — специализированных рецепторов тромбоцитов, за счет которых происходит взаимодействие тромбоцитов с тканевыми белками, обнажаемыми при повреждении стенки сосудов. Благодаря интегринам, тромбоциты образуют монослой в области поврежденных тканей, что является необходимым условием включения последующих звеньев свертывающей системы крови, предохраняющей организм от кровопотери.
Полиморфизм гена ITGA2 связан с заменой нуклеотида цитозина © на тимин (Т), что приводит к замене аминокислоты в пептидной цепи молекулы α интегринов. Изменение первичной структуры субъединицы вызывает изменение свойств рецепторов. В случае варианта Т полиморфизма c. > T отмечается увеличение скорости адгезии тромбоцитов, что может приводить к повышенному риску тромбофилии. Имеющиеся данные позволяют рассматривать вариант Т как маркер повышенного риска инфаркта миокарда (в 2,8 раза), ишемического инсульта, повышенного риска послеоперационных тромбозов. Развитие тромбоэмболических заболеваний, постангиопластические тромбозы.
интегрин (тромбоцитарный рецептор фибриногена). Ген ITGB3 кодирует аминокислотную последовательность белковой молекулы тромбоцитарного рецептора фибриногена. Данный рецептор обеспечивает взаимодействие тромбоцитов с фибриногеном плазмы крови, в результате чего происходит агрегация тромбоцитов и образование тромба.
Полиморфизм c.176T > C связан с заменой нуклеотида тимина (Т) на цитозин © в участке ДНК, кодирующем аминокислотную последовательность белковой молекулы тромбоцитарного рецептора фибриногена. Вследствие нуклеотидной замены происходит замена аминокислоты в белковой цепи рецептора, что приводит к изменению его свойств. В случае варианта С полиморфизма тромбоциты приобретают повышенную склонность к агрегации, поэтому носители этого варианта имеют повышенный риск тромбообразования с такими последствиями, как инфаркт миокарда, развитие острого коронарного синдрома, тромбоэмболия.
Посттрансфузионная тромбоцитопения. Повышенный риск потери плода на ранних сроках. В то же время, у пациентов с этим вариантом полиморфизма отмечается низкая эффективность применения в качестве антиагрегантов таких препаратов, как аспирин (ацетилсалициловая кислота) и плавикс.
Показания к назначению
- Инфаркт миокарда;
- гиперпротромбинемия;
- тромбоэмболические состояния в анамнезе;
- невынашивание беременности;
- фетоплацентарная недостаточность;
- внутриутробная гибель плода и задержка развития плода;
- отслойка плаценты;
- перед большими полостными операциями;
- венозный тромбоз;
- тромбоэмболические заболевания в молодом возрасте;
- рецидивирующие тромбоэмболии;
- сердечно-сосудистые заболевания в семейном анамнезе;
- случаи наследственной тромбоэмболии в семье;
- случаи тромбоза в анамнезе жизни;
- все женщины, планирующие беременность
Интерпретация результатовОсобенностью многих вариантных генов является то, что они могут долгое время никак себя не проявлять. Патологические симптомы могут возникнуть при дополнительных условиях (особенности питания, беременность, прием лекарств, образ жизни и т.д.). Выяснение этих дополнительных условий помогает эффективно предотвращать развитие заболеваний и их осложнений у носителей вариантных генов
ГЕН ЛЕЛЬ РИСКА ПРОЯВЛЕНИЯ ГЕНОТИПА
Ген F2-протромбин
(фактор II свертывания A/A крови)G/A
A/A
- Гибель плода в 1 триместре;
- невынашивание беременности;
- фетоплацентарная недостаточность;
- гестозы;
- внутриутробная задержка развития плода;
- отслойка плаценты;
- венозные тромбозы;
- ишемические инсульты;
- тромбоэмболии
Ген F5 (фактор V свертывания крови)G/A
A/A
- Гибель плода во 2 и 3 триместрах;
- повышенный риск при приеме гормональных контрацептивов;
- тромбоз вен НК;
- ТЭЛА;
- артериальные тромбозы в молодом возрасте
Ген F7 (фактор VII свертывания крови)G/A
A/A
- Развитие геморрагического диатеза у новорожденных;
- кровотечение из пупочной ранки, слизистой носа, ЖКТ
Ген F13A1 (фактор XIII свертывания крови)G/T
T/T
- Геморрагический синдром;
- гемартрозы;
- повышение риска тромбоза на фоне приема антикоагулянтной терапии
Ген FGB-Фибриноген (фактор I свертывания крови)G/A
A/A
- Инсульты с многоочаговыми поражениями;
- невынашивание беременности:
— фетоплацентарная недостаточность;
— внутриутробная гипоксия плодаГен Серпин1 (PAI-1)-антагонист тканевого активатора плазминогена5G/4G
G/4G
- Невынашивание беременности;
- развитие гестозов;
- гипоксия, задержка развития и внутриутробная смерть плода;
- риск коронарных нарушений
Ген ITGA2-альфа2 интегрин (тромбоцитарный рецептор к коллагену)C/T
T/T
- Послеоперационные тромбозы;
- риски развития ИМ, ишемического инсульта
Ген ITGB3-бета интегрин (тромбоцитарный рецептор фибриногена)C/T
C/C
- Риск гибели плода на ранних сроках;
- низкая эффективность терапии аспирином;
- риск развития ИМ;
- развитие посттрансфузионной тромбоцитопении