Билиарная дисфункция после холецистэктомии
В настоящее время широкое распространение малоинвазивной хирургической технологиии значительно увеличило частоту холецистэктомий и снизило риск послеоперационных осложнений. Однако, после холецистэктомии часто формируется симптомокомплекс, определяемы как «постхолецистэктомический синдром», основными клиническими признаками которого являются боль в животе и диспептические расстройства. Эти жалобы вызваны функциональными нарушениями сфинктера Одди (СО). Классификация билиарных дисфункций, в том числе СО , разработана в рамках международного консесуса по функциональных гастроинтестинальных расстроиствам (РимII). Дисфункции СО включают первичные и вторичные (после холецистэктомии) нарушения.
По совокупности клинико-лабораторных и инструментальных проявлений выделяют три клинических варианта дисфункций СО:
- Билиарный I, II, III типа
- Панкреатический
- Смешанный
Тип дифункции СО определятся сложной анатомической структурой сфинктерного аппарата, состоящего из сфинктера общего желчного протока, сфинктера панкреатического протока и сфинктера их общей ампулы, которая открывается в двенадцатиперстную кишку большим дуоденальным сосочком. При спазме преимущественно сфинктера холедоха развивается дисфункция СО по билиарному типу, при спазме панкреатического сфинктера-панкреатический тип, соответственно при спазме сфинктера в целом или только ампулярной его части возникает смешанный тип дисфункции СО.
Клиническая картина дисфункции СО также зависит от ее типа. При билиарной дисфункции I типа отмечается характерная боль в правом подреберье, часто с типичной иррадиацией в область правой половины верхнего плечевого пояса, повышение уровня печеночных ферментов (аминотрансфераз и щелочной фосфатазы), замедление дренажной функции и расширение общего желчного протока до 12 мм и более. Это наиболее тяжелый тип билиарной дисфункции, т.к. расширение протока свидетельствует о стойком спазме сфинктера. II тип характеризуется сочетанием боли с одним или двумя из указанных признаков. При III билиарном типе отмечается только типичный болевой синдром. Панкреатический тип проявляется признаками острого или подострого панкреатита, смешанный тип имеет сочетанную клиническую симптоматику.
В подавляющем большинстве случаев функциональный спазм СО развивается после холецистэктомии, особенно в ранние сроки после операции. От 20 до 40 % больных, перенесших холецистэктомию, предъявляют жалобы на боли в правом подреберье и диспептические расстройства. Именно спазм СО вызывает клиническую картину постхолецистэктомического синдрома. По сути дела, постхолецистэктомический синдром является не нозологической формой, а собирательным понятием, включающим в себя симптомы билиарной и панкреатической патологии вследствие нарушения пассажа желчи и панкреатического секрета и развития протоковой гипертензии, боли и нарушений пищеварения (билиарный, панкреатический или смешанный тип дисфункции СО).
Боль в правом подреберье — основной клинический синдром любой билиарной дисфункции. Механизм ее развития при дисфункции СО обусловлен спастическим сокращением гладких мышц сфинктера и вторичным повышением давления в протоках.
Дисфункция СО после холецистэктомии требует обязательного и эффективного устранения спазма, что приведет к восстановлению пассажа желчи, снижению протокового давления и уменьшению боли. Купирование спазма сфинктерного аппарата реализуется на периферическом уровне при воздействии непосредственно на конечный этап мышечного сокращения. Для этого применяются хорошо известные группы препаратов- холинолитики ( М1, М2 и М3 —холиноблокаторы) и миотропные спазмолитики прямого действия. Хотя использование холинолитиков патогенетически оправдано и они достаточно эффективны, в том числе и при спазме СО, но их курсовое длительное применение лимитировано большим числом хорошо известных побочных эффектов. Холинолитики обычно применяются только для купирования острого болевого приступа, вызванного спазмом.
Существуют миотропные спазмолитики трех групп с разными механизмами действия: неселективные спазмолитики — папаверин и дротаверин являются блокаторами фосфодиэстеразы цАМФ и цГМФ, пиноверия бромид и отилония бромид — блокаторы кальциевых каналов, селективно воздействующие на гладкие мышцы ЖКТ и мебеверин — селективный блокатор натриевых каналов гладких мышц ЖКТ. Конечный этап действия любого из этих спазмолитиков- это уменьшение концентрации ионов кальция в миоците и гадкомышечная релаксация. Какой из препаратов следует предпочесть при дисфункции СО? При относительно сравнимой эффективности, препараты с селективным действием на гладкие мышцы пищеварительной системы (мебеверин, отилония бромид, пиноверия бромид ) безусловно предпочтительнее. Они лишены побочных эффектов холинолитиков и системного вазодилатирующего действия, свойственного дротаверину и папаверину. Но из двух групп селективных спазмолитиков именно при спазме СО препаратом выбора следует считать мебеверин (Дюспаталин). По сравнению с селективными блокаторами кальциевых каналов у мебеверина есть значительные преимущества, т.к. он, в отличие от других препаратов, обладает высоким сродством к мышечному аппарату этого сфинктера. Кроме того, препарат оказывает не только антиспастическое, но и нормализующее действие на моторику не подавляя полностью мышечные сокращения после гипермоторики, т.е. не вызывает рефлекторной гипотонии. Этот механизм обусловлен тем, что мебеверин препятствует восполнению депо кальция на мембране миоцита после стимуляции α1-адреноцепторов. Отсутствие рефлекторной гипотонии является существенным преимуществом препарата и позволяет применять его у больных при смешанных нарушениях моторики, как при гипертонусе СО и одновременной гипотонии ЖП. При этом дополнительного снижения тонуса стенки ЖП не происходит. Дюспаталин обладает пролонгированным действием, что тоже является его преимуществом по сравнению с другими спазмолитиками, и принимается не чаще двух раз в сутки в виде капсул по 200 мг. Пролонгированное действие обеспечивается микрогранулированной формой выпуска, благодаря которой препарат равномерно распределяется и всасывается в кишечнике в течение 16 часов.
Дюспаталин следует назначать сразу после холецистэктомии для профилактики дисфункции СО. При наличии конкрементов или сладжа дюспаталин показан как симптоматическое лечение, в том числе, при подготовке к операции.
В случае спазма СО после холецистэктомии неизбежно развивается полная или частичная (селективная стеаторея) экскреторная недостаточность поджелудочной железы, что приводит к нарушению переваривания и всасывания основных нутриентов. Для устранения ферментной недостаточности оптимально применение современных ферментных препаратов в виде минимикросфер с высоким содержанием ферментов, прежде всего липазы. К таким препаратам относится креон 10000, сбалансированный по ферментному составу и содержащий необходимый минимум ферментов для адекватного переваривания.
Опрос о бремени болезни среди пациентов
Помогите докторам узнать о мигрени больше. Ваше мнение и ощущения очень важны, чтобы мы могли лучше помогать вам справляться с мигренью!
Постхолецистэктомический синдром
 Постхолецистэктомический синдром – нарушение в системе желчеотделения, развивающееся после удаления желчного пузыря. Появляется постхолецистэктомический синдром примерно в 10–15% случаев и характеризуется примерно такими же симптомами, какие были до оперативного вмешательства.
Постхолецистэктомический синдром – нарушение в системе желчеотделения, развивающееся после удаления желчного пузыря. Появляется постхолецистэктомический синдром примерно в 10–15% случаев и характеризуется примерно такими же симптомами, какие были до оперативного вмешательства.
Как проявляется патология?
В сущности, удаление желчного пузыря – распространенная и не слишком сложная операция. В настоящее время оперативное вмешательство проводится путем щадящих методов – с помощь эндоскопии. Большинство пациентов хорошо переносят холецистэктомию, поэтому хирургическое вмешательство проходит без развития осложнений. В редких случаях пациентов беспокоят следующие симптомы:
- возобновление болей в подреберной области с левой стороны от срединной линии;
- сухость во рту, горький привкус;
- неприятие жирной пищи;
- ухудшение самочувствия при погодных изменениях;
- боли невралгического характера над переносицей или над правой глазницей;
- метеоризм или повышенное образование газов;
- болезненность в пупочной области;
- частые поносы.
Постхолецистэктомический синдром еще называют дисфункцией сфинктера Одди. Данный термин-название мышечного клапана, расположенного внутри двенадцатиперстной кишки. Сокращения и расслабления сфинктера регулируют своевременное поступление желчи в пищеварительный тракт.
Симптомы дисфункции сфинктера Одди:
- приступы болей в области печени длительность от 25 минут и более, носящие регулярный характер;
- чувство тяжести в брюшной полости;
- неврологические расстройства, при этом боли отдают в позвоночник или реберную область;
- затруднение пищеварения, дискомфорт после принятия пищи.
Классификация
Единая классификация такого состояния, как постхолецистэктомический синдром, отсутствует. Некоторые врачи определяют его следующим образом:
- Истинный постхолецистэктомический синдром – это патология желчеотделения, не устраненная во время операции. Например, в желчном протоке могут остаться камни, не распознанные во время операции.
- Ложный постхолецистэктомический сидром – это патология, не связанная с системой желчеотделения.
- Сужение внепеченочных желчных протоков и дискинезия сфинктера желчного пузыря.
Иногда симптомы постхолецистэктомического синдрома вызваны спайками в брюшной полости после операции. В некоторых случаях заболевание связывают с оставшейся длинной культей желчного протока, где происходит локализация воспаления. Культя может являться источником инфицирования желчных путей, это, в свою очередь, поддерживает длительное течение холангита или воспаления брыжеечных лимфатических узлов.
Выявлена связь между размером конкрементом и постхолецистэктомическим синдромом. Так, чем больших размеров были камни в желчном пузыре, тем чаще развивается это патологическое состояние. Удивителен следующий факт: чем больше была выраженность изменений в желчном пузыре до операции, тем лучше чувствуют себя пациенты после операции, и наоборот.
Что способствует ПХЭС?
Существует ряд факторов, которые могут провоцировать развитие заболевания или усугублять неприятные проявления постхолецистэктомического синдрома. В первую очередь, это диагностические ошибки во время проведения лечения и подготовке к операции. Так, к обостряющим факторам относятся любые заболевание желудочно-кишечного тракта (гастрит, колит, язва, грыжи, рефлюкс).
Незамеченные во время операции камни, или недоброкачественное удаление желчного пузыря, когда в брюшной полости остаются части удаленного органа также способствуют появлению симптомов постхолецистэктомического синдрома. Патология печени и поджелудочной железы (гепатиты, панкреатит) отрицательно влияет на послеоперационное состояние пациента.
Типичное развитие заболевания
- Синдром «отсутствия желчного пузыря», когда функция этого органа полностью выпадает. Однако после оперативного вмешательства включается ряд компенсаторных механизмов, в результате которых наблюдается расширение сфинктера Одди и гипертония желчного пузыря.
- Синдром «культи желчного пузыря». После операции в оставшемся участке пузырного протока иногда развивается воспаление. При этом культя способна расширяться, также в ней вторично образуются конкременты, что приводит к появлению болей в подреберной области. Симптомы напоминают дискинезию желчного пузыря.
- Расслабление, или гипотония сфинктера Одди, ведет к регулярному поступлению желчи в кишечник, в том числе, и при отсутствии пищеварительных процессов. Это влияет на ряд реакций в желудочно-кишечном тракте, а также способствует появлению дисбактериоза в кишечнике (доказана антисептическая функция концентрированной желчи). При таком развитии событий могут воспаляться желчные протоки из-за проникновения содержимого двенадцатиперстной кишки.
Как будет работать организм после удаления желчного пузыря?
Желчный пузырь выполняет функцию накопителя желчи, необходимого для полноценного переваривания пищи. Желчь производится в печени, затем секрет должен поступить в двенадцатиперстную кишку для участия в переваривании пищи. Желчный пузырь в качестве накопителя собирает излишки желчи. Сфинктер Одди, расслабляясь или сжимаясь, контролирует приток секрета. Количество желчи, производимое печенью, напрямую зависит от консистенции пищи, ее количества и от частоты питания.
Нарушения, провоцирующие патологию желчного пузыря, иногда полностью выключают его из работы еще до проведения операции. Как правило, отсутствие желчного пузыря не ухудшает качество жизни, большинство пациентов продолжают вести привычное существование. Соблюдение специальных предписаний и диеты поможет вам свести к минимуму последствия удаления желчного пузыря.
Диета после холецистэктомии (удаления желчного пузыря)
 Так как резервуар для накопления желчи отсутствует, нельзя допускать ее избыточной выработки, это также является лечение постхолецистэктомического синдрома. Провоцируется избыток желчи большим количеством съедаемой пищи.
Так как резервуар для накопления желчи отсутствует, нельзя допускать ее избыточной выработки, это также является лечение постхолецистэктомического синдрома. Провоцируется избыток желчи большим количеством съедаемой пищи.
- Из этого следует первый принцип диеты: питаться нужно часто, 5–6 раз в день, причем небольшими порциями.
- Удаление желчного пузыря снижает в желчи концентрацию пищеварительных ферментов, которые отвечает за усваивание жиров (например, фермента липазы). Из-за этого необходимо диета предполагает
- ограничение количества жирной пищи, так как она перегружает печень, но полноценно не усваивается.
- Животные жиры (сало, говяжий, куриный, барсучий жир) следует полностью исключить из питания.
- Вещества, вырабатываемые в процессе жарки пищи, провоцируют раздражение слизистой и активное выделение желудочной кислоты. При отсутствии желчного пузыря такое воздействие противопоказано.
- Пищу следует варить, тушить или готовить на пару. Жареное есть нельзя.
- Холодная еда вызывает спазм привратника желудка, который переходит на желчевыводящие протоки. Поэтому пища должна быть теплой, не холодной и чрезмерно горячей.
- Слишком сухая или твёрдая пища отрицательно влияет на состояние пищеварительного тракта. Избегайте питания всухомятку.
- Чрезмерная физическая нагрузка может приводить к развитию осложнений, в первые полгода она противопоказана. Особенно следует избегать излишнего напряжения брюшного пресса.
Продукты, рекомендуемые для употребления:
- Первые сутки после холецистэктомии нельзя принимать пищу и пить воду;
- На вторые сутки разрешен кисель или нежирный бульон;
- Отварные овощи в протертом состоянии или в виде пюре;
- Каши без сахара, сваренные на воде;
- Растительное масло, так как оно улучшает отделение желчи;
- Некислые фрукты;
- Молочные продукты, желательно низкой жирности (творог, кефир, ряженка, молоко);
- Яйца всмятку, но вкрутую варить их нельзя, также разрешен омлет;
- Запеканки из творога и сухофруктов, сырники, манники;
- Арбузы и дыни рекомендуются из-за мочегонных свойств;
- Из сладкого разрешен мармелад, варенье, мед в умеренных количествах;
- Сливочное масло в небольших количествах;
- Отвары шиповника, настои трав (желчегонные сборы);
- Овощные соки (свекольный, тыквенный).
Продукты, которые запрещено употреблять людям с удаленным желчным пузырем:
- Животные тугоплавкие жиры;
- Алкогольные напитки;
- Кофе и крепкий чай;
- Консервы, копчёности;
- Раздражающие слизистую желудка продукты: чеснок, лук, острые и пряные приправы;
- Редьку, грибы;
- Домашние консервы;
- Жирные мясные, рыбные, грибные бульоны;
- Холодную пищу – прохладительные напитки, мороженое, холодец;
- Нельзя употреблять много необработанной клетчатки – сырые овощи, хлеб с отрубями, бурый рис, фасоль, горох;
- Пищу, богатую углеводами следует кушать умеренно, чтобы не спровоцировать осложнения. К ней относятся белый хлеб, картофель, каши, макароны, сдоба.
Таким образом, если соблюдать эти нехитрые рекомендации, можно избежать последствий удаления желчного пузыря – постхолецистэктомического синдрома, а также сохранить качество жизни на прежнем уровне.
Лечение последствий операции
Терапия постхолецистэктомического синдрома проводится такая же, как и при холецистите или холангите. Пациенту может помочь пластика сфинктера Одди, которая проводится эндоскопическими методами. При неэффективности этих вмешательств может потребоваться дополнительная операция для установления причины развившегося синдрома.
Жизнь без желчного пузыря, постхолецистэктомический синдром, диета после холецистэктомии
Одним из часто выполняемых оперативных вмешательств на органах пищеварения является плановая или экстренная холецистэктомия (удаление жёлчного пузыря). Операция чаще выполняется по поводу желчной колики (острого болевого синдрома в связи с обструкцией жёлчного пузыря камнем), либо в связи с рецидивирующими панкреатитами, причиной которых являются желчные камни. Нередко после удаления желчного пузыря формируется постхолецистэктомический синдром.
Пищеварение без участия желчного пузыря изменяется, так как физиологическое отделение и депонирование желчи нарушается (отсутствует резервуар для её накопления). В более трети случаев, после холецистэктомии сохраняются или появляются жалобы, которые связаны с функциональными расстройствами сфинктеров, обеспечивающих транзит желчи (сфинктер Одди), повышением внутрипротокового давления или прогрессированием сопутствующей патологии (язвенная болезнь, рефлюкс желудочного сока в пищевод, панкреатит, дуоденит). Указанные состояния носят название постхолецистэктомический синдром.

Главной причиной появления жалоб (постхолецистэктомический синдром) после удаления желчного пузыря считается повышение внутрипротокового давления и сокращение (спазм) сфинктера Одди, а также аномальный ответ гладких мышц сфинктера на выработку холецистокинина. Постхолецистэктомический синдром имеет место у подавляющего большинства пациентов после холецистэктомии. Со временем, у ряда больных при отсутствии сопутствующих заболеваний, даже без желчного пузыря наблюдается приспособление к новым условиям функционирования и снижение гипертонуса (спазма) сфинктеров, что ведёт к уменьшению негативных симптомов.
Жизнь без желчного пузыря возможна при соблюдении диеты и образа жизни. После холецистэктомии можно достичь достаточно хорошего качества жизни больного.
Как изменяется пищеварение без желчного пузыря?
Для понимания того, как меняется пищеварение без желчного пузыря, рассмотрим некоторые вопросы физиологии желчевыделения. Желчь представляет собой стерильную (в норме) жидкость, нейтральной реакции, от светло – желтого (печёночная желчь), до оливкового цвета (пузырная желчь) цвета. При различных заболеваниях гепатобилиарной системы (холецистит, камни), её стерильность может нарушаться.
Желчь состоит из жидкой фракции (вода) и растворенных в ней веществ (желчные пигменты, кислоты, холестерин, лецитин, фосфолипиды, белок, соли). Около 70 процентов веществ составляют жёлчные кислоты. Билирубин (пигмент), образующийся при распаде гемоглобина, окрашивает кал в соответствующий цвет.
Желчь принимает участие в расщеплении жиров, усиливает моторику кишечника, обладает бактерицидным свойством по отношению ко многим патогенным микроорганизмам. Образование и выделение желчи – сложный и многоступенчатый процесс. Важно не только образование желчи, но и её выведение и накопление. Поэтому жизнь без желчного пузыря чревата нарушением пищеварения.
Гепатоциты (клетки печени) постоянно, не зависимо от приёма пищи, образуют желчь (около 1,5 литров в сутки), которая поступает в желчный пузырь. Размер пузыря в среднем 30-40 мл. В нем жидкая светло-желтая желчь уменьшается в объеме за счёт обратного всасывания жидкой части (воды). При этом желчь концентрируется в 5-10 раз. Без желчного пузыря концентрационная и накопительная функции выпадают, развивается постхолецистэктомический синдром.
Во время еды синтезируется пищеварительные гормоны (холецистокинин, панкреозимин), усиливающие выработку и выведение жёлчи (сокращение желчного пузыря) в ответ на поступление пищи. Кроме того, во время приёма пищи раздражаются рецепторы вегетативной (парасимпатической) нервной системы, усиливается двигательная функция желчного пузыря, что также способствует выделению жёлчи. После холецистэктомии теряется цикличность выделения желчи, отличая постхолецистэктомический синдром от других патологий.
Желчь нейтрализует кислый химус, поступающий из желудка, что даёт возможность ферментам поджелудочной железы работать в просвете кишечника. Без желчного пузыря панкреатические ферменты недостаточно активны.
Таким образом, без желчного пузыря (после холецистэктомии) выпадает его депонирующая функция, так как в нем накопливается и концентрируется желчь. Во время еды пузырная желчь не смешивается с печёночной желчью, выделяемой непрерывно, не создаётся оптимальное внутрипротоковое давление в желчевыводящих путях. Без желчного пузыря, удалённого в результате холецистэктомии, наблюдается гипертонус (спазм) сфинктера Одди, который главным образом и определяет тяжесть такого состояния, как постхолецистэктомический синдром.
Без желчного пузыря наблюдается снижение выработки жёлчи и ее компонентов, расщепления липидов. После холецистэктомии, вследствие снижения секреции жёлчных кислот, резко снижается бактерицидность жёлчи, что может способствовать росту патогенной флоры в различных отделах ЖКТ и в системе билиарных (печеночных) протоков, развитию дисбактериоза кишечника. При этом постхолецистэктомический синдром затрагивает и другие органы пищеварительной системы.
При значительном дефиците компонентов жёлчи (билиарная недостаточность), развившейся после холецистэктомии, концентрация токсичных жёлчных кислот возрастает.
Симптомы постхолецистэктомического синдрома, боли после холецистэктомии
Симптомы, возникающие после холецистэктомии, могут иметь характер билиарного или панкреатического расстройства. В первом случае больного беспокоят боли, дискомфорт в правом подреберье или в районе эпигастрия. Боли чаще невыраженные, иногда нарушающие самочувствие и жизнедеятельность человека, ещё реже наблюдаются симптомы ПХЭС, требующие неотложного медицинского вмешательства.
Боль при постхолецистэктомическом синдроме не изменяется после смены положения тела, дефекации, имеет характер спазмов или тянущих ощущений, длящихся около получаса. Болевые симптомы билиарного характера могут провоцироваться алиментарными погрешностями (жирная, обильная пища, алкоголь), сочетаться с тошнотой или рвотой, горечью и вздутием живота.
Часто симптомы и эпизоды болей совпадают с нервно-психическими перегрузками и травмами. При всём обилии жалоб и симптомов постхолецистэктомического синдрома, у больного при тщательном обследовании часто не удаётся выявить серьезных органических изменений в билиарного системе (желчные протоки), процесс носит функциональный характер, течение заболевания отличается доброкачественностью. Постхолецистэктомический синдром может претерпевать обратное развитие.
После операции, уже без желчного пузыря, больного могут беспокоить боли (эпигастрий и правое подреберье), в постприступный период лабораторным симптомом является повышенный уровень АЛТ и АСТ, конъюгированной фракции билирубина и щелочной фосфатазы. Нормализация указанных маркёров наблюдается вскоре после купирования билиарный болей, что является типичным симптомом при данном виде постхолецистэктомического синдрома.
Вторым типом симптомов, появляющихся после проведённой холецистэктомии являются признаки, характерные для панкреатического расстройства. Симтомы боли при этой разновидности постхолецистэктомического синдрома отличаются. Локализация болевых ощущений – подложечная область и левое подреберье. Болевые симптомы чаще умеренные, боль иррадиирует в спину, под правую лопатку, меняется при изменении положения тела. В анализе крови увеличивается амилаза.
Так как после холецистэктомии желчь поступает в ДПК нерегулярно, нарушается переваривание жиров. Из-за снижения бактерицидной роли жёлчи, тонкая кишка и протоки (панкреатический и жёлчные) обcеменяются патогенной микрофлорой. Все это при постхолецистэктомическом синдроме проявляется симптомом упорной диареи (жирные поносы), повышением температуры, потерей микро и макроэлементов, витаминов. Симптомы интоксикации – слабость, сниженная работоспособность.
Токсины бактерий оказывают влияние на моторику протоков. Воспалительный процесс (панкреатит, энтерит, колит, холангит) ведёт к повышению давления в просвете ДПК, что ведёт к забросу содержимого в рядом лежащие отделы с неизбежным повреждением слизистых. Симптомы обратного заброса (рефлюкса) находят проявления в виде рефлюкс-гастрита, эзофагита, панкреатита с попаданием агрессивных компонентов жёлчи в соответствующие отделы. Постхолецистэктомический синдром в данном случае может сопровождаться повышением температуры тела, отрыжкой горьким, воздухом, кислотой.
Часто симптомами постхолецистэктомического синдрома становятся боли и дискомфорт в верхних отделах живота, в спине, усиливающиеся после еды, особенно тяжелой и жирной, тяжесть в эпигастрии. Симптомы ферментной недостаточности – вздутие живота, частый обильный жирный стул. Слизистая оболочка и эпителий тонкой и толстой кишки после холецистэктомии (без желчного пузыря) претерпевает структурные изменения.
Кроме функциональных изменений, причиной болей и диспепсии после холецистэктомии могут стать органические нарушения. К ним относятся сужения, стриктуры, стенозы, опухоли большого дуоденального соска, камни протоков, увеличение головки поджелудочной железы (острое или хроническое воспаление, кисты, опухоли), послеоперационные спайки. При этом симптомы постхолецистоэктомического синдрома выражены ярче.
Диагностика постхолецистэктомического синдрома (ПХЭС)
Ситуация, при которой у больного без желчного пузыря (после холецистэктомии), сохраняются или появляются симптомы и жалобы, требует дообследования. Для исключения органической причины постхолецистэктомического синдрома проводят ряд лабораторно-диагностических вмешательств.
По назначению врача, при наличии постхолецистэктомического синдрома осуществляется исследование крови на биохимические маркёры (АЛТ, ЩФ, АСТ, билирубиновые фракции, амилазу, липазу), мочи на диастазу, гастроскопия.
Незаменимым и безопасным методом диагностики постхолецистэктомического синдрома является эхо-исследование (УЗИ) органов гепатобилиарной зоны (печень, желчевыводящие пути, поджелудочная железа с протоками). При этом оценивается толщина общего желчного и панкреатических протоков, наличие камней и сужений. Данное исследование при постхолецистэктомическом синдроме, в ряде случаев, проводится после пищевой липидной нагрузки (оценивается динамика просвета протоков).
Ещё более информативным, но более сложным исследованием, применяемым в диагностике ПХЭС, является ретроградная эндоскопическая (через осмотр двенадцатиперстной кишки) холангиопанкреатография с введением контрастного вещества – РХПГ. При этом визуализируется большой дуоденальный сосок и оценивается функция сфинктера Одди. Данное исследование при ПХЭС может сочетаться с манометрией (исследование функции панкреатического и билиарного сфинктеров, внутрипротокового давления), с помощью введения специального зонда.
Другим современным методом диагностики причины постхолецитэктомического синдрома является МРТ в сочетании с РХПГ (при этом возможно одновременное хирургическое вмешательство, восстанавливающее пассаж жёлчи).
Диета после холецистэктомии
Питание и диета после холецистэктомии играет важное значение для оптимального функционирования пищеварительной системы в условиях отсутствия желчного пузыря. Диета после холецистэктомии отличается от привычного рациона. Вследствие потери депонирующей функции пузыря, питание должно быть не реже 5-6 раз в сутки.
Пациенту без желчного пузыря резко уменьшают холестеринсодержащие продукты, предельные жирные кислоты (животные жиры). После холецистэктомии не рекомендуют субпродукты, сало, жирное мясо, жареные блюда, большое количество приправ и специй, печёные и сдобные блюда, газированные напитки.
Так как ожирение способствует нарушению процесса образования жёлчи, диета после холецистэктомии предполагает питание, направленное на снижение веса.
Медикаментозное лечение постхолецистэктомического синдрома
Постхолецистэктомический синдром необходимо лечить. Терапия осуществляется врачом – гастроэнтерологом, терапевтом или хирургом после всестороннего обследования. Самолечение недопустимо.
Для расслабления спазмированного сфинктера Одди при ПХЭС используют дротаверин, папаверин, мебеверин, гимекромон. Постхолецистэктомический синдром, в условиях ферментной недостаточности, требует назначения ферментов (креон, пангрол, мезим-форте, панкреатин).
Постхолецистэктомичекий синдром иногда сочетается с запорами и повышенным давлением в дуоденальной системе (двенадцатиперстной кишке). Поэтому при данных жалобах проводится лечение запоров, назначаются прокинетики (домперидон, метоклопрамид, тримебутин). Для профилактики холелитиаза (повторного образования камней в протоках) после холецистэктомии, усиления выработки жёлчи и ее выведения, снижения холестерина, по назначению врача назначают препараты урсодезоксихолевой кислоты.
Лечение нарушенного микробного пейзажа тонкой и двенадцатиперстной кишки осуществляется назначением кишечных антисептиков и антибиотиков, с последующим применением пробиотиков и пребиотиков.
Лечение постхолецистэктомического синдрома органической природы (спайки, стриктуры протоков, камни, опухоли) осуществляют хирургическим путём, в том числе с помощью РХПГ.
Жизнь без желчного пузыря – последствия, осложнения, диета и реабилитация
Удаление желчного пузыря – самая распространенная операция после аппендэктомии. Орган играет важную роль в пищеварении, поэтому пациентов интересует, как можно жить без него и какими последствиями грозит вмешательство.
Самыми сложными будут первые месяцы восстановления после операции. Придется всю жизнь придерживаться диетического питания и небольших физических нагрузок. В остальном жизнь останется прежней.
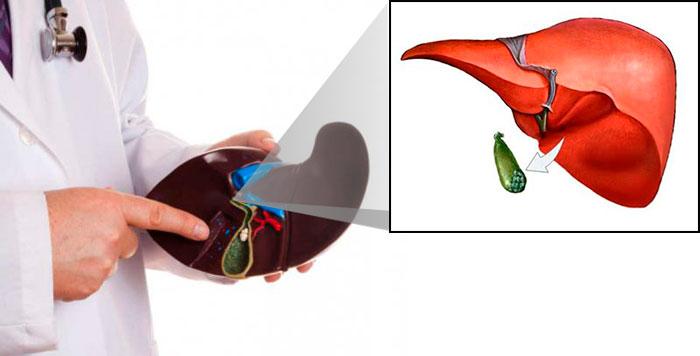
Роль и функции желчного пузыря в жизни человека
Желчный пузырь (ЖП) вместе с протоками образует единую систему – билиарную. Ее функция – накопление желчи и заброс ее в двенадцатиперстную кишку (12ПК).
Желчь беспрерывно выделяется печенью. Но она нужна только, когда в желудок попадает еда. До этого секрет накапливается и концентрируется в желчном пузыре. В 12ПК он выделяется при поступлении в нее частично переваренной пищи.
Таким образом, у желчного пузыря 2 основные функции: депонирующая (накопительная) и эвакуаторная. Своевременное поступление желчи в 12ПК важно, так как она способствует:
- дальнейшей обработке пищи, расщеплению жиров и усвоению витаминов;
- перистальтике кишечника и выработке слизи;
- обеззараживанию и предотвращению заражения гельминтами за счет создания щелочной среды;
- выработке кишечных ферментов и гормонов.
Если желчь не поступает вовремя в 12-перстную кишку, она застаивается. В дальнейшем развиваются желчнокаменная болезнь, холецистит, закупориваются протоки. Эти состояния – показания к удалению органа.
Желчный пузырь важен, но когда он поражен, рецидивы случаются постоянно, а консервативная терапия малоэффективна. Поэтому его предпочитают удалить. Как будет жить пациент без желчного пузыря, во многом зависит от соблюдения послеоперационных и профилактических мер.
Как работает организм после удаления
Желчный пузырь участвует в пищеварении, и пациенты не понимают, можно ли и как жить без него. Но у человека хорошо развиты компенсаторные функции. В организме после удаления происходят три существенных изменения:
- Желчь не скапливается, а непрерывно поступает в 12ПК.
- Увеличивается давление на печеночные протоки.
- Меняется баланс микрофлоры кишечника, так как секрет не очищается в желчном пузыре от излишков воды, хлора и натрия.
Удаление желчного пузыря приводит к ряду последствий, и жизнь после экстракции меняется. Больным грозит:
- нарушение стула – из-за недостаточной концентрации желчи обработка пищи ухудшается, развиваются диарея, запор, метеоризм, тошнота, несварение;
- нехватка полезных элементов – проблемы с пищеварением приводят к недостатку жирорастворимых витаминов, жирных кислот, антиоксидантов, кишечных белков и гормонов;
- раннее старение – уменьшается абсорбция антиоксидантов, содержащихся в овощах: каротиноида, ликопена, лютеина.
В целом продолжительность жизни без желчного пузыря не уменьшается. Больной вынужден правильно питаться, распрощаться с алкоголем и никотином, избегать умственного, физического и психологического переутомления. Все это положительно сказывается на здоровье.
Жизнь без желчного накладывает некоторые ограничения и сопровождается дискомфортом, однако существенных проблем не доставляет.
Что делать сразу после операции
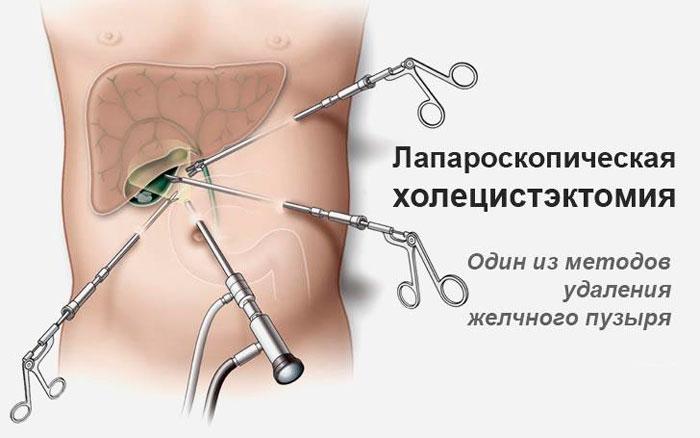
Есть 2 основных метода проведения экстирпации желчного пузыря – открытая (полостная) операция и лапароскопическая холецистэктомия. После первого типа восстановление сложное и занимает 6-8 недель, при втором реабилитация проходит быстрее – за 10-14 дней.
Вне зависимости от способа, если удаляется желчный пузырь, возникают стандартные последствия:
- временные боли в месте вмешательства;
- тошнота от введения анестезии;
- диарея и повышенное газообразование из-за нехватки желчи;
- усталость, сонливость, слабость.
Если желчный пузырь вырезали посредством лапароскопии, появляются временные последствия в виде сдавливании диафрагмы и иррадиирующих болей в животе из-за введения газа.
Первые сутки реабилитации тяжелые. Пациентам с удаленным желчным пузырем запрещается есть и пить (можно смачивать губы или полоскать рот травяным отваром), вставать и переворачиваться 5-7 часов, мыться из-за риска намочить швы.
Через несколько часов можно встать и пройти по палате. Нельзя резко двигаться, наклоняться, поднимать тяжести. На вторые сутки разрешают пить чистую негазированную воду или несладкий отвар шиповника – объем жидкости до 1 л. Запрет на купание снимают на третий день, однако швы нужно закрыть водонепроницаемым материалом.
Первые сутки после удаления желчного пузыря пациент проводит в палате интенсивной терапии. На вторые его переводят в общую палату. Находиться в стационаре нужно 3-14 дней.
Негативные последствия удаления желчного
Умеренные боли в области живота после удаления желчного пузыря – нормальные последствия, которые снимаются анальгетиками. Насторожиться стоит, если ощущения интенсивные, не купируются обезболивающими, присоединились тошнота и температура.
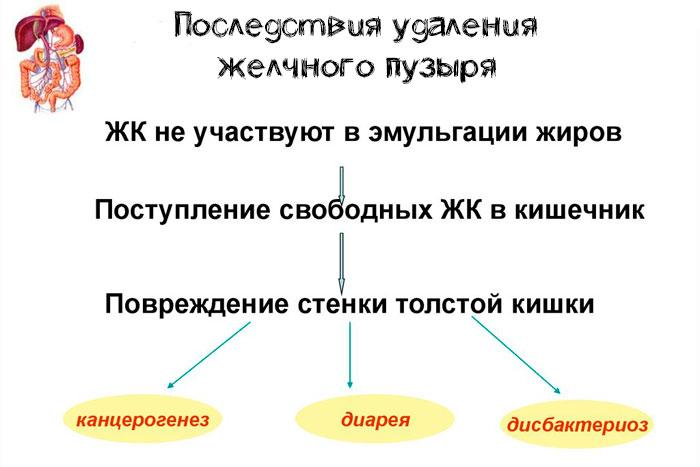
Помимо первичных последствий, существует риск послеоперационных осложнений второй очереди. Это состояние получило название синдрома ПХЭС (постхолецистэктомический). Он проявляется:
- нарушением пищеварения. Характерны тошнота, рвота, изжога, метеоризм;
- болями в правом подреберье, которые усиливаются после употребления жирной пищи;
- пожелтением кожи и склер, зудом;
- закупоркой камнями желчных протоков или их воспалением – холангитом;
- панкреатитом или гепатитом. Они развиваются из-за нарушения оттока желчи.
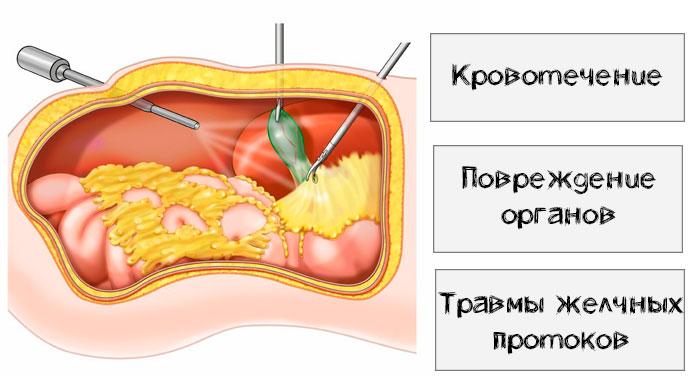
Вторичные осложненные состояния после холецистэктомии развиваются у 5-40% пациентов.
Осложнения после удаления желчного у мужчин ограничиваются этим списком. Но последствия у женщин еще бывают связаны с беременностью после удаления пузыря.
Операция по удалению желчного пузыря не влияет на способность зачать и выносить ребенка, но накладывает ряд ограничений. Так, из последствий возможен зуд во время беременности, высокий риск образования камней из-за смещения плодом органов брюшины, желтуха у женщины и ребенка. Чтобы избежать негативных явлений, будущей матери нужно принимать поливитамины, противоаллергические препараты и антиоксиданты. Медикаменты и дозировку назначает врач.
Перечисленные осложнения возникают при любом методе проведения холецистэктомии. Но у каждого типа операции – лапароскопического и полостного – есть свои последствия.
Осложнения лапароскопической холецистэктомии
Это малоинвазивный метод, его предпочитают из-за высокой точности, малой площади повреждения и быстрого восстановления. Однако не исключен риск осложнений после удаления лапароскопическим методом. Возможны:
- механические повреждения тканей, органов и сосудов;
- термические травмы, которые возникают из-за чрезмерной электрокоагуляции, приводят к нарушению кровообращения билиарной системы;
- истечение желчи в результате повреждений протоков или желчного пузыря – провоцирует перитонит;
- выпадение камней из желчного пузыря – происходит во время резекции ложа или извлечении органа из брюшной полости.
Последствия при удалении путем лапароскопии связаны с недостаточным обзором. Врач видит только определенный участок и не может оценить состояние в целом.
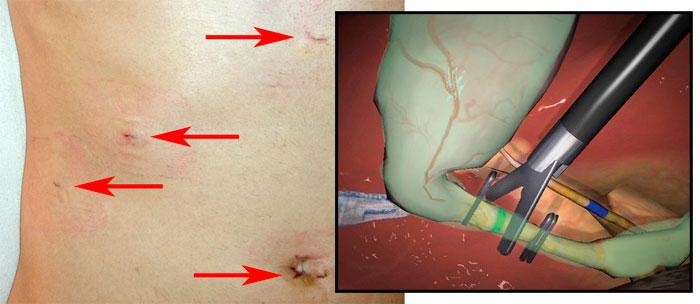
Осложнения открытой холецистэктомии
Осложнения после удаления желчного пузыря классическим полостным способом такие же, как и при лапароскопическом методе. Дополнительно встречаются кровоизлияние внутрь брюшной полости, нагноение швов, тромбоэмболия, инфицирование.
К последствиям относят формирование спаек. После лапароскопии раны быстро затягиваются, рубцы заживают или малозаметны. А при открытой операции остаются шрамы.
Реабилитация после холецистэктомии
Средние сроки полного восстановления после удаления желчного пузыря – полгода. Но жесткие ограничения накладывают в первые дни, когда состояние пациента наиболее тяжелое.
Есть разрешают на третьи сутки. Помимо травяного отвара и некрепкого чая вводят нежирный кефир и йогурт. На 4-й день добавляют соки, морсы, жидкое пюре из картофеля, легкий бульон. Употреблять пищу начинают порциями по 30-50 мл с увеличением до 200 мл. На 5-й день можно съесть ржаные сухари, подсушенный хлеб, галетное печенье.
С 6-го дня в меню добавляют перетертые каши, измельченное нежирное мясо и рыбу, овощные пюре, супы. Такую диету соблюдают 2 недели.
В восстановительный период после экстирпации желчного пузыря придерживаются следующих советов:
- не поднимают тяжести свыше 5-7 кг в течение 1-2 месяцев;
- исключают занятия спортом и тяжелую работу по дому;
- не посещают солярий, баню, бассейн, не принимают ванну, избегают солнцепека и переохлаждения;
- 1-2 месяца под запретом интимная близость;
- носят мягкое белье, пока швы не затянутся.
К работе, не связанной с физическим трудом, возвращаются через 1 неделю после лапароскопии и через 2 – при полостной операции.
Как быстро восстанавливаются после удаления желчного пузыря, зависит от метода операции, наличии или отсутствии осложнений, системных патологий, индивидуальных особенностей больного.
Послеоперационная реабилитация включает прием медикаментов. В первые 3 дня принимают антибиотики для предотвращения инфекции. Врач назначает анальгетики и спазмолитики, чтобы снять боль. Для восстановления выработки желчи показаны желчегонные препараты – Холосас, Аллохол. Для нормальной работы печени и пищеварения рекомендуют принимать гепатопротекторы (Карсил, Урсофальк) и ферменты (Мезим, Фестал).
Питание без желчного – диета, меню и отдельные рецепты
Когда удален желчный пузырь, во избежание последствий придерживаются диетического стола №5. Едят 5-7 раз в день небольшими порциями через равные промежутки времени. Температура пищи – 20-60°С, консистенция – мягкая или пюреобразная.
Рацион питания жестко ограничен. Список разрешенных и запрещенных продуктов изложен ниже.
| Можно | Нельзя |
| Диетическое мясо – курица, говядина, телятина, индейка, крольчатина, рыба | Жирное мясо и рыба, субпродукты, яйца |
| Супы на легком мясном или овощном бульоне без зажарки | Наваристые бульоны |
| Отварные, запеченные блюда, приготовленные в мультиварке | Жареное, копченое, острое, маринованное |
| Сладкие фрукты, печеные овощи | Кислые фрукты и ягоды, сырые овощи, грибы |
| Кисломолочные продукты без сахара | Сырое молоко, сладкие йогурты и творожные смеси |
| Мармелад, мед, зефир, повидло | Выпечка, кондитерские изделия, шоколад |
| Сухари, галетное печенье, вчерашний или подсушенный хлеб | Свежие хлебобулочные изделия, черный хлеб |
| Травяные отвары, некрепкий черный или зеленый чай, соки, морсы, компоты | Крепкий чай, кофе, какао |
| Каши | Манная крупа |
Ограниченно употребляют сахар (25 г/сутки), растительное масло (50 г/день), сливочное масло (20 г/сутки).
Примеры готовых блюд:
- Паста из творога. 80 г творога растирают, перемешивают с двумя ч.л. сметаны и меда, добавляют четверть яблока.
- Ленивые вареники. В 200 г творога добавляют яйцо, 15 г сахара, щепотку соли и 30 г муки. Замешивают тесто и формируют вареники.
- Крем-суп из курицы и овощей. Куриное филе и любые овощи отваривают на воде до готовности. Сваренные ингредиенты измельчают блендером, разбавляют бульоном, добавляют соль и сметану, доводят до кипения.

Диета строгая, но на ней возможно жить после экстирпации желчного пузыря. Спустя несколько месяцев или пару лет ее можно разнообразить. При заболеваниях пищеварительной системы режим питания соблюдают постоянно.
Важные советы
После холецистэктомии образ жизни меняется. Это касается режима питания, физических нагрузок и ежедневных привычек. Пациентам необходимо:
- ежедневно обращать внимание на консистенцию стула и регулярность дефекации;
- женщинам не планировать детей в первый год после операции;
- принимать поливитаминные комплексы.
Ферменты и гепатопротекторы – верные спутники. Их пьют курсами под контролем лечащего врача. По совету гастроэнтеролога включают растительные добавки: рыльца кукурузы, отвары бессмертника, шиповника.
Можно ли пить алкоголь
Спиртные напитки – табу для пациентов с удаленным желчным пузырем. В норме этиловый спирт перерабатывается печенью. Она выделяет его вместе с желчью в желчный пузырь, где он нейтрализуется.
Когда желчный пузырь удален, этиловый спирт вместе с желчью попадает сразу в 12ПК и провоцирует расстройство пищеварения. К тому же употребление алкоголя приводит к осложнениям: образованию камней, циррозу, панкреатиту, воспалению желчных протоков.
Медики рекомендуют в первый год полностью отказаться от спиртных напитков после после операции, а лучше – навсегда. Человек может жить без алкоголя, тем более у пациентов с удаленным желчным пузырем развивается непереносимость этилового спирта.

Гимнастика и физическая активность
Сколько живут люди без желчного пузыря, во многом зависит от ЛФК. Первые 1-2 месяца нагрузки запрещены. Затем рекомендованы прогулки пешком, увеличивая дистанцию каждый день. Спустя пару недель добавляют дыхательные упражнения и занятия на разминку суставов.
Больным назначают лечебную гимнастику. Ее проводят дома либо в реабилитационном центре. Комплекс нормализует отток желчи и перистальтику.
Занятия длятся 10-15 минут. Их выполняют утром до завтрака и вечером за час до сна. Гимнастика состоит из разминки, дыхательных упражнений, комплекса для укрепления брюшных мышц. ЛФК делают плавно, в первые дни выполняют 2-5 подходов, с каждой неделей увеличивая количество повторов. Через несколько месяцев добавляют утяжелители, спортивную ходьбу, лыжи. Ходьба по лестнице – отличное дополнение к ежедневным занятиям.
Очень важно следить за самочувствием. Если во время занятий появились боль, дискомфорт, тошнота, поднялась температура, упражнения прекращают и обращаются к врачу.
Пациенты без желчного пузыря, которые делают гимнастику, качественно проживают много лет. Главное – заниматься каждый день.
У жизни без желчного пузыря есть плюсы и минусы. Придется ограничить питание, отказаться от приятных, но вредных привычек, снизить физические нагрузки. Но правильная диета и здоровый образ жизни помогут похудеть, улучшат самочувствие и внешность.
Главное преимущество операции – исключение рецидивов заболеваний билиарной системы. Желчный пузырь не жизненно важен, поэтому его удаление не убавит годы жизни. Сколько живут люди без органа, зависит от наличия других хронических патологий, присутствия/отсутствия пагубных пристрастий, избыточного веса.
Видео
Последствия хирургического лечения желчнокаменной болезни
 Существуют различные подходы к лечению желчнокаменной болезни, но ни один из них не является радикальным. До настоящего времени основным методом лечения данной патологии является хирургический – холецистэктомия (удаление желчного пузыря).
Существуют различные подходы к лечению желчнокаменной болезни, но ни один из них не является радикальным. До настоящего времени основным методом лечения данной патологии является хирургический – холецистэктомия (удаление желчного пузыря).
В связи с усовершенствованием методики хирургических вмешательств статус «золотого стандарта» оперативного лечения получила лапароскопическая холецистэктомия. В хирургических стационарах среди больных с хроническими заболеваниями органов брюшной полости больные желчнокаменной болезнью занимают первое место.
Есть мнение, что выполненная по показаниям своевременная холецистэктомия в условиях высококвалифицированного хирургического стационара приводит к полному выздоровлению и полному восстановлению трудоспособности и качества жизни у большинства пациентов. В связи с этим в хирургических кругах иногда считается, что пациенты, перенесшие удаление желчного пузыря, не нуждаются в какой-либо дальнейшей медикаментозной «вспомогательной коррекции», т.е. само по себе удаление желчного пузыря автоматически устраняет факторы, способствующие прогрессированию заболевания.
Однако удаление желчного пузыря не является окончательным этапом в лечении больных желчнокаменной болезнью. Операция избавляет больного от пораженного желчного пузыря, но не приводит к нормализации физико-химического состояния желчи, что может быть причиной образования новых конкрементов (камней).
Несмотря на совершенствование техники оперативного лечения, холецистэктомия не приносит облегчения больным в 5-60 % случаев. Абдоминальные боли и диспепсические расстройства, которые сохраняются или возобновляются после удаления желчного пузыря, связывают с так называемым постхолецистэктомическим синдромом.
Постхолецистэктомический синдром
 Термин «постхолецистэктомический синдром» впервые появился в американской литературе в 30-х годах XX века. Трактовка причин болей и диспепсических расстройств после холецистэктомии постоянно менялась. Вначале их объясняли техническими погрешностями во время операции, затем – развитием спаечного процесса в зоне операции. В последующем стали придавать большее значение выпадению функций желчного пузыря и его регулирующих влияний на сфинктерный аппарат желчных путей.
Термин «постхолецистэктомический синдром» впервые появился в американской литературе в 30-х годах XX века. Трактовка причин болей и диспепсических расстройств после холецистэктомии постоянно менялась. Вначале их объясняли техническими погрешностями во время операции, затем – развитием спаечного процесса в зоне операции. В последующем стали придавать большее значение выпадению функций желчного пузыря и его регулирующих влияний на сфинктерный аппарат желчных путей.
Несмотря на то, что постхолецистэктомический синдром включен в современную классификацию болезней МКБ-10 (шифр К 91.5), точного понимания сущности этого синдрома нет и до настоящего времени. Большинство авторов считают этот термин собирательным понятием, объединяющим многие патологические состояния, которые могут отмечаться в различные сроки после удаления желчного пузыря.
В ряде работ предлагается выделять «истинный» постхолецистэктомический синдром, включающий только рецидивы печеночной колики, возникающие после холецистэктомии, выполненной с техническими погрешностями и ошибками, и «ложный» – предполагающий функциональные расстройства, возникшие в связи с удалением желчного пузыря, а также ранее существовавшие заболевания гепатопанкреатобилиарной зоны, обострение и прогрессирование которых было вызвано оперативным вмешательством.
Согласно положениям Римского консенсуса по функциональным расстройствам органов пищеварения 1999 г., термином «постхолецистэктомический синдром» принято обозначать дисфункцию сфинктера Одди, обусловленную нарушением его сократительной активности и препятствующую нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку при отсутствии органических препятствий.
Постхолецистэктомический синдром можно определить как совокупность функциональных и/или органических изменений, связанных с патологией желчного пузыря или протоковой системы, возникших после холецистэктомии или усугубленных ею, либо развившихся самостоятельно в результате технических погрешностей ее выполнения. С этой точки зрения все причины, вызывающие постхолецистэктомический симптомокомплекс, укладываются в 4 основные группы:
- диагностические ошибки, допущенные на дооперационном этапе во время обследования больного и/или во время операции;
- технические погрешности и тактические ошибки, допущенные при проведении операции;
- функциональные нарушения, связанные с удалением желчного пузыря;
- обострение или прогрессирование существовавших до операции заболеваний гепатопанкреатобилиарной зоны.
Что касается диагностических ошибок, допущенных на дооперационном этапе, то их причиной, как правило, является недостаточное обследование больного при типичных признаках желчнокаменной болезни. Между тем, тесная анатомо-функциональная взаимосвязь органов гастродуоденальной и гепатопанкреатобилиарной зон является предпосылкой к тому, что у большинства больных желчнокаменной болезнью в 60-80 % случаев имеются различные сопутствующие поражения печени, желчных путей, поджелудочной железы, двенадцатиперстной кишки и желудка, характер и степень выраженности которых зависит как от длительности камненосительства, так и от его осложнений. Удаление желчного пузыря приводит к обострению данных заболеваний.
Технические погрешности, допущенные при проведении холецистэктомии, лежат в сфере компетенции хирургов. Что касается функциональной и структурной перестройки органов пищеварения после удаления желчного пузыря, то именно они определяют необходимость активного медицинского наблюдения за пациентом и реабилитационных мероприятий, как на ранних этапах, так и в отдаленные сроки после операции.
Функциональные и органические изменения
Холагенная диарея. Удаление желчного пузыря, приводит к увеличению холереза как за счет кислотозависимой, так и за счет кислотонезависимой фракции желчи уже через 2 недели после операции. Повышение холереза основная причина холагенной диареи после холецистэктомии.
Изменения в печени. Практически у всех больных желчнокаменной болезнью имеются дистрофические и воспалительные изменения в печени – от жировой инфильтрации до картины хронического гепатита. Именно морфо-функциональные нарушения гепатоцита являются основой формирования литогенной желчи и определяют степень билиарной недостаточности, которая сохраняется у всех больных в течение длительного времени и в послеоперационном периоде. Дефицит желчных кислот после удаления желчного пузыря в определенной степени восполняется за счет ускорения их энтерогепатической циркуляции, которая при этом сопровождается подавлением синтеза желчных кислот, что приводит к дисбалансу соотношения основных компонентов желчи и нарушению ее солюбилизирующих свойств.
 Поражения желчных путей. Функциональные и органические поражения внепеченочных желчных путей является неотъемлемым атрибутом желчнокаменной болезни. После холецистэктомии эта патология может выходить на первый план и являться доминирующей клинической симптоматикой.
Поражения желчных путей. Функциональные и органические поражения внепеченочных желчных путей является неотъемлемым атрибутом желчнокаменной болезни. После холецистэктомии эта патология может выходить на первый план и являться доминирующей клинической симптоматикой.
Дисфункция сфинктерного аппарата желчевыводящих путей – один из факторов холелитиаза, при этом ведущая роль принадлежит нарушению координации моторики сфинктеров Люткенса и Одди. В зависимости от локализации нарушения оттока секрета и характера болей после холецистэктомии выделяют билиарный, панкреатический и сочетанный типы дисфункции сфинктера Одди. Частота дисфункций после удаления желчного пузыря, по данным различных авторов, колеблется в широких пределах: от 0,1 % до 15-25 % случаев у оперированных больных.
Единого мнения о характере функционального состояния сфинктера Одди после холецистэктомии нет. Некоторые авторы указывают на повышение тонуса сфинктера большого дуоденального сосочка и этим объясняют расширение холедоха после операции, связывая механизм гипертонуса сфинктера Одди с выключением регулирующей роли сфинктера Люткенса и мышечной активности желчного пузыря. В норме тонус сфинктера Одди рефлекторно понижается во время сокращения желчного пузыря, что обеспечивает координированную деятельность всего сфинктерного аппарата желчевыводящих путей, а функционирующий желчный пузырь модулирует ответ сфинктера Одди на влияние холецистокинина. Экспериментально установлено уменьшение реакции сфинктера Одди на холецистокинин после холецистэктомии. При функционирующем желчном пузыре объем желчи в холедохе равен примерно 1,5 мл, через 10 дней после операции – 3 мл, а через год – до 15 мл – наступает т.н. «эффект опузыривания» общего желчного протока как следствие гипертонуса сфинктера Одди после удаления желчного пузыря.
Другие авторы, напротив, считают, что в результате удаления желчного пузыря развивается недостаточность сфинктера Одди, т.к. он не может длительно противостоять высокому секреторному давлению желчи. Этот факт они объясняют тем, что в норме данное сфинктерное кольцо способно выдержать давление в пределах 300-350 мм вод. ст. При отсутствии резервуарной функции желчного пузыря и сохраняющемся суточном дебите желчи в общем желчном протоке создается давление более чем на порядок превышающее должное, которое способно преодолеть даже гипертонус сфинктера Одди.
Эти противоречия, вероятно, связаны, как с несовершенством методов исследования, так и с изучением функционального состояния сфинктера Одди в различные сроки после удаления желчного пузыря без учета механизмов адаптации к работе сфинктерного аппарата без участия желчного пузыря.
В то же время остается невыясненным вопрос о том, способны ли изменения давления в холедохе играть роль в развитии постхолецистэктомического синдрома. С клинической точки зрения моторная дисфункция сфинктера Одди является одной из причин острой или хронической абдоминальной боли и диспепсического синдрома в послеоперационном периоде.
При этом клиническая картина зависит от того, какой сфинктер или группа сфинктеров вовлечены в патологический процесс. Дисфункция сфинктера холедоха приводит к билиарной гипертензии, холестазу и сопровождается болями в правом подреберье или эпигастрии. При преобладании дисфункции сфинктера панкреатического протока появляется клиника, характерная для патологии поджелудочной железы. Однако полиморфизм клинической симптоматики не всегда позволяет выделить тип функционального нарушения сфинктерного аппарата билиарной системы, и затрудняет дифференциальный диагноз постхолецистэктомического синдрома.
Стеноз. Органические поражения внепеченочных желчных протоков и сфинктера Одди лежат в основе вторичной его дисфункции и наиболее часто проявляются стенозом, сформировавшимся вследствие их травматизации при миграции микролитов. Клинически они могут длительно не проявляться и не отражаться на результатах лабораторных исследований. При значительных по протяженности стриктурах возникают боли, напоминающие желчные колики и появляется желтуха.
Камни желчных протоков. Другим проявлением органического поражения желчевыводящих путей являются камни желчных протоков – наиболее частая причина рецидива истинных желчных колик после удаления желчного пузыря. При этом «новые» конкременты практически неотличимы от резидуальных. Описан случай образования конкрементов в культе пузырного протока спустя 25 лет после ХЭ (Mergener К. et al., 1999). Такие проявления постхолецистэктомического синдрома как рубцовые стриктуры и холедохолитиаз требуют, в первую очередь, хирургического лечения.
Панкреатит. Холецистэктомия более всего отражается на функции поджелудочной железы. Частота выявления панкреатита при желчнокаменной болезни – 70-85 %. Это послужило основанием для появления термина «билиарный панкреатит», причем, чем длительнее камненосительство, тем чаще встречается хронический панкреатит и тяжелее его течение. Ведущими факторами, способствующими его развитию, являются функциональные и органические изменения в сфинктерном аппарате большого дуоденального сосочка (БДС), приводящие к появлению патологических билиопанкреатических рефлюксов.
При билиарном панкреатите в первую очередь страдает внешнесекреторная функция поджелудочной железы, что проявляется снижением объема панкреатического сока, дебита бикарбонатов и ферментов (у 77,8 % больных желчнокаменной болезнью уже на ранних ее стадиях). По данным ряда исследователей, нередко причиной неудачных исходов холецистэктомии являются именно стойкие нарушения ферментообразующей функции железы, клинически проявляющиеся рецидивирующим панкреатитом, признаками мальабсорбции и мальдигестии.
Хронический билиарный панкреатит, в свою очередь, влияет на диффузную эндокринную систему желудочно-кишечного тракта (APUD или ПОДПА – систему) с развитием гиперплазии и гипертрофии апудоцитов, продуцирующих серотонин, и гипоплазии с функциональным истощением гастрин-секретирующих клеток, вследствие чего у лиц с постхолецистэктомическими расстройствами отмечается достоверное увеличение апоптоза эпителиоцитов желудка. В то же время Gloor В. и соавт. (2003) свидетельствуют, что своевременная и технически грамотно выполненная холецистэктомия с полным восстановлением проходимости желчных и панкреатических протоков способствует устранению или снижению степени выраженности патологических изменений в поджелудочной железе.
Дискинезия двенадцатиперстной кишки. Несмотря на то, что дуоденальная патология непосредственно не оказывает особого влияния на исход холецистэктомии, дуодениту принадлежит важная роль в развитии функциональных нарушений после операции. Нередко именно дискинетические расстройства двенадцатиперстной кишки являются основной причиной формирования диспепсических расстройств и абдоминальной боли.
Ряд исследователей придают большое значение второй фазе периодической моторной деятельности двенадцатиперстной кишки для адекватного желчевыделения: чем активнее она протекает, тем быстрее раскрывается сфинктер Одди. Вместе с тем другой ряд исследователей трактует изменения моторно-эвакуаторной функции двенадцатиперстной кишки как вторичные, возникающие вследствие патологических висцеро-висцеральных рефлексов при длительно существующих заболеваниях желчного пузыря, поджелудочной железы и желудка, что способствует дегенеративно-дистрофическим изменениям в интрамуральном аппарате двенадцатиперстной кишки и нарушениям ее моторики.
Дуоденогастральный рефлюкс. При замедленной перистальтике двенадцатиперстной кишки создаются предпосылки для повышения интрадуоденального давления и возникновения дуоденогастрального рефлюкса. Послеоперационноый период у пациентов с дуоденогастральным рефлюксом, существовавшим и до холецистэктомии, протекает тяжелее из-за выраженных нарушений моторно-эвакуаторной функции двенадцатиперстной кишки.
Дуоденогастральный рефлюкс является предметом детального изучения многих исследований. Сама холецистэктомия не является причиной ни гастроэзофагеального рефлюкса, ни дуоденогастрального рефлюкса, и если данные патологические состояния не сформировались до операции, то в послеоперационном периоде они не возникают. По сведениям ряда исследователей после удаления желчного пузыря в плазме крови в несколько раз повышается уровень холецистокинина, который, в свою очередь, ослабляет тонус нижнего пищеводного сфинктера и привратника, способствуя возникновению гастроэзофагеального рефлюкса и дуоденогастрального рефлюкса.
По данным ряда исследователей имеется определенная зависимость дуоденогастрального рефлюкса от интрагастрального давления, запирательной функции привратника и уровня холецистокинина: понижение интрагастрального давления, нарушение функции (слабость) пилоруса и недостаточное выделение холецистокинина являются основными патогенетическими моментами в формировании дуоденогастрального рефлюкса.
Билиарная гипертензия после холецистэктомии
А.А. Ильченко
Центральный научно-исследовательский институт гастроэнтерологии, Москва
Диагностика желчнокаменной болезни (ЖКБ) на стадии сформировавшихся желчных камней является причиной высокой оперативной активности при этом заболевании. Несмотря на внедрение в клиническую практику менее инвазивных, по сравнению с полостной холецистэктомией, технологий, у части пациентов возникают так называемые постхолецистэктомические расстройства, обозначаемые как постхолецистэктомический синдром (ПХЭС).
Несмотря на то, что ПХЭС включён в современную классификацию болезней МКБ-10 (шифр К.91.5), точного понимания сути этого синдрома нет и до настоящего времени.
Согласно Римскому консенсусу по функциональным расстройствам органов пищеварения 1999 г. термином «постхолецистэктомический синдром» принято обозначать дисфункцию сфинктера Одди, обусловленную нарушением его сократительной функции, препятствующую нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку при отсутствии органических препятствий. С подобной трактовкой можно было бы согласиться, если бы не существовало тесной анатомо-функциональной взаимосвязи между билиарной системой и другими органами пищеварения. Удаление желчного пузыря – мера исключительно вынужденная, а патология желчного пузыря, приведшая к холецистэктомии, как правило, развивается длительно и практически всегда ассоциирована с патологией других органов пищеварения, в первую очередь, панкреатодуоденальной зоны. Поэтому трудно представить, что утрата желчного пузыря не отразится на течении патологических процессов, развившихся до операции.
Исходя из этого, с практической точки зрения целесообразно рассматривать ПХЭС с позиции учёта всего комплекса патологических состояний, ассоциированных с длительно протекающим холелитиазом. В связи с этим можно выделить следующие основные группы причин развития ПХЭС:
Первая группа
Функциональные нарушения билиарного тракта – непременный атрибут холелитиаза, обеспечивающие его формирование и прогрессирование. При ЖКБ наиболее главными являются нарушения в скоординированной работе сфинктера Люткенса и сфинктера Одди. Поэтому диагностика билиарных дисфункций и их коррекция до операции способствуют более быстрой адаптации организма к потере функций желчного пузыря. Недооценка функциональных нарушений на дооперационном этапе в раннем послеоперационном периоде может проявиться различными вариантами дисфункций сфинктера Одди (билиарный, панкреатический или смешанный типы).
Структурные изменения билиарного тракта обычно представлены стенозом терминального отдела общего желчного протока или стенозирующим папиллитом, которые формируются вследствие травматизации слизистой оболочки и непосредственно сфинктерного аппарата мигрирующими микролитами или мелкими конкрементами. Выявление этих и других изменений (холангит, холедохолитиаз и другие) до операции приобретает особое значение, так как определяет не только клинические симптомы, но и тактику ведения больного, готовящегося к холецистэктомии.
Оперативное вмешательство является последним диагностическим этапом, поэтому уточнение характера патологических изменений во время операции необходимо провести в максимально полном объёме с использованием современных методов интраоперационной диагностики – интраоперационной холангиографии, прямой холангиоскопии, а в последние годы и интраоперационной сонографии. В результате подобных диагностических ошибок патологические изменения в общем желчном протоке остаются нераспознанными. Так, например, неполноценное исследование желчных протоков без рентгенологического контроля за их состоянием приводит к тому, что в половине случаев остаются незамеченными камни в протоковой системе [1].
Вторая группа
Эта группа ошибок является основной причиной формирования так называемого «истинного постхолецистэктомического синдрома» и повторных операций на желчных путях, и они подробно изложены в практических руководствах по хирургии.
Третья группа
После холецистэктомии развивается гипертонус сфинктера Одди, и в первый месяц после операции эта патология отмечается у 85,7 % больных [1]. Гипертонус сфинктера Одди клинически сопровождается билиарной гипертензией, холестазом, болями в правом подреберье, а в ряде случаев развивается клиника обострения билиарного панкреатита.
Механизм развития гипертонуса сфинктера Одди связан с выключением регулирующей роли сфинктера Люткенса и мышечной активности желчного пузыря, так как тонус сфинктера Одди рефлекторно понижается во время сокращения желчного пузыря, что обеспечивает скоординированную деятельность всего сфинктерного аппарата желчных путей. Экспериментально установлено уменьшение реакции сфинктера Одди в ответ на холецистокинин после холецистэктомии. Дисфункция сфинктера Одди в виде его гипертонуса после холецистэктомии обычно носит временный характер и проявляется, как правило, на протяжении первых месяцев после операции. Моторная дисфункция сфинктера Одди является одной из причин формирования острой или хронической абдоминальной боли и диспепсического синдрома в послеоперационном периоде. Следует отметить, что качество жизни после холецистэктомии у больных со сниженной до операции сократительной функцией желчного пузыря лучше, чем с сохранённой или повышенной. Известно, например, что у больных с так называемым отключённым желчным пузырем, дилятация общего желчного протока отмечается редко как до операции, так и после неё. Постепенная адаптация приводит к тому, что у таких больных редко развивается и ПХЭС.
Четвертая группа
Хроническая билиарная недостаточность, сопутствующая ЖКБ, сохраняется и после удаления желчного пузыря. Причём эти изменения выявляются у 100 % больных в первые 10 суток после операции и у 81,2 % пациентов не исчезают после холецистэктомии на протяжении длительного времени [2]. Примечательно, что хроническая билиарная недостаточность определяется уже на начальных стадиях ЖКБ. Так, по данным О.В. Делюкиной [3], у больных с билиарным сладжем в виде взвеси гиперэхогенных частиц она была выявлена в 91,7 %, причём в 50 % лёгкой, а в 41,7 % – средней степени тяжести.
Дефицит желчных кислот после холецистэктомии до определённой степени восполняется за счёт ускорения их энтерогепатической циркуляции. Однако значительное ускорение энтерогепатической циркуляции сопровождается подавлением синтеза желчных кислот, что приводит к дисбалансу соотношения основных её компонентов и нарушению солюбилизирующих свойств желчи.
Удаление желчного пузыря сопровождается перестройкой процессов желчеобразования и желчевыделения. По данным Р.А. Иванченковой [4], после холецистэктомии увеличивается холерез как за счёт кислотозависимой, так и кислотонезависимой фракций. Увеличение желчевыделения наступает уже через 2 недели после холецистэктомии. Повышение холереза – основная причина холагенной диареи после холецистэктомии.
Среди органов гепатопанкреатодуоденальной зоны удаление желчного пузыря более всего отражается на функции поджелудочной железы. Развитию хронического панкреатита билиарной этиологии способствуют часто встречающиеся функциональные нарушения (дисфункции сфинктерного аппарата желчных путей) или органические заболевания протоковой системы, нарушающие пассаж желчи (сужение, сдавление кистами или увеличенными лимфоузлами, камни с локализацией в терминальном отделе общего желчного протока, воспалительные процессы, особенно с локализацией в его дистальных отделах и др.). В связи с этим обострение хронического панкреатита у больных, перенесших холецистэктомию, встречается достаточно часто. По данным В.А. Зориной с соавт. [5], обследовавших больных через 4-10 дней после холецистэктомии, у 85 % больных отмечено повышенное содержание в сыворотке крови b1-антитрипсина, причём в 34,7 % случаев показатели превышали норму более чем в 2 раза.
Хронический гастрит является наиболее распространённой патологией органов пищеварения. Считается, что роль его в формировании постхолецистэктомического синдрома невелика и определяется в основном функциональными нарушениями. Хронический гастрит часто ассоциирован с Helicobacter pylori (НР). В связи с этим обсуждается вопрос о необходимости проведения антихеликобактерной терапии у больных, которым предстоит холецистэктомия. Накопленный опыт, свидетельствующий о том, что антихеликобактерная терапия, проведённая, например, перед резекцией желудка, значительно снижает число послеоперационных осложнений, убеждает в такой же необходимости и в связи с предстоящей холецистэктомией.
В необходимости проведения антихеликобактерной терапии убеждают и последние исследования, свидетельствующие о возможной связи хеликобактерной инфекции с билиарной патологией и гепатобилиарным раком, в частности. По данным F. Fukuda и соавт. [6], обследовавших 19 больных гепатобилиарным раком и 19 больных с доброкачественными заболеваниями гепатобилиарной системы, с помощью ПЦР выявили хеликобактерную ДНК в образцах желчи соответственно в 52,6 % и 15,7 % случаев. Получены первые доказательства о наличии НР в желчи [7] и слизистой оболочке желчного пузыря у людей [8], а также данные экспериментальных исследований на животных, подтверждающие роль энтерогепатических хеликобактеров (H. bilis, H. hepaticus, H. rodentium) в билиарном литогенезе [9]. Решение вопроса о роли хеликобактеров в этиологии билиарной патологии может значительно изменить подходы к тактике ведения пациентов с заболеваниями желчевыводящих путей, в том числе и к вопросу профилактики постхолецистэктомического синдрома.
Хронический дуоденит и синдром избыточного бактериального роста (СИБР). Холецистэктомия сопровождается снижением бактерицидных свойств желчи, что приводит к избыточному бактериальному росту в двенадцатиперстной кишки. Этому способствует и снижение барьерной функции желудка, обусловленной гипосекрецией соляной кислоты. Хроническая билиарная недостаточность, снижение бактерицидных свойств желчи и присоединившийся СИБР приводят к существенному нарушению пищеварения, что обуславливает развитие соответствующей симптоматики и требует медикаментозной коррекции.
Таким образом, анализируя характер патологических процессов, связанных с холецистэктомией, можно дать следующее определение постхолецистэктомического синдрома: ПХЭС – совокупность функциональных и/или органических изменений, связанных с патологией желчного пузыря или протоковой системы, усугубленных холецистэктомией или развившихся самостоятельно в результате технических погрешностей её выполнения.
Подобное определение нацеливает врача на более тщательное обследование больных перед операцией с целью выявления различной сопутствующей патологии как органов пищеварения, так и других органов и систем, позволяет понять патогенетическую связь между оперативным вмешательством и развившейся клинической симптоматикой после него.
Анализ клинической симптоматики позволил выделить следующие варианты течения ПХЭС:
Результаты обследования 820 больных с ПХЭС показали, что наиболее часто по сравнению с другими встречается диспепсический вариант (рисунок).
Диагностика
Для диагностики ПХЭС применяют методы, позволяющие выявить функциональные и структурные нарушения билиарного тракта, протекающими как самостоятельно, так и в ассоциации с другими заболеваниями органов пищеварения. В качестве скрининговых используют лабораторные (определение уровней ГГТП, ЩФ, билирубина, АсАТ, АлАТ, амилазы) и инструментальные (УЗИ, ЭГДС) методы диагностики. В качестве дополнительных методов – эндоскопическую ретроградную холангиопанкреатикографию (ЭРХПГ), в т. ч. с манометрией сфинктера Одди, динамическую холесцинтиграфию, магнитно-резонансную холангиографию, эндоскопическую ультрасонографию, этапное хроматическое дуоденальное зондирование и другие методы.
Тщательное обследование больных ПХЭС с использованием высокоинформативных методов диагностики позволяет провести своевременную и адекватную коррекцию анатомо-функциональных нарушений, развившихся после удаления желчного пузыря или усугублённых холецистэктомией.
Лечение
В большинстве случаев консервативное лечение позволяет провести коррекцию основных патофизиологических нарушений при ПХЭС, однако в различные сроки после холецистэктомии могут появиться показания и для оперативного лечения.
Важное значение в раннем послеоперационном периоде имеет лечебное питание. Диетические рекомендации заключаются в частом (до 6 раз в день) и дробном питании. Необходимо ограничение жиров до 60-70 г в сутки. При сохранённой функции поджелудочной железы в рацион питания можно включать до 400-500 г углеводов в сутки. С целью адекватной функциональной адаптации органов пищеварения к выпадению функций желчного пузыря целесообразно как можно более раннее (в зависимости от сопутствующих заболеваний) расширение диеты. Основные принципы консервативной терапии заключаются в восстановлении нормального биохимического состава желчи, оттока желчи и панкреатического секрета в двенадцатиперстную кишку, а также в лечении заболеваний, ассоциированных с патологией билиарного тракта.
При наличии хронической билиарной недостаточности необходима заместительная терапия препаратами урсодеоксихолевой кислоты (УДХК). Наш опыт показывает, что применение УДХК в средней суточной дозе 10-15 мг на 1 кг массы тела эффективно уменьшает степень билиарной недостаточности и выраженность дисхолии. Доза и длительность лечения УДХК определяются степенью билиарной недостаточности и динамикой изменения холатохолестеринового коэффициента на фоне терапии.
Для обеспечения адекватного желчеоттока показаны миотропные спазмолитики: гимекромон – 200-400 мг 3 раза в день или мебеверина гидрохлорид по 200 мг 2 раза в день, или пинаверия бромид по 50-100 мг 3 раза в день в течение 2-4 нед.
Препараты указанной группы оказывают в основном спазмолитический эффект и не влияют на характер патологических изменений в печени. В связи с этим заслуживает внимания гепабене – комбинированный препарат растительного происхождения, состоящий из экстракта дымянки аптечной и экстракта расторопши пятнистой.
Экстракт дымянки лекарственной (Fumaria officinalis), содержащий алкалоид фумарин, оказывает желчегонное действие, обладает спазмолитическим действием, понижает тонус сфинктера Одди, облегчая поступление желчи в кишечник.
Экстракт плодов расторопши пятнистой (Fructus Silybi mariani) содержит силимарин – группу флавоноидных соединений, включающую изомеры: силибинин, силидианин и силикристин. Силимарин оказывает гепатопротективное действие: связывает свободные радикалы в ткани печени, обладает антиоксидантной мембраностабилизирующей активностью, стимулирует синтез белка, способствует регенерации гепатоцитов, нормализуя, таким образом, различные функции печени при острых и хронических заболеваниях печени. На фоне терапии гепабене стабилизируется биохимический состав желчи, уменьшается индекс насыщения холестерином пузырной желчи [10]. Двойной механизм действия гепабене (спазмолитический и гепатопротективный) делают его одним из препаратов выбора у больных ПХЭС. Назначают гепабене по 1-2 капсулы 3 раза в день, курс лечения – 1-3 мес.
При наличии синдрома избыточного бактериального роста назначают антибактериальные препараты – ко-тримоксазол, интетрикс, фуразолидон, нифуроксацид, ципрофлоксацин, эритромицин, кларитромицин, которые применяют в общепринятых дозах. Курс лечения – 7 дней. При необходимости проводится несколько курсов антибактериальной терапии со сменой препаратов в очередном курсе. Весьма перспективными в лечении СИБР могут стать не всасывающиеся антибиотики. Первые опыты применения рифаксимина в клинике показывают, что препарат нормализует бактериальную микрофлору, уменьшает симптомы дуоденальной гипертензии, что имеет важное значение и у больных ПХЭС. После антибактериального курса назначают пробиотики (бифиформ, бифидумбактерин, споробактерин и др.), пребиотики – хилак-форте, который нормализует кишечную микрофлору, стимулирует регенерацию повреждённых деконьюгированными желчными кислотами эпителиоцитов кишечной стенки.
Для связывания избытка желчных и других органических кислот, особенно при наличии холагенной диареи, показано применение алюминий-содержащих антацидов по 10-15 мл (1 пакетик) 3-4 раза в день через 1-2 ч после еды в течение 7-14 дней. По показаниям возможно применение ферментных препаратов (панкреатин и др.).
В позднем послеоперационном периоде может возникнуть ряд осложнений, требующих проведения повторных операций. Рецидив камней встречается достаточно редко и возникает при условии существования причин, способствующих их формированию (нарушение оттока желчи и секреция литогенной желчи). Камни общего желчного протока удаляют с помощью баллонной дилатации, папиллотомии или папиллосфинктеротомии. В ряде случаев эти операции сочетают с контактной литотрипсией. Рецидив стриктур, по данным Э.И. Гальперина [1], является наиболее частым осложнением и составляет 10-30 % после операций на рубцово-изменённых желчных протоках. Рестенозы большого дуоденального сосочка развиваются и после папиллосфинктеротомии, в связи с чем может возникнуть вопрос о целесообразности наложения холедоходуоденоанастомоза.
Профилактика
Мероприятия по профилактике заключаются в комплексном обследовании больных в процессе подготовки к операции с целью выявления и своевременного лечения в первую очередь заболеваний гепатопанкреатодуоденальной зоны. Технически грамотно и в полном объёме выполненная операция, при необходимости с применением интраоперационных диагностических методик, важна и направлена на профилактику послеоперационных осложнений и постхолецистэктомического синдрома в частности. Одним из основных условий профилактики ПХЭС является своевременно выполненное хирургическое вмешательство до развития осложнений заболевания, а также в необходимом объёме проведённая предоперационная подготовка с целью коррекции выявленных нарушений. Однако высокая оперативная активность при ЖКБ связана с высокими экономическими затратами здравоохранения (таблица). В связи с этим наиболее эффективным путём профилактики холелитиаза и, как следствие ПХЭС, является выявление и лечение больных ЖКБ на ранних (предкаменных стадиях). С этой целью Центральным НИИ гастроэнтерологии была разработана современная клиническая классификация ЖКБ:
I стадия – начальная или предкаменная: