Лактатдегидрогеназа (ЛДГ) общая
Лактатдегидрогеназа (ЛДГ) общая – внутриклеточный гликолитический фермент, который участвует в обратимом превращении лактата в пируват и содержится в большинстве тканей организма.
Дегидрогеназа молочной кислоты.
Синонимы английские
Lactate dehydrogenase, Total, Lactic dehydrogenase, LDH, LD.
УФ кинетический тест.
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Лактатдегидрогеназа (ЛДГ) – цинксодержащий внутриклеточный фермент, который катализирует окисление молочной кислоты в пируват и содержится практически во всех клетках организма. ЛДГ наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах.
Существует пять разных форм (изоферментов) ЛДГ, которые отличаются молекулярной структурой и расположением в организме. От того, какая из пяти преобладает, зависит основной способ окисления глюкозы – аэробный (до CO2 и H2O) или анаэробный (до молочной кислоты). Подобное различие обусловлено разной степенью родства того или иного изофермента и пировиноградной кислоты. Для миокарда и мозговой ткани основной является ЛДГ-1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ-1 и ЛДГ-2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ-3. ЛДГ-4 находится во всех тканях с ЛДГ-3, а также в гранулоцитах, плаценте и мужских половых клетках, в которых содержится и ЛДГ-5. Изоферментная активность в скелетных мышцах (в порядке убывания): ЛДГ-5, ЛДГ-4, ЛДГ-3. Для печени наиболее характерен изофермент ЛДГ-5, меньшая активность у ЛДГ-4. В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя – общей ЛДГ. Их активность в крови распределяется следующим образом: ЛДГ-2 > ЛДГ-1 > ЛДГ-3 > ЛДГ-4 > ЛДГ-5.
При заболеваниях, сопровождающихся повреждением тканей и разрушением клеток, активность ЛДГ в крови повышается. В связи с этим она является важным маркером тканевой деструкции. Несмотря на то что увеличение активности фермента не указывает на какую-то определенную болезнь, его определение в комплексе с другими лабораторными анализами помогает в диагностике инфаркта легкого, мышечной дистрофии и гемолитической анемии. Повышенная активность ЛДГ может выявляться у новорождённых, беременных и после интенсивных физических нагрузок.
Ранее совместные анализы на ЛДГ, аспартатаминотрансферазу и креатинкиназу широко использовались в диагностике инфаркта миокарда. Сейчас для этой цели определяют уровень тропонина как более специфического маркера повреждения сердечной мышцы. Но исследование активности ЛДГ остается вспомогательным анализом при дифференциальной диагностике болевого синдрома в грудной клетке. У больных стенокардией активность фермента не изменяется, но при инфаркте миокарда начинает возрастать через 8-10 часов с максимумом в первые 24-48 часов после сердечного приступа и возвращается к норме через 10-12 дней. Повышение ЛДГ при нормальной активности АСТ через 1-2 дня после боли в грудной клетке указывает на инфаркт легкого.
При дифференциальной диагностике миопатий данный анализ помогает уточнить патофизиологические механизмы заболевания. Так, при нарушении мышечной функции, связанной с нейрогенными заболеваниями, ЛДГ не повышается, но при повреждении мышц из-за эндокринных и метаболических патологий активность ЛДГ увеличивается.
Активность ЛДГ в крови может возрастать вследствие многих злокачественных новообразований, при эффективном лечении она снижается, что иногда применяют для динамического наблюдения за онкологическими больными.
Для чего используется исследование?
- Для диагностики острого или хронического повреждения тканей при комплексном обследовании пациента.
- Для дифференциальной диагностики заболеваний при резкой боли в грудной клетке (инфаркт миокарда, стенокардия, инфаркт легкого).
- Чтобы выявлять заболевания, сопровождающиеся гемолизом эритроцитов.
- В целях наблюдения за течением онкологических заболеваний при терапии.
- Для исследования патологий печени и почек.
- Для диагностики поражений мышечной ткани.
Когда назначается исследование?
- При подозрении на острое или хроническое повреждение ткани и клеток в организме.
- При комплексном профилактическом обследовании пациента.
- При наблюдении за течением некоторых хронических заболеваний (мышечной дистрофии, гемолитических анемий, заболеваний печени, почек), онкологической патологии.
Лактатдегидрогеназа (ЛДГ) в биохимическом анализе крови: что это, нормы по возрасту, что значит повышение и снижение уровня фермента
К леточные ферменты довольно неспецифичны в плане обследования и идентификации патологических процессов. Рост и падение показателей наблюдаются в различных случаях. Порой речь идет о десятках возможных заболеваний. Поэтому специалистам приходится разрабатывать модификации, новые способы диагностики.
ЛДГ в крови — это особый фермент, известный как лактатдегидрогеназа, и отвечающий за энергетический обмен на клеточном уровне: в частности распад глюкозы и ускорение превращения молочной кислоты в пировиноградную.
Он содержится во всех без исключения цитологических структурах, в тканях организма. Правда, в различных концентрациях. Без него не может быть нормальной жизни как таковой.
Наибольшей концентрации вещество достигает в функционально активных, нагруженных органах. Например, в печени, сердце, легких. Имеется оно и в клетках крови, но ничтожно малых количествах, поскольку роль у них совсем другая.
Исследование ЛДГ проводят в рамках биохимического анализа крови. Специально изучать показатели не нужно, разве что возникнут подозрения. Тогда назначают вспомогательные, прицельные методики.
Что же такое ЛДГ и когда изучают этот показатель?
Роль фермента в организме, что показывает анализ
Лактатдегидрогеназа отвечает за энергетический обмен на клеточном уровне. Если говорить конкретнее, то благодаря этому веществу, возможны два основных процесса:
- Бескислородный распад глюкозы. Это не самый эффективный метод выработки энергии, зато крайне быстрый. Благодаря тому, что он вообще возможен, организм постоянно и без перерыва получает пусть малые, но необходимые ресурсы.
Они затрачиваются на обеспечение базовых процессов. Проведение нервных импульсов, сокращение мускулатуры, в том числе сердечной, мышцы миокарда.
- Второй путь, который обеспечивает лактатдегидрогеназа — кислородный распад глюкозы. Правда, косвенным образом. ЛДГ ускоряет превращение молочной кислоты в пировиноградную. Уже это вещество отвечает за окисление органических сахаров. А значит за существенную выработку энергии.
Собственно сама ЛДГ во время этих процессов не расходуется. Она остается в прежней концентрации, внутри клеток. Это результат ее химического строения.
Как было сказано ранее, лактатдегидрогеназа — это фермент. И как все вещества этого ряда она не расходуется, а только ускоряет биохимические процессы. В рассматриваемом случае речь идет об увеличении интенсивности реакций в десятки раз.
Анализ отлично подходит для диагностики патологий внутренних органов . В частности, с помощью исследования можно выявить такие расстройства:
- Стенокардия, инфаркт и прочие нарушения со стороны сердца.
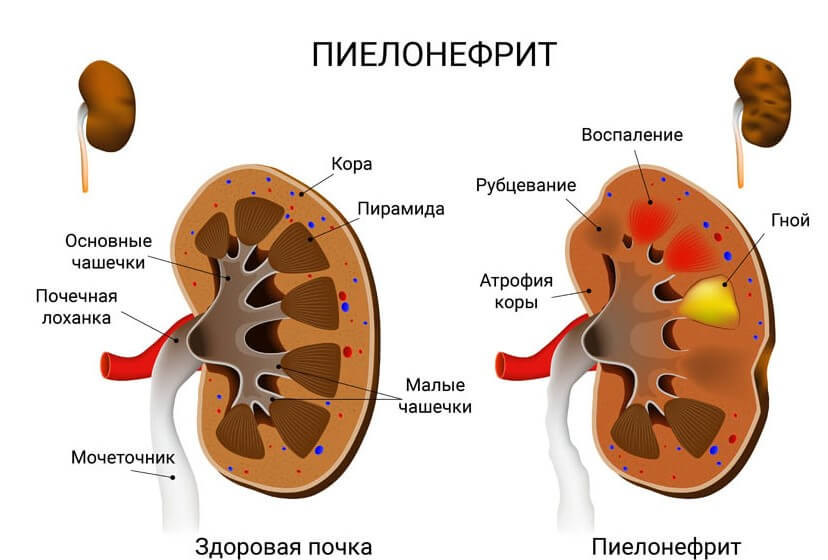
- Поражения почек. Пиелонефриты, всевозможные деструктивные, воспалительные явления.
- Лимфадениты.
- Функциональные расстройства селезенки. Увеличение ее в размерах.
- Пневмонии. Воспаления легких.
- Миозиты. Воспаления мышц. То же самое касается дистрофических процессов. Когда мускулатура разрушается.
- Панкреатит. Прочие заболевания поджелудочной железы.
- В меньшей мере изменение указывает на проблемы с кроветворной системой.
Вариантов масса. Но есть одна существенная сложность.
ЛДГ в анализе крови — это неспецифический показатель: действительно, при распаде тканей, клеток, она выходит в кровеносное русло и фиксируется лабораторным оборудованием, но почему — сказать невозможно. Поэтому специалисты прибегли к ухищрению и исследовали фермент более детально.
Выяснилось, что несмотря на, в общем, идентичное строение, лактатдегидрогеназа обладает спецификой в зависимости от того, где вещество расположено и в каких клетках оно содержится.
Модификации получили название изоферментов. Всего насчитывается 5 вариантов. Они маркируются соответствующим постфиксом, через дефис.
- ЛДГ-1. Располагается в клетках почек, сердечно-сосудистой системы. В значительно меньших количествах вещество можно найти в эритроцитах. В лабораторном протоколе иногда записывается как HHHH или H4.
- ЛДГ-2. Более специфичное вещество. Обнаруживается в кровеносном русле, если нарушается работа лимфоузлов или есть проблемы с селезенкой. Изменение показателя может быть косвенным. Нужно смотреть на другие уровни фермента.
В лабораторном протоколе маркируется как H3M или HHHM. Это синонимы. Как именно конкретная клиника отразит название — это вопрос предпочтений и применимой методики.
- ЛДГ-3. Располагается в клетках легочной системы. Дыхательных структур. Благодаря высокой специфичности удается точно описать суть проблемы. Другие наименования — H2M2 или HHMM.
- ЛДГ-4. Предпоследняя вариация. Располагается в структурах плаценты у беременных женщин, также в поджелудочной железе. В органах пищеварительного тракта. Другие названия — HM3 или HMMM.
- ЛДГ-5. Последний вариант. Локализуется в печени, мускулатуре скелета (не сердца). Описывается как M4 или MMMM.
Изоферменты лактатдегидрогеназы исследуются отдельно, если на то есть основания. Обычно в том случае, когда повышен общий показатель в биохимическом анализе крови. Вопрос, нужна ли прицельная оценка, остается на усмотрение специалистов.
Подготовка и сдача материала
Сложностей в плане подготовки нет. Достаточно следовать простым советам.
- За 12 часов отказаться от еды. Анализ сдают натощак. Желательно до 9-10.00. В этот период результаты будут наиболее точными.
- За сутки-двое нужно исключить алкоголь. Этанол, продукты его распада неминуемо спровоцируют повреждение тканей. А это приведет к повышению показателей ЛДГ, ложному итогу и, возможно, проблемам с диагностикой.
- То же самое касается режима питания. Специальной диеты как таковой нет. Но за сутки важно минимизировать количество продуктов с высоким содержанием жира. Иначе печень будет перегружена. Это неминуемо скажется на концентрации фермента. Ложный результат потребует повторения анализа.
- За 24 часа отказываются и от табака. Сигареты провоцируют те же проблемы, что и спиртное.
- За несколько часов до процедуры не стоит перенапрягаться физически. Интенсивное мышечное сокращение приведет к ложному росту показателей ЛГД.
- Наконец, нужно посоветоваться с врачом о текущем лечении. Многие медикаменты искусственно завышают уровни лактатдегидрогеназы. Например, средства на основе ацетилсалициловой кислоты. Часто также и противовоспалительные лекарства. Желательно отказаться от них хотя бы за сутки-двое. Но не всегда это возможно. Самовольно отменять препараты нельзя.
Процедура как таковая ничем не отличается от стандартного анализа крови.
Пациент приходит на место к назначенному времени. В процедурном кабинете сдает материал из вены. Образец помещают в пробирку и маркируют. Далее лаборатория подсчитывает концентрацию вещества в сыворотке и дает заключение.
В среднем, на подготовку результатов уходит 1-2 дня. Сложностей в плане оценки нет. С протоколом, заключением пациенту рекомендуется обращаться к врачу, который направил его на анализ.
Таблицы норм по возрастам
Концентрация фермента зависит от периода жизни и от пола человека. Норма ЛДГ у женщин примерно на 20% выше, чем у мужчин.
Референсные значения изменяются только в детские годы. Затем диапазон стабилизируется и уже не сдвигается.
| Возраст | Норма ЛДГ в единицах на литр крови |
|---|---|
| До 1 года | Не более 450 |
| 2-3 | Около 355 |
| 4-6 | До 310 |
| 7-12 | Не более 330 |
| 13-18 | Не выше 270 |
| После 18 | 130-210 у мужчин и 130-232 у женщин. |
Уровни примерные и касаются общей концентрации вещества в биохимическом анализе. Также исследуют изоферменты, в рамках расширенной диагностики. Расшифровка — прерогатива специалиста.
Причины повышения ЛДГ
Если лактатдегидрогеназа повышена, это значит, что идет массовое разрушение клеток организма и высвобождение фермента в кровь. Рост концентрации вещества встречается куда чаще снижения.
LDG меняется в результате ряда факторов:
- Патологии легких. Воспаление (пневмония), тромбозы и прочие расстройства. Те, в ходе которых орган разрушается. Причина повышения ЛДГ — деструкция клеток, в результате чего накопленные запасы лактатдегидрогеназы выделяются в кровеносное русло. Причем по концентрации можно судить о степени нарушения.
- Миокардит. Инфаркт миокарда. В первом случае речь идет об инфекционном поражении мышечного слоя органа. Обычно бактериального генеза.
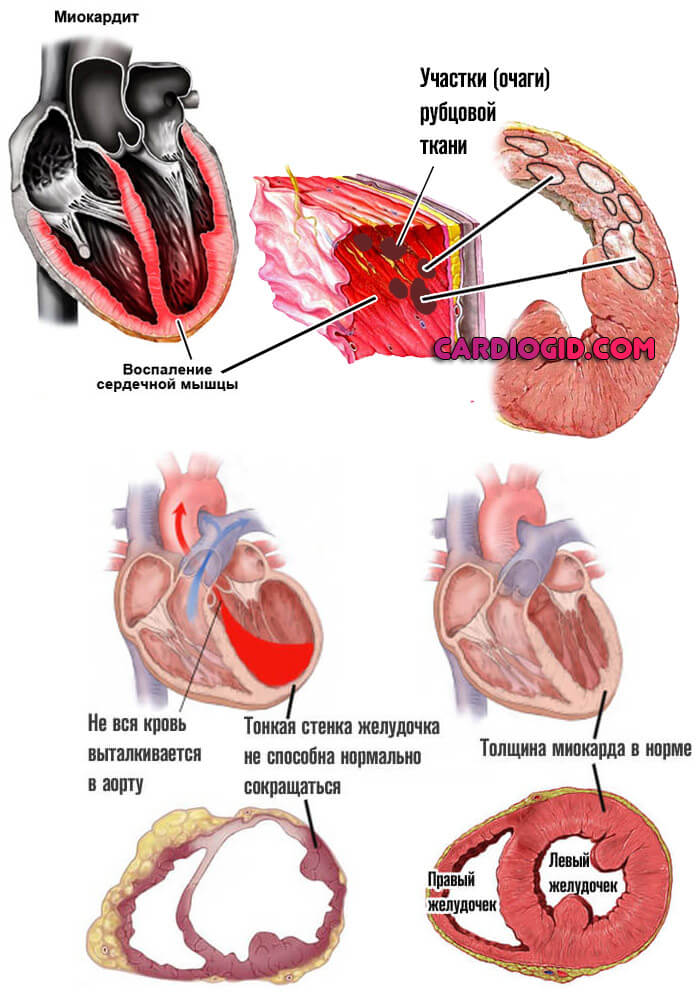
Во втором — о стремительном отмирании клеток-кардиомиоцитов в результате острой ишемии: недостаточного питания и дыхания.
В обеих ситуациях ЛДГ в биохимическом анализе крови повышен, но при инфаркте куда сильнее, поскольку объемы отмерших тканей в разы больше. То же возможно и при тяжелых миокардитах.
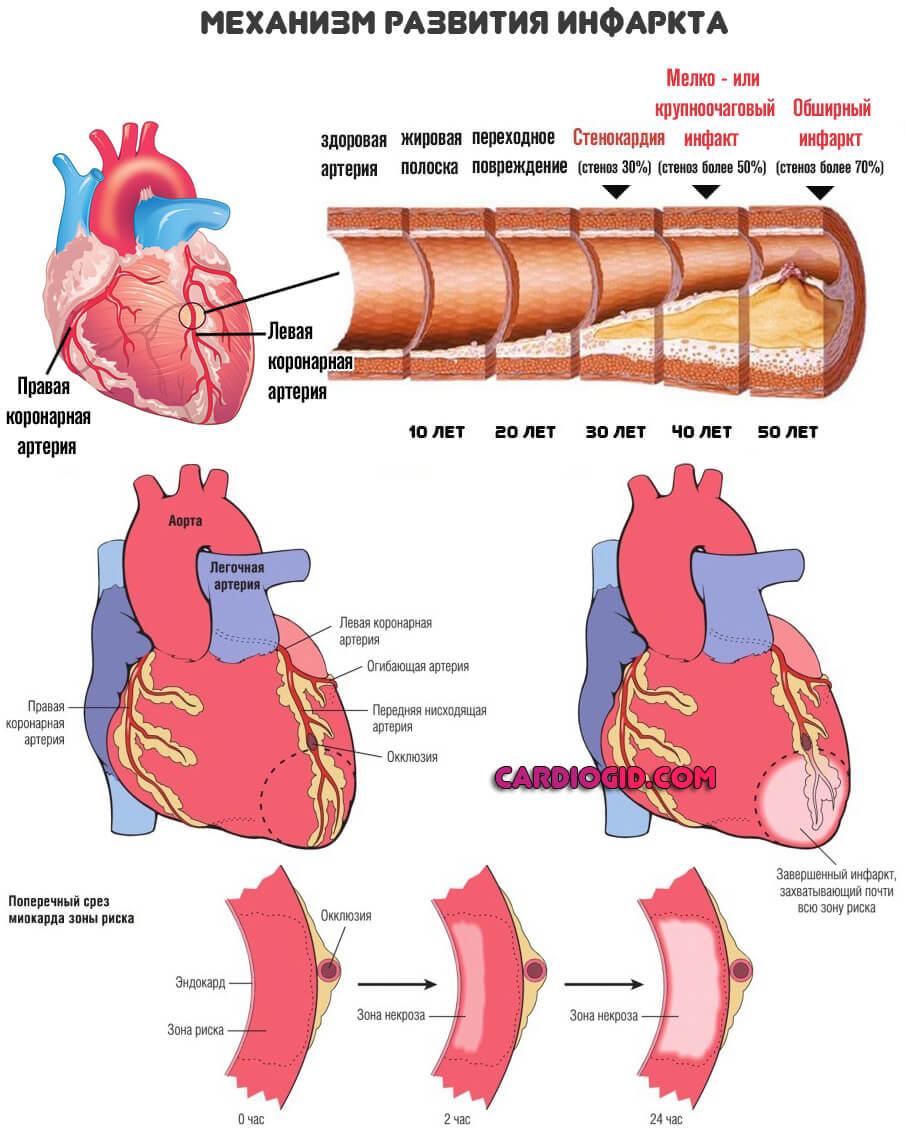
- Злокачественные опухоли. Не важно, какой локализации. Растут инфильтративно — прорастают сквозь здоровые ткани, тем самым уничтожают их. Отсюда рост фермента. В то же время, и злокачественные клетки имеют в запасе вещество, которое обеспечивает их энергетический обмен.
При крупных размерах опухоли, раковые структуры уже не получают достаточного количества питания и начинают самостоятельно, массово отмирать, это повышает лактатдегидрогеназу еще сильнее.
- Гепатит. Группа заболеваний, для которых характерно воспаление печени. Обычно инфекционного происхождения. Реже токсического, лекарственного. При гепатите концентрация ЛДГ растет в пределах 10-30% от нормы, это не столь серьезное повышение, но так происходит только на ранних стадиях. При дальнейшем прогрессировании все становится хуже.
- Цирроз печени. Серьезное заболевание органа. Гепатонекроз. То есть отмирание клеток крупнейшей железы. При остром течении концентрация ЛГД увеличивается в разы прямо на глазах. Хронические формы цирроза менее агрессивны в этом отношении. Потому и рост плавный.
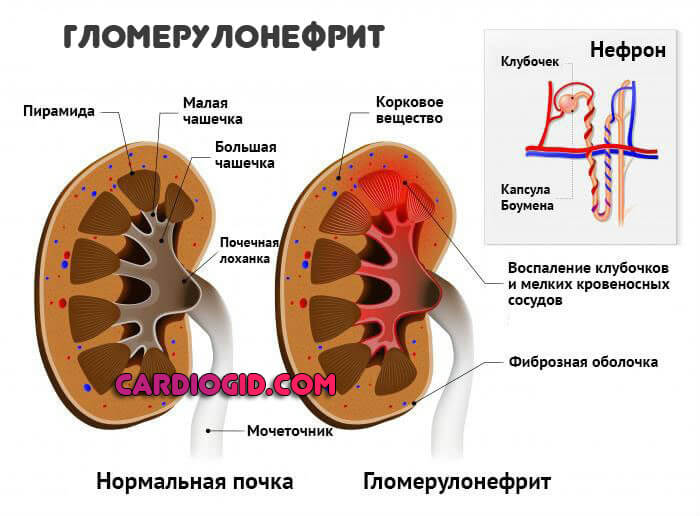
- Воспалительные поражения почек. Пиелонефрит, гломерулонефрит. То есть как инфекционные, так и аутоиммунные. Не привязанные к этиологии. Также и прочие заболевания структур мочеотделительного тракта. Названными двумя список не ограничивается.
- Панкреатит. Воспаление поджелудочной железы.
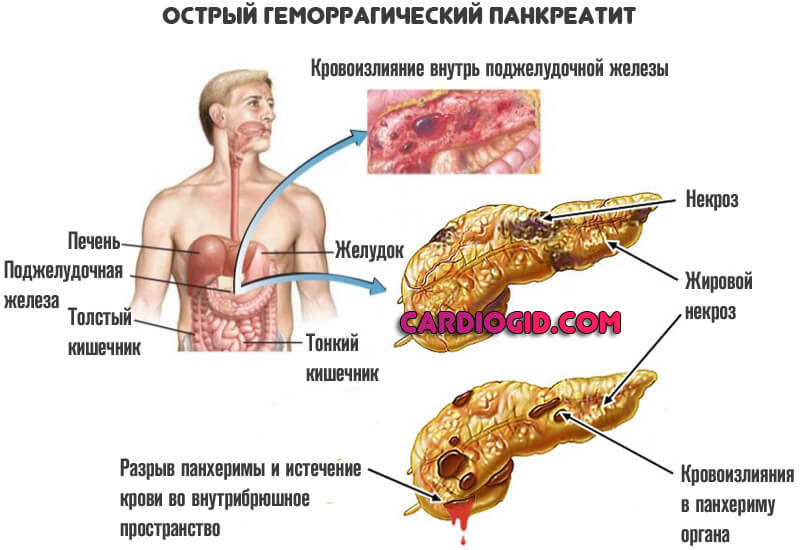
- Инфекционные процессы. В основном сопряженные с поражением пиогенной флорой (например, стафилококком) или же герпетическими агентами.
Классическая ситуация — мононуклеоз. Заболевание, обусловленное вирусом Эпштейна-Барр. Или цитомегалия, поражение герпесом пятого типа.
Насколько растет показатель — сказать трудно. Все зависит от степени нарушения работы организма и интенсивности иммунного ответа. Единой выкладки даже примерной нет.
- Массивные ожоги. В определенной мере фермент содержится и в клетках дермы, также в подкожно-жировой клетчатке. Если поражены еще и мышцы, ситуация становится крайне угрожающей. Чем больше площадь повреждений, серьезнее отклонения ЛДГ от нормы.
- Проблемы с плацентой. Отслойка, недостаточность.
- Избыточный синтез гормонов щитовидной железы. Гиперфункция.
- Атрофия мускулатуры. Например, при длительном голодании. Когда организм начинает утилизировать собственные мышцы. Или же на фоне долгого периода иммобилизации. У лежачих больных.
Кроме всего прочего, на основании динамики можно делать выводы о характере болезни: как она протекает и насколько эффективна терапия.
Есть и ситуативные виновники. Они, как правило, не относятся к заболеваниям и обусловлены субъективными действиями пациентов.
- Потребление спиртного в больших количествах.
- Физическая перегрузка.
- Курение накануне исследования.
- Прием некоторых препаратов.
И прочие. Расшифровку стоит доверить врачу. Обычно повышенная лактатдегидрогеназа означает, что имеются проблемы органического плана.
Причины снижения показателей
Встречается в несколько раз реже. Виновники могут быть такими:
- Нерациональное питание. Как правило, приводит к накоплению солей щавелевой кислоты. Оксалаты (собственно названные вещества) угнетают нормальную ферментативную активность лактатдегидрогеназы.
Не весь объем соединения участвует в катализе (ускоряет реакции). Следовательно, и в анализе будут отклонения. Поскольку методики подсчета как раз и основаны на взаимодействии специальных реагентов и фермента ЛДГ.
Чтобы получить более точные данные, пациенту следует рассказать о характере питания. Отдельно важно проверить состояния обмена веществ.
- Заболевания почек. Оксалаты в норме выводятся с мочой. Если выделительная система работает недостаточно эффективно, наблюдается обратное всасывание веществ, проникновение их в кровеносное русло. Концентрация ЛДГ снижена при нефритах, почечной недостаточности в фазе суб- и декомпенсации. Чем более запущен процесс, тем хуже обстоит дело.
- Нарушения обмена веществ. На общем уровне. По самым разным причинам. Пониженный ЛДГ в крови встречается при поражении гипофиза, гипоталамуса, сахарном диабете, проблемами с надпочечниками, расстройствами работы щитовидки (при котором падает синтез гормонов) и т.д.
- Прием некоторых лекарств. Особой активностью в отношении лактатдегидрогеназы обладают антибиотики (любого типа) и гормональные медикаменты. В меньшей мере витамин C. Аскорбиновая кислота. Чтобы сделать какие-то выводы, сначала препарат отменяют, потом биохимическое исследование повторяют. Если показатели восстановились, виной всему именно медикаменты. Курс терапии пересматривают.
- Проводимое лечение. Если понизить ЛДГ — это желаемый результат коррекции. Если пациент получает специальный курс и уровень фермента падает, это как раз то, на что и рассчитывает специалист. Если есть какие-то сомнения, назначают вспомогательные диагностические мероприятия.
Низкая концентрация ЛДГ встречается не так часто. Но это показательный результат. Потому врачам несколько проще трактовать подобные отклонения.
Дополнительные исследования
Мало обнаружить изменения концентрации фермента. Чтобы сказать что-то конкретное, требуется тщательная и всесторонняя диагностика. Среди дополнительных методов:
- Консультации профильных специалистов. В зависимости от того, какой изофермент находится за пределами референсных значений. При предполагаемых проблемах с печенью — гастроэнтеролог. То же касается и поджелудочной железы. Если вероятнее всего нарушение затрагивает сердца — нужна помощь кардиолога и так далее. На первичной консультации врач выявляет жалобы, составляет список проявлений и выдвигает гипотезы. Их нужно проверить.
- Сбор анамнеза. Проводимое лечение. Применяемые в данный момент препараты, перенесенные заболевания. Также характер питания, повседневной активности.
- УЗИ органов брюшной полости. Больше врачей интересует состояние собственно печени и поджелудочной.
- По потребности, чтобы изучить функциональную сохранность крупнейшей железы, назначают сцинтиграфию. Радиоизотопное исследование. После инъекции препарата йода пациента помещают под специальный датчик. По динамике выведения, накопления делают выводы о сохранности органа. Его способности работать.
- Электрокардиография. Для выявления функциональных нарушений со стороны сердца.
- ЭХО-КГ. Модификация УЗИ. В этом случае исследуется мышечный орган. Можно сделать выводы о характере патологий. Если таковые вообще есть. Особенно важна методика на фоне инфаркта или стенокардии. Для регулярного скрининга при ИБС.
- Электромиография. Проверка сократимости и состояния мускулатуры.
- Анализы на гормоны. Врачей интересуют уровни Т3, Т4, ТТГ, кортизол, адреналин, прочие. То есть вещества щитовидной железы, гипофиза и надпочечников.
- Обязательно проводят специальные тесты, чтобы выявить диабет. Как минимум, анализ крови на сахар. Возможно с провокацией. Когда пациенту предлагают выпить концентрированный раствор глюкозы.
- По потребности назначают МРТ или КТ. В рамках диагностики сложных органических патологий или опухолей.
Исследований довольно много. Назначают те, которые будут полезны в конкретном случае и помогут опровергнуть или подтвердить ранее выдвинутые гипотезы.
Анализ на ЛДГ — это эффективный и простой способ первичного обследования. Результаты позволяют определиться с направлением дальнейшей диагностики и понять, какой орган под ударом.
Чтобы получить исчерпывающие данные, нужно провести комплекс мероприятий и оценить результаты в системе.
ЛДГ в крови — что это такое, причины повышения в биохимическом анализе крови
Лактатдегидрогеназа (ЛДГ) в крови – это лабораторный критерий с низкой специфичностью. Однако его отклонение от нормы является достаточным условием для проведения комплексного обследования пациента. Он необходим для первичной диагностики патологий в работе сердца, лёгких, почек, различных онкопатологий и деструкции мышечной ткани у человека.
Что это такое ЛДГ в крови?
Для того чтобы понять с какой целью назначается анализ первоначально следует разобраться — что такое ЛДГ в биохимическом анализе крови?
Лактатдегидрогеназа (ЛДГ) в крови – это фермент, локализующийся внутри клеток. В состав обязательно входят ионы цинка. Основная функция – катализировать процесс окисления молочной кислоты до пирувата. Практически все клетки в организме человека содержат фермент ЛДГ. Максимальная концентрация отмечается в скелетных (9000 ед/г) и сердечной (25 000 ед/г) мышцах, а также в почках (15 000 ед/г), лёгких (9500 ед/г)и печени (9000 ед/г).
В случае повреждения клетки происходит активное высвобождение фермента в кровеносное русло. Клетки крови также содержат ЛДГ, однако, их содержание незначительно. Именно поэтому даже при незначительной деструкции тканей любого из органов происходит резкое увеличение уровня ЛДГ в сыворотке крови, что применяется для диагностики различных заболеваний. Данный факт позволяет отнести анализ крови на ЛДГ к высокочувствительным, но низкоспецифичным критериям.
Изоформы фермента
С точки зрения информативности полученных результатов изоформы ЛДГ являются более предпочтительными за счёт повышения уровня специфичности. Известно 5 изоформ фермента с характерными физико-химическими свойствами.
Изоформа
Орган, в котором вырабатывается
Показания к проведению исследования
Выписать направление на биохимический анализ сыворотки крови с целью определения уровня ЛДГ врач может если:
- у пациента наблюдаются симптомы хронического или острого повреждения целостности клеток и тканей;
- человек ощущает сильную боль в области груди, причиной которой может являться инфаркт миокарда или стенокардия;
- необходим контроль течения хронических патологий, включая онкологию;
- проводиться масштабный скрининг здоровья человека.
Норма ЛДГ в крови
Любая расшифровка результатов должна проводится исключительно специалистом. В виду низкой специфичности рассматриваемого критерия запрещается его изолированное применение для окончательной диагностики заболевания. Показатели нормальной концентрации ЛДГ у взрослых и детей в крови приведены в таблице.
Пол
Нормальные значения, Ед/л
Необходимо отметить, что в норме уровень ЛДГ у мужчин выше, чем у женщин. Отклонение от референсных (нормальных) значений в большую или меньшую сторону свидетельствует о развитии патологического процесса.
Значение показателей изоферментов ЛДГ
Активность изоферментов определяют по степени инактивации мочевиной. Установлено, что уровень ингибирования ферментативной активности сыворотки человека мочевиной находится в пределах от 26 до 36 %. Этот показатель рассматривается как стандартное значение для сравнения ингибирующих свойств пяти фракций изоферментов.
Изофермент
Уровень инактивации от общей активности мочевины, %
Из таблицы видно, что для каждой фракции соответствует свой уровень ингибирования. Исходя из известных данных о приоритетном органе синтеза каждого изофермента, и полученных результатов анализов можно с высокой долей вероятности определить орган, в котором развивается заболевание.
Расшифровка результатов: причины понижения
Отмечается, что уровень ЛДГ понижен в следующих случаях:
- наличие у пациента оксалатов (соли и эфиры щавелевой кислоты) и мочевины, которые ослабляют ферментативную активность ЛДГ;
- приём лекарственных препаратов, снижающих работу фермента (антибиотики, аскорбиновая кислота);
- эффективность выбранной тактики лечения, приводящая к нормализации величины рассматриваемого критерия.
Причины повышения ЛДГ в биохимическом анализе крови
Рассматриваемый критерий может отклоняться от нормальных величин при целом ряде различных заболеваний. Причинами повышения концентрации лактатдегидрогенезы могут являться:
- инфаркт миокарда, сопровождающийся ишемическим некрозом среднего слоя мышечной ткани сердца;
- закупоривание артерии лёгкого тромбом или инфаркт лёгких;
- патологии крови, для которых характерно разрушение эритроцитов (различные виды анемии, гемолиз, тяжелые интоксикации);
- злокачественные опухоли, поражающие различные органы и ткани, нередко сопровождающиеся метастазированием;
- нарушения в работе печени на фоне хронического и острого гепатита, болезни Госпела или алкогольной интоксикации;
- патологии почек (клубочковый нефрит, пиелонефрит);
- атрофия или травмы мышечной ткани;
- открытые и закрытые переломы;
- застойная сердечная или коронарная недостаточность;
- воспаление ткани сердечной мышцы;
- мононуклеоз, вирусной этиологии;
- острый приступ панкреатита;
- судорожные припадки;
- алкогольный делирий (психические отклонения на фоне резкой отмены алкоголя);
- ожоговая болезнь;
- отслоение плаценты раньше срока;
- гиперфункция щитовидной железы.
При выявлении причин повышения ЛДГ у женщин и мужчин необходимо исключать влияние факторов, которые могут приводить к недостоверным результатам:
- неправильный забор крови, в результате чего в пробирке разрушились эритроциты (гемолиз);
- пренебрежение правилами подготовки к сдаче биоматериала: физические и эмоциональные стрессы, курение, алкоголь, неправильный рацион;
- применение методов лечения, сопровождающиеся электростимуляцией пациента за неделю до проведения анализа;
- избыточное количество тромбоцитов в крови;
- приём лекарственных препаратов, активирующих работу ферментативной системы.
Нормализация уровня ЛДГ в крови
Пациенты часто задаются вопросом – как снизить уровень фермента? Для этого необходимо изначально установить точную причину повышения ЛДГ. Только при устранении заболевания, которое являлось причиной, возможно вернуть показатель к нормальным значениям. Терапия каждой из патологий имеет свои особенности:
- после первых признаков инфаркта миокарда человеку необходимо оказать первую помощь. Любая отсрочка лечения может привести к летальному исходу и развитию серьёзных осложнений. С целью оценки риска рецидива проводится контрольное измерение уровня ЛДГ, который при адекватной терапии должен возвращаться в норму;
- при анемии, спровоцированной недостатком железа, проводится коррекция питания пациента, и назначаются железосодержащие препараты. Благоприятным исходом считается – повышение уровня гемоглобина и снижение – ЛДГ;
- при онкопатологии необходим масштабный скрининг пациента для оценки размера опухоли, наличия метастазов и степени повреждения органов. При этом оценка эффективности лечения включает анализ на ЛДГ и основные онкомаркеры. Отсутствие положительной динамики, выражающейся в уменьшении рассматриваемых критериев, является поводом для перевода пациента на более агрессивные методы лечения;
- в случае острого панкреатита необходимо обязательное помещение пациента в круглосуточный стационар. Лечение включает в себя капельницы с обезболивающими, антибактериальными и противовоспалительными препаратами. По мере улучшения состояния больного, в норму приходят все биохимические показатели.
Как проводится анализ ЛДГ?
Для оценки уровня ЛДГ и его ферментативной активности применяют 2 группы методик:
- спектрофотометрические, суть которых заключается в определении различия в спектрах поглощении окисленной формы НАД (кофермент всех живых клеток) от восстановленной;
- колориметрические, подразделяющиеся на динитрофенилгидразиновые – определение концентрации пирувата, и редоксиндикаторные – выявление определённых молекул при помощи индикаторов, которые меняют цвет.
В качестве стандартов для определения ферментативной активности ЛДГ применяется оптический тест, а для изоферментов – электрофорез. При выдаче результатов анализа лаборатория обязательно должна указывать выбранную методику.
Как подготовиться к исследованию
Подготовка к сдаче анализа необходима для получения максимально достоверных и точных результатов. Биологическим материалом является венозная кровь, собранная из кубитальной вены на локтевом сгибе. Рекомендации перед анализом:
- кровь сдаётся строго натощак, за 1 сутки необходимо исключить из рациона жирные и жареные блюда;
- категорически запрещается за 12 часов до забора биоматериала пить сок, чай и кофе, разрешена чистая вода без газа;
- за 30 минут не курить;
- минимум за 48 часов не употреблять алкоголь и лекарственные препараты. При невозможности отмены каких-либо лекарств предупредить об их приёме сотрудника лаборатории;
- ограничить физическое и эмоциональное напряжение за 1 час.
Выводы
Подводя итог, необходимо подчеркнуть:
- ЛДГ в биохимическом анализе крови – низкоспецичный критерий, позволяющий предположить ряд заболеваний. Для уточнения диагноза обязательно проведение дополнительных лабораторных и инструментальных обследований;
- при расшифровке результатов важно учитывать, что референсная величина у ребёнка и взрослого человека различна;
- в случае некроза и инфаркта, для которых характерно разрушение клеток рекомендуется повторное проведение анализа после острой стадии. Это необходимо для оценки степени разрушения тканей и тяжести патологии;
- выявление степени активность изоформ фермента позволяет уточнить место локализации патологии.
![]()
Дипломированный специалист, в 2014 году закончила с отличием ФГБОУ ВО Оренбургский госудаственный университет по специальности “микробиолог”. Выпускник аспирантуры ФГБОУ ВО Оренбургский ГАУ.
В 2015г. в Институте клеточного и внутриклеточного симбиоза Уральского отделения РАН прошла повышение квалификации по дополнительной профессиональной программе “Бактериология”.
Лауреат всероссийского конкурса на лучшую научную работу в номинации “Биологические науки” 2017 года.
Лактатдегидрогеназа (ЛДГ, LDH) в крови: что это, норма в анализе, причины повышения

© Автор: З. Нелли Владимировна, врач лабораторной диагностики НИИ трансфузиологии и медицинских биотехнологий, специально для СосудИнфо.ру (об авторах)
Гликолитический внутриклеточный (цитоплазматический) фермент лактатдегидрогеназа (ЛДГ, LDH), ускоряющий реакцию превращения молочной кислоты в пировиноградную, а также катализирующий обратную реакцию (обратимая реакция окисления L-лактата в пируват), присутствует без исключения во всех тканях человеческого организма. Наибольшее содержание ЛДГ отмечается в сердце, печеночной и почечной паренхиме, скелетных мышцах, красных кровяных тельцах, где фермент представлен в виде пяти изоферментов (изоэнзимов): ЛДГ-1, ЛДГ-2, ЛДГ-3, ЛДГ-4, ЛДГ-5. Электрическая подвижность данных изоэнзимов полностью соответствует таковой глобулинов – α1, β1, γ1, γ2. Основная концентрация ЛДГ сосредоточена внутри клеток, сыворотка заметно уступает в этом плане.
У взрослого человека, не жалующегося на свое здоровье, общая активность лактатдегидрогеназы в сыворотке крови в норме колеблется в границах 0,80 – 4,00 ммоль/(ч·л) или 38 – 62 U/l (при 30°С).
Распределение фракций в плазме. Возраст и норма

содержание фракций ЛДГ в органах
Первая фракция (ЛДГ-1 или тетрамер НННН) берет свое начало преимущественно в сердечной мышце и значительно повышается в сыворотке крови при поражении миокарда.
Вторая, третья, четвертая фракции (ЛДГ-2, ЛДГ-3, ЛДГ-4) начинают активно поступать в плазму при патологических состояниях, сопровождающихся массивной гибелью кровяных пластинок – тромбоцитов, что происходит, например, в случае такого опасного для жизни состояния, как тромбоэмболия легочной артерии (ТЭЛА).
Пятый изофермент (ЛДГ-5 или тетрамер ММММ) происходит из клеток печеночной паренхимы и выделяется в плазму крови в больших количествах на острой стадии вирусных гепатитов.
Ввиду того, что разные виды тканей накапливают и выделяют различные концентрации ЛДГ, фракции изоэнзимов лактатдегидрогеназы распределяются в плазме крови неравномерно:
| Изофермент | Концентрация в сыворотке |
|---|---|
| ЛДГ-1 | 17 – 27% (0,17 – 0,27 отн. ед) |
| ЛДГ-2 | 27 – 37% (0,27 – 0,37) |
| ЛДГ-3 | 18 – 25% (0,18 – 0,25) |
| ЛДГ-4 | 3 – 8% (0,03 – 0,08) |
| ЛДГ-5 | 0 – 5% (0,00 – 0,05) |
Активность лактатдегидрогеназы в красных кровяных тельцах (эритроцитах) в 100 раз превосходит уровни энзима, содержащегося в плазме крови, причем, повышенные значения отмечаются не только при патологических состояниях, ряд физиологических условий, например, беременность, первые месяцы жизни либо чрезмерные физические усилия со своей стороны тоже способствуют возрастанию активности ЛДГ. Существенные различия нормальных уровней данного показателя также обусловлены возрастом и полом, о чем может свидетельствовать таблица, расположенная ниже:
| Возраст | Показатели нормы (U/l, 37°С) |
|---|---|
| Новорожденные | 150 – 785 |
| От 1 месяца до полугода | 160 – 437 |
| От 7 месяцев до года жизни | 145 – 365 |
| От 1 года до 2 лет | 86 -305 |
| От 3 до 16 лет | 100 – 290 |
| Взрослые женщины Мужчины |
120 – 214 135 – 240 |
Между тем, показатели нормы для ЛДГ крови всегда ориентировочны, их не следует запоминать раз и навсегда по той причине, что анализ может быть выполнен при температуре 30°С или 37°С, уровень рассчитан в различных единицах (мккат/л, ммоль/(ч·л), Ед/л или U/l). Но коль имеет место острая необходимость самостоятельно сравнить собственные результаты с вариантами нормы, то полезно будет для начала поинтересоваться в учреждении, производившем анализ, методами его проведения и единицами измерения, используемыми данной лабораторией.
Выведение изоэнзимов лактатдегидрогеназы (LDH-4, LDH-5) почками не переходит уровня в 35 мг/сутки (норма экскреции).
Причины повышения ЛДГ

Уровень активности ЛДГ повышен практически при любых патологических процессах, которым сопутствует воспаление и гибель клеточных структур, поэтому причинами увеличения данного показателя в первую очередь считают:
- Острую фазу инфаркта миокарда (более подробное описание изменения спектра ЛДГ при некротическом поражении миокарда будет представлено ниже);
- Функциональную недостаточность сердечной и сосудистой системы, а также органов дыхания (легкие). Вовлечение в процесс легочной ткани и развитие недостаточности кровообращения в малом круге кровообращения (уровень ЛДГ повышен за счет активности ЛДГ-3 и в некоторой степени – за счет ЛДГ-4 и ЛДГ-5). Ослабление сердечной деятельности влечет нарушение кровообращения, симптомы застойных явлений и рост активности фракций LDH-4 и LDH-5;
- Повреждения красных кровяных телец (пернициозная и гемолитическая анемии), обусловливающие состояние гипоксии тканей;
- Воспалительные процессы, затрагивающие легкие, а также почечную либо печеночную паренхиму;
- Тромбоэмболию легочной артерии, инфаркт легкого;
- Острый период вирусного гепатита (в хронической стадии активность LDH, как правило, не покидает границы нормы);
- Злокачественные опухоли (особенно, с метастазированием), локализованные преимущественно в ткани печени. Между тем, строгая корреляция, в отличие от инфаркта миокарда (чем больше размер очага, тем выше активность ЛДГ) между прогрессированием онкологического процесса и изменением спектра лактатдегидрогеназы не прослеживается;
- Различную гематологическую патологию (полицитемия, острый лейкоз, гранулоцитоз, хронический миелобластный лейкоз, анемии, обусловленные дефицитом витамина B12 или недостатком фолиевой кислоты);
- Массивное разрушение тромбоцитов, причиной которого нередко становятся гемотрансфузии, не обеспеченные достаточным подбором по отдельным системам крови (например, HLA);
- Заболевания костно-мышечной системы, в первую очередь – поражение скелетных мышц (травмы, атрофические поражения главным образом, на начальной стадии развития болезни).
ЛДГ и некроз сердечной мышцы
Исследование гликолитического фермента имеет весьма важное диагностическое значение при поражении сердечной мышцы, поэтому относится к главным ферментативным тестам, определяющим инфаркт миокарда в первые сутки развития опасного некротического процесса, локализованного в сердечной мышце (8 – 12 часов от начала болевого синдрома). Рост активности фермента происходит, в первую очередь, за счет фракции ЛДГ-1 и отчасти – за счет второй фракции (ЛДГ-2).

Спустя сутки-двое от болевого приступа уровень ЛДГ крови достигает максимальных значений и в большинстве случаев сохраняет высокую степень активности до 10 дней. При этом следует отметить, что активность находится в прямой зависимости от площади поражения миокарда (чем больше размер очага, тем выше значения показателя). Таким образом, инфаркт миокарда, первоначально диагностируемый с помощью таких лабораторных тестов, как определение креатинкиназы и МВ-фракции креатинкиназы, через сутки уже может подтвердиться данным ферментативным исследованием (ЛДГ повышен и повышен значительно – в 3 – 4… до 10 раз).
Кроме увеличения общей активности лактатдегидрогеназы и возрастания активности фракции ЛДГ-1, для выявления острого инфаркта миокарда особую ценность имеет коэффициент ЛДГ/ЛДГ-1 или ГБДГ (гидроксибутиратдегидрогеназа) и соотношение LDH-1/LDH-2. Учитывая, что значения ГБДГ в остром периоде болезни существенно изменяются в сторону увеличения, а общая активность лактатдегидрогеназы будет понижена относительно довольно высоких значений ЛДГ-1, то и коэффициент ЛДГ/ГБДГ будет заметно падать и окажется ниже 1,30. В это же время соотношение ЛДГ-1/ЛДГ-2, наоборот, будет проявлять тенденцию к повышению, стремясь достигнуть 1,00 (а иногда и перейти данный рубеж).
Другие причины изменения коэффициентов
Вышеописанные параметры, помимо некротического повреждения сердечной мышцы, подвергаются изменению и в случае других тяжелых заболеваний:
- Гемолитической анемии различного происхождения (ЛДГ/ГБДГ уменьшается и становится ниже 1,3);
- Мегалобластной анемии (содержание первой фракции значительно превосходит концентрацию второй);
- Состояниях, сопровождающихся усиленным разрушением клеток (острый некротический процесс);
- Новообразований, локализованных в железах женской и мужской половой сферы: дисгерминоме яичника, семиноме яичка, тератоме (здесь отмечается только возрастание концентрации ЛДГ-1);
- Поражений почечной паренхимы.
Таким образом, главными виновниками, а, стало быть, и главными причинами изменений концентрации описываемых показателей в сыворотке крови можно считать состояния, связанные с разрушением клеток печеночной и почечной паренхимы, а также форменных элементов крови (тромбоцитов, эритроцитов).
Отдельные нюансы
Для исследования ЛДГ в крови достаточно 1 мл сыворотки, которую добывают из крови, сданной, как и для любого другого биохимического теста, утром натощак (правда, если стоит вопрос о диагностике острого ИМ, то данными правилами, конечно, пренебрегают).
При лабораторном исследовании ЛДГ гемолиз приводит к искажению результатов анализа (завышает их). А при воздействии гепарина и оксалата активность фермента, наоборот, в сыворотке будет понижена по сравнению с реальными значениями ЛДГ крови. Чтобы этого не случилось, к работе с материалом следует приступить как можно раньше, первым делом отделив сгусток с форменными элементами от сыворотки.
Видео: специалист о ЛДГ
Органоспецифические ферменты в крови

Лактатдегидрогеназа
Катализирует превращение пировиноградной кислоты в молочную, и наоборот. Лактатдегидрогеназа (ЛДГ) является тетрамером, состоящим из двух субъединиц: Н (heart — сердечная) и М (muscle — мышечная). Выделяют пять изоферментов лактатдегидрогеназы: ЛДГ < (НННН); ЛДГ2 (НННМ); ЛДГ3 (ННММ); ЛДГ4 (НМММ) и ЛДГ5 (ММММ). Изоферменты, в которых преобладает субъединица Н, выделены из органов с аэробным метаболизмом (головной мозг, сердце). Субъединицы М характерны для органов, где преобладает анаэробный гликолиз (скелетные мышцы, печень, почки, новообразования).
ЛДГ1 попадает в плазму преимущественно из ткани сердца, эритроцитов и лейкоцитов. Активность ЛДГ2, ЛДГ3 и ЛДГ4 наиболее высока в тромбоцитах, а ЛДГ3 — также в поджелудочной железе, легких и почках. ЛДГ5 наиболее богаты скелетные мышцы, печень, кожа, слизистые оболочки и клетки некоторых злокачественных опухолей.
Норма содержания общей ЛДГ в сыворотке крови — до 195 МЕ/л. Активность ЛДГ1 составляет 19-25%, ЛДГ2 — 23-37%, ЛДГ3 — 17-25%, ЛДГ4 — 8-17%, ЛДГ5 — 8-18% от общей активности.
Аминотрансферазы
Аминотрансферазы катализируют процессы трансаминирования (перенос NH3-группы от аминокислоты , на кетокислоту), широко распространены во всех органах и тканях. В клинической лабораторной диагностике наиболее часто определяются два фермента из этого класса: аланинаминотрансфераза (АлАТ) и аcпартатаминотрансфераза (АсАТ). АлАТ выводится из кровотока несколько медленнее, чем АсАТ, поэтому активность АлАТ в норме выше, чем АсАТ. Более высокая активность АлАТ также связана с преимущественной локализацией фермента в цитоплазме, а АсАТ имеет и цитоплазматические, и митохо ндр иаль ные изоф ерменты.
Норма в сыворотке крови: АлАТ — 28- 191 нмоль/с-л, АсАТ — 28-125 нмоль/с-л. В Ед/л активность АлАТ и АсАТ составляет для лиц старше 17 лет у женщин — до 31 Ед/л, у мужчин — до 41 Ед/л.
АсАТ в высоких концентрациях присутствует в клетках сердечной и скелетных мышц, печени, почках, эритроцитах. Поражение любого из этих органов приведет к повышению уровня АсАТ в сыворотке. Причины повышения АсАТ представлены в таблице ниже.
| Артефактные | Гемолиз эритроцитов in vitro |
|---|---|
| Физиологические | У новорожденных активность в 1,5 раза выше, чем у взрослых |
| Патологические | Недостаточность кровообращения при шоке и гипоксии, инфаркт миокарда, острый вирусный или токсический гепатит, инфаркт легких, брыжейки, почек, цирроз печени, механическая желтуха, метастазы опухоли в печень, поражение скелетной мускулатуры, травмы и оперативные вмешательства, выраженный внутрисосудистый гемолиз, панкреатит, дерматомиозит |
Незначительное повышение аминотрансфераз может отмечаться после приема витамина С, антибиотиков (особенно из групп аминогликозидов и макролидов), холинэргических средств, морфия. Гиповитаминоз В6, повторный гемодиализ, почечная недостаточность и беременность могут приводить к снижению трансфераз.
Креатинфосфокиназа (КФК) или креатинкиназа
Принимает участие в энергетическом обмене клеток мышечной, нервной и других тканей. Катализирует обратимую
реакцию фосфорилирования креатинина: креатинфосфат -> креатинин + АТФ.
Молекула креатинкиназьт является димером, состоящим из субъединиц двух типов: В (brain — мозговая) и М (muscle — мышечная). Комбинация субъединиц образует три изофермента: ВВ-КФК (мозговой), МВ-КФК (сердечный) и ММ-КФК (мышечный).
Норма содержания креатинкиназы в сыворотке крови 10-110 МЕ/л. Активность ММ-КФК в сыворотке крови составляет 94-96%, МВ-КФК — 4-6%. ВВ-КФК определяется лишь в следовых количествах или не выявляется в периферической крови.
Причины повышения ММ-КФКм сыворотке:
— повреждения и заболевания скелетных мышц;
— неотложные состояния (отравления, комы, ТЭЛА).
Причины повышения МВ-КФК в сыворотке:
— острый инфаркт миокарда;
— миокардит, миокардиодистрофия;
— нестабильная стенокардия;
— затяжные аритмии.
Причины появления ВВ-КФК в сыворотке:
— острые нарушения мозгового кровообращения;
— черепно-мозговая травма;
— рак мочевого пузыря, легкого, предстательной железы, кишечника, печени, матки, яичка;
— некоторые психические заболевания (шизофрения, эпилепсия, МДП).
Фосфатазы
Фосфатазы — это группа ферментов, которые содержатся почти во всех органах и тканях. Катализируют отщепление остатка фосфорной кислоты от органических соединений. В зависимости от оптимального pH действия различают щелочную и кислую фосфатазу.
Щелочная фосфатаза
Оптимум pH для щелочной фосфатазы (ЩФ) составляет 8,6 — 10,1. В сыворотке присутствует несколько изоферментов ЩФ.
1. Костная ЩФ.
Секретируется остеобластами — крупными одноядерными клетками, лежащими на поверхности костного матрикса в местах интенсивного формирования костной ткани. У детей костная фосфатаза повышена до периода полового созревания.
2. Печеночная ЩФ — маркер холестаза, высвобождается из эпителия поврежденных желчных протоков. Сывороточная активность ЩФ резко возрастает за счет печеночного изофермента при обтурационных желтухах, когда нарушение выведения фермента с желчью приводит к тому, что он вновь поступает в кровь.
3. Кишечная фосфатаза синтезируется энтероцитами, поступает впросвет тонкого кишечника и частично всасывается в кровь. Вклад изофермента в общую активность невелик. Кишечная ЩФ может быть увеличена у лиц с первой и третьей группами крови, особенно после приема пищи, а также при диарее.
4. Почечная ЩФ частично всасывается в кровь, но в основном выводится с мочой. Определение ее в моче используется для диагностики заболеваний почек (гломерулонефрит, пиелонефрит).
5. Плацентарная ЩФ появляется в сыворотке крови матери при беременности, особенно в третьем триместре. Данный показатель может применяться в качестве дополнительного критерия оценки функции плаценты при беременности, осложненной бактериальными или вирусными инфекциями.
6. Неидентифицированные изоферменты ЩФ (так называемые изоферменты Regan и Nagao) имеют опухолевое происхождение и наиболее часто определяются при раке легкого.
Норма содержания общей щелочной фосфатазы в сыворотке крови : 60-310 МЕ/л.
Наибольший вклад в сывороточную активность щелочной фосфатазы дают ее костный и печеночный изоферменты. В зависимости от возраста они составляют: до 18 лет костный — 85%, печеночный — 15%; 18-30 лег — 60 и 40% соответственно. После 30 лет активность печеночного изофермента составляет 60% и выше.
Кислая фосфатаза
Под этим названием подразумевается группа лизосомальных ферментов, имеющих оптимум pH действия ниже 7,0 и выявляющихся практически во всех органах и тканях. У мужчин половину содержащейся в крови кислой фосфатазы (КФ) составляет предстательный изофермент, остальную часть — печеночный, эритроцитарный и тромбоцитарный. У женщин КФ происходит преимущественно из печени, эритроцитов и тромбоцитов.
Норма содержания общей кислой фосфатазы в сыворотке крови: 0,05-0,13 ммоль/ч*л.
Чаще всего тест используется при наблюдении за течением рака простаты у мужчин. Однако, поскольку уровень КФ не повышен на ранних стадиях заболевания и при доброкачественной гипертрофии, тест не рекомендуется при скрининге.
Причины повышения кислой фосфатазы в сыворотке крови:
— рак простаты, особенно при метастазировании в кости;
— заболевания гепатобилиарной системы;
— сфинголипидозы (болезни Гоше, Нимана-Пика);
— гемолитические анемии.
α-Амилаза
Этот фермент осуществляет расщепление α-1,4-связей в молекулах гликогена и крахмала. Плазма крови человека содержит два изофермента — панкреатическую α-амилазу (тип Р) и слюнную (тип S). Амилолитическую активность проявляют также кишечник, печень, почки, легюте, жировая ткань. Содержание S-амилазы составляет 45-70% общей активности фермента в плазме. В отдельных случаях в сыворотке практически здоровых людей обнаруживается так называемая макроамилаза, образованная комплексом фермента с Ig.
Молекулярная масса панкреатической амилазы и амилазы слюны практически одинакова, но они отличаются зарядами. Изоамилаза слюны имеет больший «отрицательный» заряд и плохо фильтруется через почечный фильтр, а P-тип быстро выводится с мочой из организма. В связи с этим определение амилазы в моче можно использовать для оценки функции поджелудочной железы. В моче α-амилаза называется диастазой.
Норма активности α-амилазы в сыворотке крови составляет 13-32 г/ч*л.
Снижение активности α-амилазы наблюдается при панкреонекрозе, заболеваниях печени, ожоговой болезни, гипотиреозе, сахарном диабете.
Диастаза мочи в норме составляет 16-64 Ед.
Уровень фермента значительно нарастает при остром панкреатите (до 512-1024 Ед) и сохраняется повышенным до 2 недель после приступа острого панкреатита. Другие острые заболевания органов брюшной полости сопровождаются менее значительным увеличением диастазы.
Повышенный уровень α-амилазы в плазме и низкий уровень диастазы мочи отмечается на фоне почечной недостаточности и циркуляции в крови макроамилазы.
Гаммаглутамилтрансфераза (ГГТФ) или гамма-глутамилтранспептидаза (ГГТП)
Гаммаглутамилтрансфераза — это мембраносвязанный фермент, который встречается во многих паренхиматозных органах. Наибольшая активность его наблюдается в почках, поджелудочной железе, печени, селезенке, простате и тонкой кишке. ГГТФ считается одним из маркеров цитолиза гепатоцитов, а также синдрома холестаза. Для диагностики холестаза ГГТФ желательно определять параллельно со щелочной фосфатазой.
Норма содержания ГГТФ в сыворотке крови:
у мужчин — 15-106 усл. ед. или 250-1770 нмоль/(с * л):
у женщин — 10-66 усл. ед. или 167-1100 нмоль/(с * л).
Лактатдегидрогеназа (ЛДГ) норма (таблица). Лактатдегидрогеназа (ЛДГ) повышена или понижена – что это значит
Лактатдегидрогеназа – это фермент, принимающий участие в метаболизме глюкозы. Как известно, глюкоза является основным источником энергии для поддержания жизнедеятельности организма. При наличии в клетке кислорода, глюкоза расщепляется, высвобождая энергию с образованием воды и углекислого газа. Но если по каким-то причинам кислорода в клетке нетто она тоже может использовать молекулу глюкозы для своей работы. Правда в этом случае объем высвобождаемой энергии оказывается меньше примерно в 18 раз и вместо углекислого газа и воды образуется молочная кислота. Так происходит, если, например, произошло перекрытие сосуда, снабжающего клетку кровью. Она может продержаться еще какое-то время, но только в том случае, если ей поможет лактатдегидрогеназа.

Именно поэтому она присутствует во всех клетках организма, в качестве запасного «пожарного» варианта работы клетки без участия кислорода. Лактатдегидрогеназа сконцентрирована, главным образом внутри клеток и лишь небольшая ее часть присутствует в сыворотке крови
Когда из-за заболевания или по другим причинам, клетки начинают разрушаться, концентрация лактатдегидрогеназы крови увеличивается. Таким образом, при проведении анализа крови, этот фермент является важным маркером разрушения тканей. Хотя само по себе увеличение ЛДГ в сыворотке крови еще не указывает на какое-то заболевание, оно играет роль вспомогательного фактора при диагностике различных заболеваний, например, при инфаркте легкого, гемолитической анемии или инфаркте миокарда. Впрочем, в последнем случае, теперь все чаще используют тест на концентрацию в крови тропонина, что является более информативным и специфическим показателем. Тем не менее, тест на уровень лактатдегидрогеназы помогает провести дифференцированную диагностику при болевых ощущениях за грудиной и в грудной клетке.
Норма лактатдегидрогеназы в крови. Расшифровка результата (таблица)
Поскольку уровень лактатдегидрогеназы в сыворотке крови возрастает при повреждении тканей и клеток, данное тестирование назначается при комплексных обследованиях, чтобы выявить возможные патологические процессы, а также для того чтобы выяснить причины появления острой боли за грудной клеткой. Анализ крови на лактатдегидрогеназу может быть назначен для диагностики заболеваний, вызывающих гибель эритроцитов, а также для того чтобы следить за ходом лечения онкологических заболеваний. Кроме того данный тест необходимо проводить для того чтобы оценить степень поражения мышечной ткани при дистрофии или при исследовании степени поражения клеток печени и почек при соответствующих заболеваниях.
Забор крови осуществляется из вены строго натощак – рекомендуется не принимать пищу за 12 часов до сдачи анализа.
Норма лактатдегидрогеназы в крови обычных людей и беременных женщин:

Если лактатдегидрогеназа повышена, что это значит?
Заболеваний, которые вызывают повышение уровня лактатдегидрогеназы в сыворотке крови достаточно много. Вот их примерный список:
- инфаркт легкого,
- инфаркт миокарда,
- миокардит,
- застойная сердечная недостаточность,
- инфаркт кишечника,
- эмболия легкого,
- заболевания, вызывающие разрушение эритроцитов – серповидно-клеточная анемия, мегалобластическая анемия, гемолитическая анемия и другие виды, эритремия,
- лейкозы,
- заболевания печени с разрушением ее клеток – гепатиты, цирроз, алкогольное поражение,
- опухолевые образования злокачественного характера – рак печени, рак яичек, яичников, лимфомы, метастазы и т.п.
- заболевания почек с разрушением их клеток,
- мышечная дистрофия и другие мышечные патологии,
- переломы костей,
- гипотиреоз,
- инсульт,
- эклампсия,
- тромбоцитоз,
- некоторые другие заболевания.
Все эти заболевания объединяет одно – они протекают с разрушением и отмиранием клеток. При беременности увеличение концентрации лактатдегидрогеназы является довольно опасным симптомом, который может говорить о преждевременной отслойке плаценты и гибели плода. Чрезвычайно высокая активность ЛДГ связывается с раковыми новообразованиями в легких и в брюшной полости и с болезнью Ходжкина. При лейкемии повышение уровня лактатдегидрогеназы весьма незначительно.
Но бывают и другие причины, по которым повышается норма лактатдегидрогеназы в крови. Например, повышение уровня лактатдегидрогеназы наблюдается у пациентов с искусственным сердечным клапаном, вследствие разрушения эритроцитов створками этого устройства. К такому же результату приводит интенсивная физическая нагрузка незадолго до сдачи крови или прием некоторых лекарственных препаратов, в частности – анестетиков, анаболических стероидов, кодеина, изотретионина, вальпроевой кислоты, вазопрессина и многих других. Поэтому перед проведением анализа не забудьте предупредить вашего лечащего врача обо всех лекарственных средствах, которые вы принимали в последнее время.
Если лактатдегидрогеназа понижена, что это значит?
Снижение уровня лактатдегидрогеназы, в отличие от его повышения, не свидетельствует о каком-то заболевании и обычно не используется для диагностики. Чаще всего подобное явление может быть вызвано повышением уровня мочевины или оксалатов, которые нейтрализуют проявления лактатдегидрогеназы. Также уровень ЛДГ в сыворотке крови может быть снижен в результате приема некоторых лекарственных препаратов, в частности аскорбиновой кислоты – витамина С, метронидазола, гидроксимочевины амикацина, цефотаксима и проч.