Синдром миелодиспластический – описание, причины, симптомы (признаки), диагностика, лечение.
Краткое описание
Миелодиспластический синдром (МДС) — группа патологических состояний, характеризующихся нарушением гемопоэза во всех ростках, проявляющемся панцитопенией. МДС часто трансформируется в острый лейкоз или апластическую анемию. Частота. Увеличение заболеваемости (1–2 на 100 000) в последние годы может быть связано с более точной диагностикой. Преобладающий возраст — старше 65 лет.
Код по международной классификации болезней МКБ-10:
- D46 Миелодиспластические синдромы
Генетика. При миелолейкозе наблюдают межгенный сплайсинг генов MDS1 и AML1 (*600049, Â). Клинически: синдром миелодисплазии. Лабораторно: ассоциация с транслокацией хромосом t(3; 21)(q26; q22).
Причины
Факторы риска • Эндогенные: хромосомные и генетические нарушения • Экзогенные: длительный контакт с продуктами органической химии, радиация, инсоляция, применение некоторых ЛС (например, хлорамфеникол, цитостатики).
Морфологическая классификация • Рефрактерная анемия — 5% бластов в крови, или наличие палочек Ауэра (палочковидные цитоплазматические красного цвета [при окраске по Лейшману] включения в моноцитах, миелоцитах и миелобластах) • Хронический миеломоноцитарный лейкоз — 1–20% бластов в костном мозге, 1´109/л
Симптомы (признаки)
Клиническая картина • Интоксикация — субфебрильная температура тела, усиленное потоотделение, слабость, вялость, понижение аппетита, снижение массы тела • Анемия — бледность кожных покровов и видимых слизистых оболочек, нарушение микроциркуляции • Геморрагический синдром — экхимозно – петехиальная сыпь, кровотечения из слизистых оболочек • Спленомегалия, гепатомегалия (редко) • Кожные инфильтраты • Инфекционные осложнения вследствие лейкопении.
Диагностика
Лабораторные исследования • Периферическая кровь — анемия макроцитарная, возможны ретикулоцитоз, гранулоцитопения (гипогранулярные или агранулярные нейтрофилы со слабо конденсированным хроматином), тромбоцитопения • Биохимический анализ крови — увеличение уровня HbF до 70% • Прямой антиглобулиновый тест Кумбса положителен в некоторых случаях • Миелограмма — незначительное увеличение содержания бластов, гипоплазия эритроидного и миелоидного ростков, ретикулярный фиброз выражен слабо, аномальная локализация незрелых предшественников. Содержание мегакариоцитов снижено. Количество клеток красного костного мозга обычно нормально, у 10% возможно выявление гипоплазии.
Специальные исследования • Цитогенетические • Тест определения функций гранулоцитов — снижение миелопероксидазной активности, фагоцитоза, хемотаксиса и адгезии • Тест определения функций тромбоцитов — нарушение агрегации, адгезии • Иммунофенотипирование — используют неспецифические миелоидные маркёры • Рентгенография органов грудной клетки • УЗИ — увеличение печени и селезёнки • Гепатосцинтиграфия.
Лечение
ЛЕЧЕНИЕ
Режим • Амбулаторный • Показания к стационарному лечению •• Тяжёлое состояние больного, истощение •• Геморрагический синдром •• Присоединение инфекционных осложнений •• Панцитопения, требующая заместительных гемотрансфузий.
Лекарственная терапия — симптоматическая • Антибактериальная терапия (предпочтительнее антибиотики широкого спектра действия), противогрибковые, антивирусные препараты • Гемостатики, ангиопротекторы (например, аминокапроновая кислота, этамзилат) • Общеукрепляющая, дезинтоксикационная терапия (р – р глюкозы, препараты калия, витамины, трифосаденин, кокарбоксилаза, инозин) • Биопрепараты при выраженной лейкопении (например, эшерихия коли, бифидобактерии бифидум) • Трансфузионная терапия по показаниям — см. Анемии апластические (переливания отмытой эритроцитарной массы, тромбоцитарной взвеси) • Даназол или преднизолон — при сопутствующей аутоиммунной тромбоцитопении.
Трансплантация костного мозга показана больным моложе 35 лет.
Ведение больного. Наблюдение 1 р/мес в перерывах между курсами поддерживающей терапии. Необходим контроль периферической крови, миелограммы (для исключения трансформации МДС в острый лейкоз или аплазию).
Прогноз • Средняя продолжительность жизни для больных с рефрактерной анемией, рефрактерной анемией с кольцевыми сидеробластами составляет 5 лет • Средняя продолжительность жизни больных с рефрактерной анемией с избытком бластов, рефрактерной анемией с избытком трансформирующихся бластов и хронической миеломоноцитарной анемией составляет 1 год • Отягощают течение и ухудшают прогноз геморрагический синдром, генерализованные инфекции.
Синонимы • Гемопоэтическая дисплазия • Прелейкоз
Сокращение. МДС — миелодиспластический синдром
МКБ-10 • D46 Миелодиспластические синдромы
Миелодиспластический синдром
Миелодиспластическим синдромом называют группу гетерогенных клональных заболеваний крови, объединенных следующими признаками: неэффективный гемопоэз, периферическая цитопения, дисплазия в одном или более ростке кроветворения с высоким потенциалом трансформации в острый миелоидный лейкоз.
Недостаточное кроветворение проявляется анемией, повышенной кровоточивостью и подверженностью инфекциям. Миелодиспластический синдром (МДС) встречается у людей любого возраста, в том числе и детского, но в большей степени ему подвержены люди после 60 лет.
По МКБ-10 миелодиспластическим синдромам присваивается код D46.
Причины
Клетки крови синтезируются и созревают главным образом в костном мозге (этот процесс называется миелопоэзом, а ткань, в которой он происходит, называется миелоидной), затем, выполнив свою функцию и состарившись, уничтожаются селезенкой, а на их место приходят новые. При миелодиспластическом синдроме костный мозг теряет способность к воспроизводству клеток крови (всех – эритроцитов, лейкоцитов, тромбоцитов или только некоторых) в необходимом организму количестве, в кровь попадают незрелые клетки (бласты), в результате чего она хуже выполняет свои функции. Это проявляется характерной для МДС симптоматикой. Примерно в 30% случаев процесс миелопоэза становится со временем полностью бесконтрольным, количество бластных форм кровяных клеток увеличивается, вытесняя нормальные, зрелые клетки. Когда количество бластов в крови превышает 20% (ранее пороговым значением было 30%), ставится диагноз острого миелоидного лейкоза.
В зависимости от того, известна ли причина нарушения функции костного мозга, или нет, МДС делится на первичный, или идиопатический, и вторичный. Вторичный возникает в результате угнетения костномозговой функции после химиотерапевтического или лучевого воздействия. Такое воздействие обычно является частью противоопухолевой терапии, т. е. проводится по поводу какого-либо вида рака. В этом случае МДС можно рассматривать как осложнение.
Первичный, или идиопатический МДС возникает спонтанно, без какой-либо предшествующей патологии и по неизвестной причине. Возможно, предрасполагающим фактором является генетический, поскольку при некоторых видах синдрома обнаруживаются хромосомные изменения.
Факторами, способствующими развитию МДС, являются:
- курение;
- контакт с канцерогенными химическими веществами (пестициды, гербициды, бензол);
- воздействие ионизирующей радиации;
- пожилой возраст.
Формы заболевания
Как уже указывалось выше, МДС делится на два вида, первичный и вторичный.
Чаще встречается первичный МДС (около 80% всех случаев), большинство заболевших – пожилые люди (65-75 лет). Вторичным МДС также в основном страдают пожилые люди, по той причине, что и злокачественные опухоли, а значит, и их осложнения, у них встречаются чаще. Вторичный МДС хуже поддается терапии и связан с худшим прогнозом.
Кроме того, МДС делится на клинические типы в зависимости от типа бластных клеток, их количества и наличия хромосомных изменений, эта классификация предложена Всемирной Организацией Здравоохранения (ВОЗ). Согласно классификации ВОЗ, выделяют следующие формы МДС:
- рефрактерная (т. е. устойчивая к классической терапии) анемия;
- рефрактерная цитопения с мультилинейной дисплазией;
- МДС с изолированной делецией 5q;
- МДС неклассифицируемый;
- рефрактерная анемия с кольцевидными сидеробластами;
- Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами;
- рефрактерная анемия с избытком бластов-1;
- рефрактерная анемия с избытком бластов-2.
Стадии заболевания
В протекании МДС выделяют три стадии, которые, однако, не всегда клинически четко отличаются между собой, различия определяются лабораторно. Это стадия анемии, стадия трансформации (промежуточная между анемией и острым лейкозом), и острый миелоидный лейкоз. Не все исследователи согласны с определением острого миелоидного лейкоза как стадии миелодиспластического синдрома, поскольку он относится к миелопролиферативным нарушениям (т. е. тем, которые характеризуются бесконтрольным клеточным ростом), тем самым не полностью соответствуя характеристикам МДС.
Симптомы
Основные симптомы МДС связаны с проявлениями анемии. Пациенты предъявляют жалобы на повышенную утомляемость, приступы головокружения, одышку при физической нагрузке, которая ранее переносилась легко. Анемия связана с нарушением продукции эритроцитов, следствием чего является низкий уровень гемоглобина в крови.
В некоторых случаях развивается геморрагический синдром, который характеризуется повышенной кровоточивостью. Пациент начинает замечать, что даже незначительные поверхностные повреждения вызывают длительно не останавливающееся кровотечение, может появиться кровоточивость десен, частые и спонтанные носовые кровотечения, петехии на коже и слизистых оболочках, а также множественные гематомы (синяки) либо без связи с какой-либо запоминающейся пациенту травмы, либо после незначительного ушиба или даже надавливания. Геморрагический синдром связан с нарушениями тромбоцитопоэза.
У больных с МДС также обнаруживается подверженность инфекционным болезням. Они часто болеют простудными заболеваниями, кожными бактериальными и грибковыми инфекциями. Такое состояние обусловлено нейтропенией (недостаточностью нейтрофилов).
Кроме того, признаками МДС могут быть:
- беспричинное повышение температуры, часто до высоких значений (38 °С и выше);
- снижение веса, уменьшение аппетита;
- гепатомегалия;
- спленомегалия;
- болевой синдром.
В ряде случаев МДС ничем себя не проявляет и обнаруживается случайно во время лабораторного исследования крови по другому поводу.
Диагностика
Основной метод диагностики МДС – лабораторный. При подозрении на миелодисплазию проводятся:
- Клинический анализ крови. При этом обнаруживается анемия (макроцитарная), ретикулоцитопения, лейкопения, нейтропения, при синдроме 5q – тромбоцитоз. Примерно у половины пациентов выявляется панцитопения.
- Биопсия костного мозга. Цитоз обычно в норме или увеличен, но примерно у 10% пациентов он снижен (гипопластический вариант МДС), есть признаки нарушенного гемопоэза одного или нескольких ростков кроветворения, может обнаруживаться повышенное содержание бластных форм, патологических сидеробластов (эритроциты, содержащие отложения железа). Для идентификации аномальных фенотипов проводят исследование иммунофенотипа костномозговых клеток, это позволяет проводить дифференциальную диагностику МДС и неклональных цитопений, что важно для прогноза.
- Цитогенетический анализ. У 40–70 % пациентов обнаруживаются клональные цитогенетические аномалии, особенно часто наблюдается делеция (моносомия) 7 хромосомы (7q), которая является прогностически неблагоприятной.
- Определение уровня железа и феритина в сыворотке. Уровни повышены.
- Определение эндогенного эриропоэтина (при Диагностика МДС проводится лабораторными методами
Диагностические критерии
Для определения МДС разработаны специальные критерии, т. е. условия, при соблюдении которых ставится данный диагноз. Диагностические критерии следующие:
- 1-, 2- или 3-ростковыя периферическая (т. е. обнаруживаемая в периферической крови) цитопения;
- дисплазия: признаки нарушения гемопоэза не менее 10% клеток не менее одного кроветворного ростка;
- характерные цитогенетические изменения (наличие патологического клона).
Цитопения должна быть стабильной и наблюдаться в течение не менее шести месяцев, однако если обнаруживается специфический кариотип, или ей сопутствует дисплазия не менее двух ростков кроветворения, достаточно двух месяцев.
Для постановки диагноза должны быть исключены другие заболевания, сопровождающиеся клеточной дисплазией и цитопенией.
При выявлении цитопении без других признаков МДС диагностируют идиопатическую цитопению, значение которой не установлено; при выявлении дисплазии без цитопении – идиопатическую дисплазию, значение которой не установлено. При этом требуется постоянное наблюдение пациента с повторным исследованием костного мозга через 6 месяцев, поскольку оба этих диагноза способны прогрессировать до МДС и острого миелоидного лейкоза (или другого миелопролиферативного заболевания).
Дифференциальная диагностика
МДС дифференцируется со следующими заболеваниями:
- анемии (прежде всего, мегалобластическая, сидеробластическая и апластическая);
- острый миелоидный лейкоз;
- лейкопения с нейтропенией;
- первичная иммунная тромбоцитопения;
- клональный гемопоэз с неопределенным потенциалом;
- первичный миелофиброз;
- ВИЧ;
- тяжелая интоксикация различной этиологии.
Лечение
В 1997 году была разработана специальная шкала, называемая шкалой IPSS (International Scoring Prognostic System, Международная шкала оценки прогноза), разделяющая пациентов на группы риска. В соответствии с определенной группой риска выбирается лечебная тактика, и, что следует из названия, оценивается прогноз.
Баллы присваиваются с учетом трех факторов:
- количество бластных форм;
- количество пораженных кроветворных ростков;
- цитогенетическая категория.
Миелодиспластический синдром: причины, признаки, диагностика, как лечить, прогноз

Миелодиспластический синдром (МДС) — тяжелое гематологическое заболевание, которое относится к группе онкопатологий и плохо поддается терапии . В основе недуга лежит нарушение процесса воспроизведения клеток крови: их развития и деления. В результате подобных аномалий образуются онкологические структуры, и формируются незрелые бласты. Постепенно количество нормально функционирующих, зрелых клеток в организме уменьшается. Данный синдром называют «дремлющим лейкозом» из-за скопления в крови бластных клеток.
Костный мозг — важный кроветворный орган, в котором происходят процессы образования, развития и созревания клеток крови, то есть осуществляется гемопоэз. Этот орган также принимает участие в иммунопоэзе — процессе созревания иммунокомпетентных клеток. У взрослого человека в костном мозге содержатся незрелые, недифференцированные и низкодифференцированные клетки – стволовые.

Большинство заболеваний костного мозга обусловлены мутацией стволовой клетки крови и нарушением ее дифференциации. МДС не является исключением. Расстройство кроветворения приводит к развитию острого лейкоза. Причина первичного МДС неизвестна. Мутагенные факторы оказывают негативное воздействие на стволовую клетку крови, что приводит к нарушению ДНК и выработке в костном мозге аномальных клеток, постепенно вытесняющих нормальные. Вторичный синдром развивается в результате длительного лечения цитостатиками, при частом контактировании с химическими веществами, в следствии облучения. Заболевание чаще развивается у пожилых лиц старше 60 лет, чаще у мужчин. Раньше среди детей синдром практически не встречался. В настоящее время недуг «помолодел». Все чаще случаи МДС наблюдаются у больных среднего возраста, что связано с экологическими проблемами крупных городов. Миелодиспластический синдром имеет код по МКБ-10 D46.
Цитопения — клиническое проявление патологий системы кроветворения. Симптоматика недуга определяется поражением определенной клеточной линии. У больных возникает слабость, утомляемость, бледность, головокружение, лихорадка, кровоточивость, кровоизлияния. Специфические признаки при этом отсутствуют. Диагностика патологии основывается на результатах гемограммы и гистологического исследования биоптата костного мозга. Лечение заключается в переливании основных компонентов крови, проведении химиотерапии, иммуносупрессивной терапии и пересадке костного мозга.

цитопения с нарушением созревания клеток крови по нескольким росткам
Эффективное лечение МДС – одна из самых сложных проблем современной медицины. Его проводят специалисты в области онкогематологии. Синдром в запущенных случаях приводит к онкологии. Но так происходит не всегда. Легкие формы недуга типа рефракционной анемии обычно не заканчиваются формированием рака. Недостаток клеток крови приводит к анемии, кровоточивости, сердечной дисфункции, увеличению риска развития инфекционных заболеваний. Прогноз МДС определяется особенностями течения патологического процесса, своевременностью диагностических и общетерапевтических мероприятий. Своевременная терапия – единственный реальный шанс сохранить и продлить жизнь больных.
Этиология и патогенез
Гемопоэз – процесс кроветворения, который заключается в образовании и созревании клеток крови. Он происходит непрерывно, что связано с коротким сроком жизни клеток: от нескольких дней до 3-4 месяцев. Ежедневно в живом организме синтезируется огромное количество новых кровяных телец из клеток-предшественников. В процессе миелопоэза образуются миелоидные клетки – эритроцитарные, лейкоцитарные и тромбоцитарные клеточные элементы. Под воздействием негативных экзогенных и эндогенных факторов в костном мозге происходят патологические изменения, возникает расстройство кроветворения.

Этиология и патогенез МДС в настоящее время полностью не изучены. Ученые установили факторы, провоцирующие развитие патологии:
- загрязнения окружающей среды,
- радиоактивное излучение,
- табакокурение,
- опасные и вредные производственные факторы,
- контакты с агрессивными веществами,
- длительное проведение иммуносупрессивной терапии,
- врожденные генетические заболевания.
Первичный или идиопатический синдром — недуг невыясненной этиологии, который развивается в 80% случаев у лиц в возрасте 60-65 лет.
Вторичный синдром обусловлен воздействием на организм химиотерапевтических препаратов или лучевой терапии. Эта форма обычно развивается у молодых людей, быстро прогрессирует, отличается высокой устойчивостью к лечению и максимальным риском развития острого лейкоза.
В костном мозге вырабатываются все клеточные элементы крови. Там они находятся в незрелом состоянии, то есть являются предшественниками зрелых форм. По мере необходимости каждая из них превращается в полноценные клетки и выполняет жизненно важные функции, от которых зависит процесс дыхания, гемостаз, иммунная защита. При МДС стволовые клетки погибают до выхода в кровяное русло и не достигают своей функциональной зрелости. Это приводит к дефициту нормальных клеточных форм в крови и нарушению их функций, связанному с клеточной дисплазией.
МДС часто называют тлеющей лейкемией или предлейкозом, обусловленном генной мутацией стволовых клеток. Клональная пролиферация эритроидных, миелоидных и мегакариоцитарных форм приводит к неэффективному гемопоэзу и панцитопении. В костном мозге и крови происходят характерные морфологические изменения, обусловленные аномальной клеточной продукцией. У больных увеличивается печень и селезенка. Нестабильность синдрома обусловлена тенденцией к переходу в острый миелобластный лейкоз.
Симптоматические проявления
МДС не имеет специфической симптоматики. Его клинические проявления определяются степенью тяжести и формой недуга.
 Анемический синдром — постоянный и обязательный признак патологии. Для него характерны гиперхромия и макроцитоз. Большой размер эритроцитов и их интенсивное окрашивание, зависящее от повышенного содержания гемоглобина, – признаки анемии при МДС и остром лейкозе. При анемии больные быстро утомляются, плохо переносят физические нагрузки, жалуются на головокружение, одышку, боль в груди, костях и суставах, невозможность сосредоточится. Их кожа становится бледной, ухудшается аппетит, снижается вес и работоспособность, возникает нервозность, цефалгия, дрожь в теле, шум в ушах, сонливость, тахикардия, обмороки. Плохо переносят анемию престарелые больные, а также лица с сердечно-легочной патологией. У них могут развиться тяжелые последствия – стенокардия, инфаркт миокарда, аритмии.
Анемический синдром — постоянный и обязательный признак патологии. Для него характерны гиперхромия и макроцитоз. Большой размер эритроцитов и их интенсивное окрашивание, зависящее от повышенного содержания гемоглобина, – признаки анемии при МДС и остром лейкозе. При анемии больные быстро утомляются, плохо переносят физические нагрузки, жалуются на головокружение, одышку, боль в груди, костях и суставах, невозможность сосредоточится. Их кожа становится бледной, ухудшается аппетит, снижается вес и работоспособность, возникает нервозность, цефалгия, дрожь в теле, шум в ушах, сонливость, тахикардия, обмороки. Плохо переносят анемию престарелые больные, а также лица с сердечно-легочной патологией. У них могут развиться тяжелые последствия – стенокардия, инфаркт миокарда, аритмии.- Нейтропения характеризуется лихорадкой, снижением сопротивляемости организма к патогенным биологическим агентам, частым развитием инфекционных заболеваний бактериальной и вирусной этиологии. У больных повышается температура тела, потливость, возникает слабость, увеличиваются лимфоузлы. Сепсис и пневмония у таких пациентов часто заканчиваются летальным исходом.
- При тромбоцитопении кровоточат десна, появляются гематомы и петехии, часто течет кровь из носа, возникают длительные кровотечения после мелких хирургических вмешательств и различных инвазивных манипуляций. Возможно развитие внутренних кровотечений, меноррагий, кровоизлияний в головной мозг. Массивная потеря крови часто становится причиной смерти пациентов.
- У больных возникает лимфаденит, гепатомегалия, спленомегалия, специфическое поражение кожи — лейкемиды.
МДС долгое время может протекать бессимптомно или иметь стертое течение. Больные часто не обращают внимание на слабовыраженные клинические проявления и не посещают своевременно врача. Обычно МДС обнаруживают случайно во время проведения очередного медосмотра.
Диагностика
Диагноз МДС ставят после проведения лабораторного исследования периферической крови и гистологического исследования биоптата костного мозга. Специалисты изучают образ жизни больного, его анамнез, наличие профессиональных вредностей.

наиболее достоверный диагностический метод – трепанбиопсия костного мозга
Диагностические методы при МДС:
- гемограмма — анемия, лейкопения, нейтропения, моноцитоз; панцитопения – абсолютное показание для цитологического исследования костного мозга;
- биохимия крови – определение уровня железа, фолиевой кислоты, эритропоэтина, ЛДГ и АСТ, АЛТ, щелочной фосфатазы, мочевины;
- иммунограмма – специальный комплексный анализ, позволяющий определить, в каком состоянии находится иммунная система;
- гистология костного мозга выявляет деструкцию ткани, очаги поражения, наличие аномальных клеток, дисбаланс кроветворной и жировой ткани, гиперплазию всех ростков кроветворения, признаки дисплазии клеток;

Только после полноценной диагностики и постановки правильного диагноза можно переходить к лечению недуга.
Лечение
Интенсивное лечение МДС заключается в применении целого комплекса мероприятий. В тяжелых случаях медикаментозную терапию проводят в условиях стационара. Больные с более легкими формами синдрома лечатся амбулаторно или на дневном стационаре. Основными среди общетерапевтических мероприятий являются химиотерапия и иммуносупрессивные методики. Трансплантация костного мозга проводится при тяжелом течении болезни и повышает шансы больных на выздоровление.

Лечение МДС проводится с целю нормализации показателей периферической крови, устранения симптомов патологии, предупреждения трансформации недуга в острый лейкоз, улучшения и продления жизни больных.
Симптоматическая терапия направлена на устранение клинических проявлений синдрома и сопутствующих заболеваний, осложняющих течение основного недуга.
- Внутривенное капельное введение кровяных ингредиентов – тромбоконцентрата или эритроцитарной массы. Тромбоцитарную массу переливают редко.
- Для профилактики гемосидероза – «Дисферал».
- Иммуносупрессоры – «Леналидомид», антитимоцитарный и антилимфоцитарный глобулин, «Циклоспорин А», комбинации глюкокортикоидов.
- Химиотерапевтические средства – «Цитарабин», «Дакоген», «Мельфалан».
- Препараты-стимуляторы эритропоэза — железосодержащие препараты: «Ферроплекс», «Фенюльс», «Сорбифер дурулес»; препараты витаминов: «Цианкобаламин», «Фолиевая кислота»; анаболики-стероиды: «Анаполон», «Нандролон»; препараты эритропоэтина: «Эральфон», «Эпокомб»
- Стимуляторы лейкопоэза – «Нейпоген», «Лейкоген», «Метилурацил», «Интерлейкин».
- Ингибирование апоптоза – естественной гибели клеток – «Сандиммун», «Весаноид».
- Ингибиторы развития кровеносных сосудов – «Талидамид», «Ревлимид».
- Гипометилирующие средства – «Азацитидин».
- При развитии инфекционных осложнений — антибиотики и антимикотики.
Схема лечения и дозировка препаратов зависят от возраста пациента, степени тяжести заболевания и общего состояния здоровья. Эффективность медикаментозной терапии достаточно низкая и непродолжительная. Единственный способ спасти больного — выполнить пересадку костного мозга. В тяжелых случаях также проводят трансплантацию стволовых клеток. Несмотря на свою эффективность, эти способы лечения имеют много недостатков: являются дорогостоящими, имеют высокую вероятность отторжения трансплантата, требуют дополнительной подготовки пациента к операции, вызывают трудности в поиске подходящего донора.
В настоящее время развитие генной инженерии и культивирование клеток крови достигли нового уровня. С их помощью процесс кроветворения можно регулировать. Специалисты определяют сколько клеток недовырабатывается индивидуально у каждого больного, а затем переходят непосредственно к лечению.
С помощью любого из вышеперечисленных методов можно добиться полной ремиссии синдрома.
Профилактика
Специфической профилактики синдрома не существует. Профилактические мероприятия, не допускающие ухудшения состояния больных и предупреждающие трансформацию синдрома в лейкоз:
- укрепление иммунитета,
- сбалансированное питание,
- поддержание гемоглобина на оптимальном уровне,
- частые прогулки на свежем воздухе,
- своевременное обращение к врачу при появлении первых признаков синдрома,
- периодическая сдача анализов и прохождение необходимых исследований,
- гигиена кожи,
- защита от контактов с химическими веществами,
- защита от радиации,
- ограничение активной физической нагрузки,
- своевременное лечение простудных и инфекционных заболеваний.
Прогноз
Прогноз МДС неоднозначный. Он зависит от тяжести патологии и своевременности лечения. Продолжительность жизни при легких формах синдрома составляет 15 лет, при наличии тяжелого течения недуга она не превышает 10 месяцев. При отсутствии или неэффективности лечения МДС трансформируется в острый лейкоз. Адекватная терапия обеспечивает максимальное продление жизни. Наблюдение за больными, имеющими стертую клиническую картину и относительно благоприятное течение недуга, осуществляют постоянно, даже в период стабильных показателей крови и костного мозга.
У пожилых людей синдром протекает особенно тяжело и плохо лечится. Это связано с наличием у них хронических заболеваний и подавлением иммунитета. Их организм не справляется, и процесс выздоровления затягивается.
Видео: базовая информация о миелодиспластическом синдроме
Цитопения
Цитостатические лекарственные средства применяются для сдерживания и уничтожения злокачественных клеток. Однако после химиотерапии такими препаратами проявляется негативный побочный эффект: ухудшение работы костного мозга и последующее уменьшение в организме кровяных частиц, называемое цитопенией. Отличие патологии выделяется из её названия (греч. cyto – клетка, penia – недостаток). Обычно наблюдается изолированная нехватка лейкоцитов и тромбоцитов, реже – эритроцитов.
Причины возникновения и развития цитопении
Проявление заболевания выражается в двух факторах: разрушение кровяных телец в сосудах, а также ухудшение синтеза новых клеток.
Не считая воздействия на организм ряда медикаментов, причинами возникновения цитопении являются:
- Анемия (в том числе постцитостатическая), вызванная нехваткой железа и витаминов группы B.
- Инфекционные заболевания (туберкулёз, сифилис, гепатит, пневмония)
- Высокая скорость кровяного цикла.
- Миелодиспластический синдром и причины его образования (негативная генетика, вредное производство, курение, радиация).
- Онкологии, вызывающие ухудшение кровяного цикла: все виды лейкоза, метастазы костного мозга, миелома, лимфосаркома.
- Депрессия, частые стрессы, проявления шизофрении и другие ухудшения работы нервной системы.

- Дифференциация стволовых клеток в костном мозге, нарушающая его деятельность.
- При увеличении селезёнки – секвестрация в ней кровяных тел.
- Наследственная нейтропения (замедление роста и снижение концентрации отдельного вида белых тел в крови).
- Уничтожение эритроцитов антителами (аутоиммунная гемолитическая анемия).
- Цитомегалия и мононуклеоз, провоцирующие проблемы с балансом гормона роста и приводящие к остановке роста клеток крови.
- Пароксизмальная ночная гемоглобинурия (в кровеносных сосудах появляются склонные к гемолизу клоны эритроцитов).
Следствие развития цитопении – характерные для неё клинические признаки:
- уменьшение синтеза клеток крови и замедление их выхода;
- ускорение цикла кровообращения;
- поглощение и перераспределение кровяных тел в сосудах.
Виды цитопении и их характеристики
Цитопения – это ощутимый для организма дефицит клеток крови в организме. Болезнь обнаруживает разновидности: названия и особенности обусловлены нехваткой конкретного компонента системы кровообращения.
Двух-, трёхростковая, рефрактерная цитопения, панцитопения считаются симптомами миелодиспластического синдрома (МДС) – неспособности костного мозга воспроизводить клетки крови. Группа заболеваний МДС располагает кодом по МКБ-10 D46.
Эритроцитопения
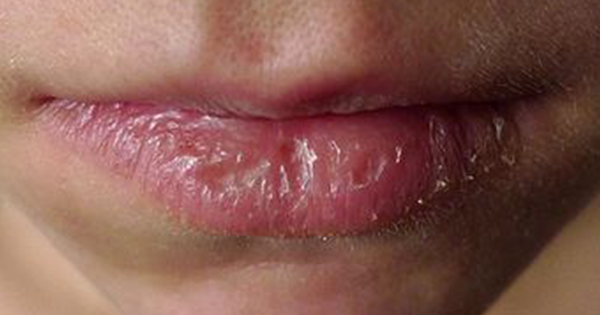
Нехватка красных кровяных тел. Патология вынуждает уменьшать количество гемоглобина и кислорода в организме, приводящее к утомлению и ухудшению состояния больного. По признакам патология характерна типичному оголоданию человека: озноб, слабое внимание, потеря массы, головокружение. Все видимые покровы портятся (растрескивание губ, бледность или пожелтение кожи, кариес и рыхлые дёсны на зубах).
Лейкопения
Лейкопения – пониженный уровень лейкоцитов в системе кровообращения. Уменьшение их количества негативно сказывается на иммунной системе человека: сопротивление болезням слабеет, даже незначительные недуги протекают в тяжёлой форме. Сопровождается частыми инфекционными заболеваниями, недомоганием и высокой температурой тела. На теле появляются прыщи, болячки, фурункулы, нагноения.
Тромбоцитопения
Тромбоцитопения представляет собой изолированный дефицит тромбоцитов в цикле кровообращения. Имеет код по МКБ-10 D69. Внешне распознаётся частыми кровотечениями из носа, кровохарканием, черным калом (кровоизлияния в кишечнике). Телесные повреждения (и сильные, и слабые) вызывают синяки. Причины – ухудшение свёртываемости и меньшая вязкость крови: как итог, кровотечение (как внутреннее, так и наружное) занимает больше времени для остановки.
Другие виды
Пониженное содержание всех видов составляющих цикла кровообращения приводит к панцитопении.
Угнетение работы нескольких ростков кроветворения означает заболевание двухростковой или трёхростковой цитопенией. Также возможна рефрактерная цитопения – поражение всех ростков: нехватка гемоглобина, тромбоцитов и лейкоцитов. Тяжёлым видам недуга подвержены люди старше 70 лет.
Диагностика
Обнаружить и искоренить сразу недуг не получится: на первых порах заметных признаков нет. Количество элементов крови уменьшается постепенно: к плавным переменам организм стремится приспосабливаться. Симптомы проявляются только при длительном развитии патологии.

Диагностика цитопении
Вероятное развитие цитопении возможно отследить при долгом наблюдении ряда общих симптомов: по частой заболеваемости, утомлению, недомоганиям, ломким ногтям, выпадению волос.
Точное определение наличия и разновидности патологии устанавливается специалистами. Диагностика заболевания проходит в ряд последовательных шагов:
- Началом послужит беседа больного с врачами. Затем, собрав необходимые сведения (анамнез, вероятность наследственных патологий) и проведя полный клинический осмотр, устанавливается характер заболевания.
- Следующий шаг – внутренний осмотр. Включает общий и биохимический анализ крови и мочи. Проводится иммунологическая и серологическая экспертиза (на уровень сопротивляемости организма и стадию развития уже имеющейся болезни).
- Забор пункции костного мозга, анализ полученных тканей.
- Выведение миелограммы (результатов анализа состояния костного мозга): изучение хода кроветворения.
- УЗИ брюшной полости (проверка на увеличение органов), МРТ и ПЭТ при необходимости.
Диагностика МДС
Обнаруживается и устанавливается диагноз МДС после гистологического и цитологического изучения поражённого органа.
Двухростковая цитопения – синдром рефрактерной цитопении с мультилинейной дисплазией (РЦМД): 10% клеток с нарушенным развитием, дефект двух или трёх ростков кроветворения.
Цитопения конкретного вида клеток – неклассифицированный МДС (с одноростковой дисплазией и отсутствием бластов) или рефракторная анемия (при наличии бластов).
Панцитопения вкупе с повышенным числом кольцевых сидеробластов (свыше 15%) говорит о РЦМД с кольцевыми сидеробластами.
Лечение цитопении
В случае подтверждения заболевания врачом-гематологом проводится лечение. Оно требует стационарных условий, а также регулярно сдавать кровь на анализ. Важно помнить: указанная болезнь – не самостоятельный недуг, а сопровождение другой патологии. Курс, нацеленный только на применении мер против цитопении, будет бесполезным.
Общее лечение заболевания
Обычное лечение (на предмет сниженного иммунитета) предусматривает употребление пациентом гормональных кортикостероидов и глюкокортикостероидов. Также гематологами выявляется нехватка минералов и иных компонентов крови: составляются курсы употребления витаминов и правильного питания, сравнение состояния пациента до, во время и после терапии. При острой необходимости допускается переливание крови. Результат терапии непредсказуем: возможен как положительный, так и негативный итог. Во время лечения процедуры и препараты подбираются с учётом особенностей патологии.
Лечить пациента стандартным курсом достаточно, если основной болезнью стала лёгкая или средняя степень анемии: восполняется недостаток железа, белков и витамина В12.
Цитопения обнаруживается не только у взрослых, но и у детей всех возрастов. Их комплекс лечения предполагает принятие Цитозара – предусматривается как дифференциальная, так и комбинированная терапия. Универсальность препарата делает его ключевым средством в достижении ремиссии раковых опухолей.
Специфическое лечение цитопении
По сравнению с консервативной терапией, к углублённому варианту лечения недуга прибегают, если заболевание-источник признан тяжёлой патологией.
При лейкозе, миеломе, метастазах костного мозга и иных онкологических заболеваниях в развитой форме стационарного лечения и насыщения организма становится недостаточно. Если применение цитозара также не привело к желаемым результатам, проводится хирургическое вмешательство: выполняется пересадка костного мозга. Эта операция считается наиболее действенным способом избавления от цитопении. Другой возможной процедурой (при соответствующих медицинских показаниях) считается удаление селезёнки.
После выполненных хирургических процедур назначается симптоматическое лечение. От правильно организованной диеты, восполняющей послеоперационную бедность организма питательными веществами, витаминами и минералами, и распределения физических нагрузок зависит восстановление организма и возвращение полноценной жизнедеятельности человека. Симптомы проходят, состояние нормализуется.
Профилактика и прогноз жизни
Методы, предупреждающие развитие цитопении на ранних сроках, отсутствуют: из-за адаптации организма начальную стадию невозможно распознать. Цель профилактических мер – уменьшить число обострений.
Предупреждающие мероприятия
Для профилактики переболевшему патологией нужно регулярно сдавать анализ крови и проходить обследование у врача-гематолога. Норма посещений – не реже 1 раза в полгода (или каждые 4 месяца, если риск рецидива велик).
Выздоровевший пациент для профилактики цитопении должен соблюдать каждый элемент здорового образа жизни:

- Здоровое питание: обогащение рациона свежими фруктами, ягодами, орехами, злаками, нежирным мясом и молоком, избегание жареной и жирной еды.
- Занятия лечебной физкультурой, двигательная активность: развивается кровообращение, улучшается иммунитет, стабилизируется работа сердца и лёгких.
- Полный отказ от вредных привычек: курения, алкоголя, переедания.
- Следование рекомендациям лечащего врача, регулярное употребление прописанных препаратов.
Сроки жизни после хирургической и химической терапии
Прогноз жизни и возможность полноценной жизнедеятельности зависит от общего физического состояния пациента, его возраста и заболевания, послужившего причиной развития цитопении. Практика показывает: после химиотерапии и остальных необходимых мер 4 из 5 переболевших гарантировано восстановление до нормы и пятилетний срок жизни.
При лейкозе в ранней стадии, анемии, инфекционных заболеваниях в случае их успешного преодоления обычно даётся положительный прогноз жизни.
Лечение миелодиспластического синдрома в тяжёлой форме зависит от своевременного переливания крови и трансплантации костного мозга (в особых случаях – стволовых клеток). Но, учитывая, что 80% больных – люди старше 60 лет (с ожидаемым сроком жизни до 12 лет), вопрос о применении хирургических мер почти не поднимается. Основной метод – лечение низкой интенсивности (переливание эритроцитов, белковое питание, химиотерапия) и поддерживающие меры для улучшения состояния и посильного продления существования.
В сравнении с довольно «лёгкими» патологиями, на поздних сроках онкологических недугов и метастазов в системе кровообращения также применяются лишь общие лечебные процедуры по поддержанию внешнего качественного состояния здоровья пациента. Неизлечимые патологии неизбежно ведут к смерти больного.
СИНДРОМ МИЕЛОДИСПЛАСТИЧЕСКИЙ
Миелодиспластический синдром (МДС) — группа патологических состояний, характеризующихся нарушением гемопоэза во всех ростках, проявляющемся панцитопенией. МДС часто трансформируется в острый лейкоз или апластическую анемию. Частота. Увеличение заболеваемости (1-2 на 100000) в последние годы может быть связано с более точной диагностикой. Преобладающий возраст — старше 65 лет.
❐ Факторы риска
● Эндогенные: хромосомные и генетические нарушения
● Экзогенные: длительный контакт с продуктами органической химии, радиация, инсоляция, применение некоторых ЛС (например, хлорамфеникол, цитостатики).
● Рефрактерная анемия с кольцевыми сидеробластами — 15% кольцевых сидеробластов,
● Рефрактерная анемия с избытком бластов — 5-20% бластов в костном мозге,
● Рефрактерная анемия с избытком трансформирующихся бластов — или 20-30% бластов в костном мозге, или >5% бластов в крови, или наличие палочек Ауэра
● Хроническая ми-еломоноцитарная анемия — 1-20% бластов в костном мозге, 1х109/л
● Рефрактерная цитопения -похожа на рефрактерную анемию, но кроме этого может быть лейкопения или тромбоцитопения без анемии
● Рефрактерная анемия с дис-плазией — выраженная дисплазия всех трёх ростков без избытка бластов
● Острый МДС со склерозированием — рефрактерная анемия с избытком бластов и выраженным склерозом
❐ Клиническая картина
● Интоксикация — субфебрильная температура тела, усиленное потоотделение, слабость, вялость, понижение аппетита, снижение массы тела
– бледность кожных покровов и видимых слизистых оболочек, нарушение микроциркуляции
● Геморрагический синдром — экхимозно-петехиальная сыпь, кровотечения из слизистых оболочек
● Спленомегалия, гепатомегалия (редко)
● Инфекционные осложнения вследствие лейкопении.
❐ Лабораторные исследования
● Периферическая кровь — анемия макроцитарная, возможны ретикулоцитоз, гранулоцитопения (гипо-гранулярные или агранулярные нейтрофилы со слабо конденсированным хроматином), тромбоцитопения
● Биохимический анализ крови -увеличение уровня HbF до 70%
● Прямой антиглобулиновый тест
Кумбса положителен в некоторых случаях
● Миелограмма — незначительное увеличение содержания бластов, гипоплазия эритроидного и миелоидного ростков, ретикулярный фиброз выражен слабо, аномальная локализация незрелых предшественников
● Количество клеток костного мозга обычно нормально, у 10% возможно выявление гипоплазии.
❐ Специальные исследования
● Тест определения функций гранулоцитов — снижение миелопероксидазной активности, фагоцитоза, хемотаксиса и адгезии
● Тест определения функций тромбоцитов — нарушение агрегации, адгезии
● Иммунофеноти-пирование — используют неспецифические миелоидные маркёры
● Рентгенография органов грудной клетки
● УЗИ — увеличение печени и селезёнки
❐ Дифференциальный диагноз
● Гемобластозы (например, острый миелобластный лейкоз, эритремия, хронический миелолейкоз, истинная полицитемия)
● Костномозговые метастазы солидных опухолей
● Аутоиммунные заболевания (например, СКВ)
● Нарушение обмена (например, белкового)
● Токсические поражения (например, интоксикация тяжёлыми металлами, алкоголем)
● Хронические болезни печени (например, гепатит, цирроз)
● Миелодепрессивный синдром (после проведения цито-статической и лучевой терапии)
❐ Лечение:
✎ Режим:
● Показания к стационарному лечению
● Тяжёлое состояние больного, истощение
● Присоединение инфекционных осложнений
● Панцитопения, требующая заместительных гемотрансфузий. Лекарственная терапия — симптоматическая
● Антибактериальная терапия (предпочтительнее антибиотики широкого спектра действия), противогрибковые, антивирусные препараты
● Гемостатики, ангиопротекторы (например, кислота аминокапроновая, дицинон [этамзилат])
● Общеукрепляющая, дезинтоксикационная терапия (р-р глюкозы, препараты калия, витамины, АТФ, кокарбоксилаза, рибоксин)
● Биопрепараты при выраженной лейкопении (например, коли-бактерин, бифи-дум-бактерин)
● Трансфузионная терапия по показаниям -см. Анемия апластическая (переливания отмытой эритроци-тарной массы, тромбоцитарной взвеси)
● Даназол или предни-золон — при сопутствующей аутоиммунной тромбоцитопении. Трансплантация костного мозга показана больным моложе 35 лет.
✎ Меры предосторожности. Следует избегать назначения аспирина, салицилатов и других НПВС.
Ведение больного. Наблюдение 1 р/мес в перерывах между курсами поддерживающей терапии. Необходим контроль периферической крови, миелограммы (для исключения трансформации МДС в острый лейкоз или аплазию).
✎ Прогноз
● Средняя продолжительность жизни для больных с рефрак-терной анемией, рефрактерной анемией с кольцевыми сидеробластами составляет 5 лет
● Средняя продолжительность жизни больных с рефрактерной анемией с избытком бластов, рефрактерной анемией с избытком трансформирующихся бластов и хронической миеломоно-цитарной анемией составляет 1 год
● Отягощают течение и ухудшают прогноз геморрагический синдром, генерализованные инфекции.
❐ Синонимы
● Прелейкоз См. также Лейкоз
✎ Сокращения: МДС — Миелодиспластический синдром МКБ. D46 Миелодиспластические синдромы
Миелодиспластический синдром код по мкб 10
Детская глаукома
- 1 Общие сведения о недуге
- 2 Этиология и патогенез недуга
- 2.1 Стадии проявление глаукомы у детей:
- 3 Синдромы, при которых развивается врожденная глаукома
- 4 Какие наблюдаются симптомы?
- 5 Диагностические меры
- 6 Что включает в себя лечение?
- 7 Профилактические мероприятия

Многие годы безуспешно боретесь с ГИПЕРТОНИЕЙ?
Глава Института: «Вы будете поражены, насколько просто можно вылечить гипертонию принимая каждый день.
Тяжелым глазным недугом, который редко встречается и ведет к слепоте, является глаукома у детей. Под детской глаукомой понимают ряд разных болезней. Также заболевание называют зеленой катарактой из-за того, что у пациента неподвижный зрачок зеленого оттенка. Ученым до сих пор не удалось выяснить причины появления и развития недуга, и они не могут дать единого описания заболевания.
Для лечения гипертонии наши читатели успешно используют ReCardio. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…

Общие сведения о недуге
Для глаукомы у детей характерно увеличение показателей внутриглазного давления как на постоянной основе, так и периодически. При этом у пациента появляются трофические расстройства, поражающие сетчатку, зрительный нерв и оттоковые каналы жидкости, циркулирующей внутри глаза. Вследствие этого в поле зрения маленького пациента появляются зрительные искажения и развиваются краевые углубления в дисках зрительных нервов.
Болезнь имеет врожденный или первичный характер. Какого бы типа ни была детская глаукома, признаки недуга отличаются от симптомов у взрослых пациентов. У маленьких детей и подростков недуг встречается реже, чем у пациентов в возрасте. Если вовремя не обратить внимание на болезнь, то ребенок ослепнет, и это не удастся ничем исправить. По МКБ-10 детская глаукома имеет код Н40. К основным типам недуга относят:
- Вторичную глаукому, которая развивается из-за перенесенных в утробе травм либо воспалительных болезней глаз.
- Инфантильную форму, для которой характерно отсутствие светобоязни, а размер и цвет глазного яблока находится в пределах нормы.
- Ювенильный вид, который диагностируют от 3-х лет и выше. Ювенильная глаукома проявляется с признаками старения, врожденными недугами передней глазной области или развивается на фоне близорукости.
Вернуться к оглавлению
Этиология и патогенез недуга
 Появление болезни, может быть врожденным и приобретенным,выявить болезнь может только квалифицированный врач.
Появление болезни, может быть врожденным и приобретенным,выявить болезнь может только квалифицированный врач.
Заболевание может быть врожденным или приобретенным. На появление врожденного типа болезни влияет внутриутробная инфекция, проявившаяся при беременности матери. Фактором развития может быть отравление токсическими веществами, злоупотребление алкогольных напитков и курение. Врожденная форма появляется из-за радиационного облучения, при патологическом развитии плода и вследствие гипоксии. Если в процессе вынашивания организм матери был поражен инфекционными недугами (свинкой, краснухой, полиомиелитом и т. д.), то после рождения у малыша возможно развитие глаукомы. Приобретенный тип (юношеская глаукома) появляется из-за таких факторов:
- высокое АД;
- нарушенное функционирование нервной и эндокринной систем;
- генетическая предрасположенность к появлению зрительных недугов;
- появление глазных недугов (близорукости или дальнозоркости);
- повышение внутриглазного давления;
- наличие сахарного диабета;
- появление лишнего веса;
- недуги сердечно-сосудистой системы;
- глазные травмы.
Вернуться к оглавлению
Стадии проявление глаукомы у детей:
- В зоне глазного яблока ухудшается отток жидкости.
- Повышение ВГД до показателей, превышающих норму.
- Ухудшение кровообращения в глазных тканях.
- Появление гипоксии в области, где находится выход зрительного нерва.
- Передавливание нервного волокна, нарушение функционирования.
- Дистрофические, атрофические и деструктивные проявления в зрительном волокне.
- Развитие оптической глаукомной нейропатии, отмирание зрительного нерва.
Вернуться к оглавлению
Синдромы, при которых развивается врожденная глаукома
| Синдром | Описание |
| Синдром мраморности покровов кожи | Врожденный вид недуга выявляется при наличии мраморной структуры кожных покровов при врожденных телеангиоэктазиях. Синдром выявляют у пациентов в редких случаях. Для него характерно появление сосудистых расстройств из-за поражения покровов кожи. У маленького пациента наблюдаются апоплексические удары, мраморные кожные покровы, возможно появление судорожных признаков и глаукомы. |
| Аномалия Петерса | При болезни у маленького пациента мутнеет роговица. Также у малыша развивается дефект десцеметовой мембраны, стромы и эндотелия. |
| Нейрофиброматоз | Первый тип нейрофиброматоза сочетается с плексиформной невромой орбиты. |
| Синдром Рубинштейна-Тейби | Недуг проявляется редко, при этом наблюдается антимонголоидный разрез глаз, у человека широкие пальцы рук и ног, удлиненные ресницы. |
| Синдром Стерджа-Вебера | Для недуга характерно появление ангиом внутри черепа. При этом глаукому определяют в 30% случаев проявления синдрома. Глаукому диагностируют чаще у маленьких детей, реже — у школьников. |
Вернуться к оглавлению
Какие наблюдаются симптомы?
 Первые проявления глаукомы у детей повышенная слезоточивость.
Первые проявления глаукомы у детей повышенная слезоточивость.
Для врожденной формы болезни характерно развитие недугов сердечно-сосудистой системы, микроэнцефалии (размер головного мозга не соответствует норме), факоматозов (поражение кожных покровов, глаз, внутренних органов человека), а также у пациента отсутствует слух. При приобретенной форме недуга наблюдается зрительный дискомфорт (чувство, что на глазах находится пленка, а также ощущение, что перед глазами летают мелкие «мошки»). Также наблюдаются такие признаки глаукомы:
- увеличивается слезовыделение;
- повышается ВГД;
- увеличение роговицы и глазного дна;
- деформируется форма глаза;
- снижается реакция зрачков;
- отекает роговица;
- появляются болевые ощущения в области головы;
- у пациента преобладает общее недомогание.
Вернуться к оглавлению
Диагностические меры
Если подозревают развитие глаукомы у маленького пациента, врач назначает комплексное обследование, в процессе которого применяется общая анестезия. У ребенка проводят замеры ВГД, исследуют глазное состояние и глазную работоспособность. Кроме того, проводят исследование диска зрительного нерва. При исследовании организма маленьких пациентов не используют диагностические методы, которые назначают взрослым людям.
Вернуться к оглавлению
Что включает в себя лечение?
 Для лечения глаукомы у детей используеться оперативное вмешательство.
Для лечения глаукомы у детей используеться оперативное вмешательство.
Глаукома у детей не лечится только с помощью медикаментозной терапии. Консервативные методы лечения назначают для стабилизации внутриглазного давления перед проведением операции. Количество лекарств назначают в зависимости от веса пациента. Эффективным средством в лечении недуга является оперативное вмешательство. Если вовремя обратиться к врачу, то возможен благоприятный прогноз, а зрение и глаза ребенка сохранятся. После операции наступает этап восстановительной терапии, чтоб состояние пациента улучшилось.
Вернуться к оглавлению
Профилактические мероприятия
Чтобы предупредить развитие недуга, родители малышей каждый год должны водить ребенка к офтальмологу. Если у маленького пациента проблемы со зрением, осмотры проводятся раз в полгода. Родители должны следить за тем, чтоб ребенок занимался спортом, в его рационе присутствовали необходимые минералы и витамины, и чтоб он не ел вредную продукцию. Ребенку нельзя смотреть телевизор более 1—1,5 часов в день или сидеть за компьютером более 2-х часов. Рекомендуется оградить малыша от стрессовых ситуаций.
Дополнительная хорда левого желудочка
 Дополнительная хорда в левом желудочке -диагноз, который устанавливается только на основе УЗИ, ни при выслушивании, ни при ЭКГ выявить ее невозможно. Конечно, если у молодого пациента шум в сердце и не подозревается серьезный порок, то врач может предположить, что это либо дополнительная хорда, либо пролапс клапана.
Дополнительная хорда в левом желудочке -диагноз, который устанавливается только на основе УЗИ, ни при выслушивании, ни при ЭКГ выявить ее невозможно. Конечно, если у молодого пациента шум в сердце и не подозревается серьезный порок, то врач может предположить, что это либо дополнительная хорда, либо пролапс клапана.
Очень часто не чистые на руку врачи, особенно педиатры, послушав ребенка и сделав задумчивый вид, говорят, что у ребенка шум в сердце и это дополнительная хорда, и надо срочно делать УЗИ сердца в «таком-то» месте и выписывают направление, на красивом бланке частной клиники, ставя там свою печать. При этом в амбулаторной карточке не пишут ни слова о шуме и если сходить к не заинтересованному эксперту, то окажется, что и шума-то никакого нет. Ведь, при дополнительной хорде шум в сердце чрезвычайно редкое явление.
Сама по себе дополнительная хорда представляет собой тяж, который крепиться одной стороной к створке клапана, а другой — к стенке сердца. Таких хорд у каждого человека имеется несколько и их основная функция – помогать клапану не прогибаться и удерживать кровь в то время, когда сердце сокращается. Если одна или несколько из этих хорд более толстая или плотная, то она становиться видна при УЗИ. Об этом непременно пишут в заключении, чаще всего добавляя слово «гемодинамически незначимая» — т.е. никак не влияющая на работу сердца. Такая хорда не требует лечения и вообще не стоит особо обращать на нее внимания.
Если дополнительная хорда все-таки гемодинамически значима, то необходимо идти на консультацию к кардиохирургу. Но не волнуйтесь, это совсем не означает, что ее придется иссекать, просто нужно разобраться в сложившейся ситуации.



