Врожденные пороки сердца
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
НЦССХ имени А.Н. Бакулева РАМН, Москва
В рожденные пороки сердца (ВПС) — достаточно распространенная патология среди заболеваний сердечно-сосудистой системы, которая является основной причиной смерти детей первого года жизни. Частота ВПС составляет 30% от всех пороков развития. Лечение врожденных сердечных аномалий возможно только хирургическим путем. Благодаря успехам кардиохирургии стали возможны сложные реконструктивные операции при ранее неоперабельных ВПС. В этих уcловиях основной задачей в организации помощи детям с ВПС является своевременная диагностика и оказание квалифицированной помощи в хирургической клинике.
Основными причинами рождения детей с ВПС являются: хромосомные нарушения – 5%; мутация 1-го гена – 2–3%; влияние внешних факторов (алкоголизм родителей, прием лекарственных препаратов, перенесенные вирусные инфекции во время беременности и т.д.) – 1–2% ;полигенно-мультифокальное наследование – 90%.
Помимо этиологических выделяют факторы риска рождения ребенка с ВПС. К ним относятся: возраст матери, эндокринные заболевания супругов, токсикоз и угроза прерывания I триместра беременности, мертворожденные в анамнезе, наличие детей с врожденными пороками развития у ближайших родственников. Количественно оценить риск рождения ребенка с ВПС в семье может только генетик, но дать предварительный прогноз и направить родителей на медико-биологическую консультацию может каждый врач.
Встречается более 90 вариантов ВПС и множество их сочетаний. В Институте сердечно-сосудистой хирургии им. А.Н. Бакулева АМН СССР была разработана классификация, основанная на распределении ВПС с учетом анатомических особенностей порока и гемодинамических нарушений.
Для практикующих врачей-кардиологов удобнее пользоваться более упрощенным делением ВПС на 3 группы:
1. ВПС бледного типа с артериовенозным шунтом: дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП); открытый атриовентрикулярный канал (АВК).
2. ВПС синего типа с веноартериальным шунтом: транспозиция магистральных сосудов (ТМС), тетрада Фалло (ТФ), триада Фалло, атрезия трикуспидального клапана (АТК) и т.д.
3. ВПС без сброса, но с препятствием на пути кровотока из желудочков (стенозы легочной артерии и аорты). Такое деление охватывает 9 наиболее распространенных ВПС.
Нарушение гемодинамики при врожденных пороках сердца
Не случайно во всех предложенных классификациях большое внимание уделено оценке нарушений гемодинамики при ВПС, так как степень этих нарушений тесно связана с анатомической тяжестью порока, от них зависит тактика медикаментозного лечения и сроки выполнения операции.
ВПС вызывает ряд изменений компенсаторного характера, которые заставляют перестраиваться весь организм ребенка, но при длительном существовании порока процессы компенсации ведут к выраженным деструктивным изменениям органов и систем, что приводит к гибели больного.
В зависимости от состояния малого круга кровообращения в организме больного с ВПС наблюдаются следующие патологические изменения:
• при наличии увеличенного кровотока в легких (пороки бледного типа с артериовенозным шунтом) развивается гиперволемия и гипертензия малого круга кровообращения;
• при наличии обедненного кровотока в легких (пороки синего типа с веноартериальным шунтом) у больного развивается гипоксемия;
• при увеличении кровотока в малом круге кровообращения развивается гиперволемия и легочная гипертензия.
Примерно 50% детей первого года жизни с большим сбросом крови в малый круг кровообращения без хирургической помощи погибают при явлениях сердечной недостаточности. Если ребенок переживает этот критический период, то к году в результате спазма легочных артериол уменьшается сброс крови в малый круг и состояние ребенка стабилизируется, однако это улучшение касается только самочувствия больного, так как одновременно начинают развиваться склеротические процессы в сосудах легких. Существует много классификаций легочной гипертензии. Для практики наиболее удобной является классификация, разработанная в ИССХ им. А. Н. Бакулева АМН СССР (В.И. Бураковский и соавт., 1975). Она основана на величине давления в легочной артерии, степени сброса крови и соотношении общелегочного сопротивления к показателям большого круга кровообращения (табл. 1).
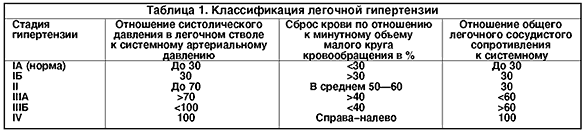
Согласно этой классификации, больные делятся на 4 группы, где I и III стадия разделены на подгруппы А и Б. Больные IА группы имеют небольшие нарушения гемодинамики и нуждаются в наблюдении кардиолога. У больных IБ и II группы ставится вопрос об операции. Легочная гипертензия в этих группах носит функциональный характер.
У больных III группы при большом сбросе крови в малый круг изменения в легочных сосудах значительно более выражены. При IIIА гемодинамической группе возможна радикальная коррекция порока, и давление после операции снижается. В IIIБ и IV группе хирургическое лечение не показано. Дифференциальный диагноз между IIIА и Б группами сложен, и нередко для решения вопроса об операбельности порока необходимо выполнить внутрисосудистое ультразвуковое исследование и/или биопсию легкого для изучения морфологических изменений в легочных сосудах. Для оценки этих изменений наиболее часто используется классификация, предложенная Д. Хитом и Дж. Эдвардсом в 1958 г. (табл. 2).

При цианотических формах ВПС наличие сброса венозной крови в артериальную или смешение крови ведут к увеличению объема крови в большом круге кровообращения и уменьшению в малом, что приводит к снижению насыщения крови кислородом (гипоксемии) и к появлению цианоза кожи и слизистых. Для улучшения доставки кислорода к органам и повышения эффективности вентиляции происходит развитие коллатерального кровообращения между сосудами большого и малого круга кровообращения. Перестройка коллатеральной сети кровообращения происходит в сосудах всех органов. Особенно это выражено в сосудах сердца, легких и головного мозга.
Благодаря компенсаторным механизмам состояние больного с цианотическими формами ВПС, несмотря на тяжелые нарушения гемодинамики, может быть длительно удовлетворительным, но постепенно компенсаторные механизмы истощаются, длительная гиперфункция миокарда приводит к развитию тяжелых необратимых дистрофических изменений в сердечной мышце. Поэтому оперативное вмешательство при цианотических пороках (радикальное или паллиативное) показано в самом раннем детском возрасте.
Первичная диагностика ВПС основывается на данных неинвазивных методов исследования. Большое значение для диагностики имеет целенаправленный сбор анамнеза у родителей ребенка. При бледных пороках сердца необходимо выяснить, часто ли болеет ребенок респираторными инфекциями, были ли у него пневмонии, так как это говорит о большом сбросе крови слева-направо. С другой стороны, прекращение респираторных инфекций у больного с большим сбросом крови в малый круг говорит о начале развития легочной гипертензии. Это должно быть поводом для направления больного к кардиохирургу. Естественное течение ВПС может осложниться развитием инфекционного эндокардита, поэтому необходимо выяснить, бывают ли у ребенка подъемы температуры тела без признаков респираторной инфекции. Следует также выяснить, не было ли у больного синкопальных состояний, судорожного синдрома, которые могут быть следствием аритмий сердца.
При осмотре ребенка с подозрением на ВПС необходимо отметить цвет кожных покровов и слизистых. Цианоз может быть периферическим и генерализованным. Важно отметить наличие или отсутствие цианоза на всех 4 конечностях, так как при некоторых ВПС наблюдается дифференцированный цианоз (предуктальная коарктация аорты, транспозиции магистральных сосудов в сочетании с перерывом дуги аорты). При осмотре грудной клетки необходимо отметить деформацию грудной клетки в области сердца — появление так называемого сердечного горба (по величине и локализации которого можно косвенно судить о сложности ВПС и/или развитии легочной гипертензии).
При пальпации грудной клетки у больного с ВПС можно отметить смещение верхушечного толчка, изменение его площади, наличие “дрожания” над областью сердца. Пальпация позволяет оценить размеры печени и селезенки. Методом перкуссии определяют размеры сердца, печени и селезенки.
Аускультация является наиболее информативным методом физикального обследования больных с ВПС. При аускультации можно отметить изменение тонов сердца (усиление, ослабление или расщепление), появление шумов, а также их локализацию, иррадиацию и место максимального выслушивания. Интенсивность шума не всегда коррелирует с тяжестью порока, например, при ВПС с легочной гипертензией и синих пороках со стенозом легочной артерии эта зависимость носит обратный характер. При аускультации легких можно выявмть признаки застоя в малом круге.
Физикальное исследование дополняется проведением неинвазивного инструментального обследования, которое включает электрокардиографию (ЭКГ), фонокардиографию (ФКГ) и рентгенографию органов грудной клетки.
ЭКГ позволяет судить о гипертрофии различных отделов сердца, патологических отклонениях электрической оси, наличии нарушений ритма и проводимости. Изменения на ЭКГ не являются специфичными для какого-либо порока, но в сочетании с данными, полученными при клиническом обследовании и с помощью других неинвазивных методов, позволяют судить о тяжести порока. Разновидностью метода ЭКГ является холтеровское суточное ЭКГ-мониторирование, которое помогает выявить скрытые нарушения ритма и проводимости.
Следующим неинвазивным методом обследования кардиологических больных является ФКГ, которая воспроизводит данные аускультации сердца и позволяет более детально и количественно оценить характер, продолжительность и локализацию сердечных тонов и шумов.
Рентгенография органов грудной клетки дополняет предыдущие методы и позволяет оценить: состояние малого круга кровообращения (наличие артериального или венозного застоя, снижение наполнения сосудов легких); расположение, форму, размеры сердца и его отдельных камер; изменения со стороны других органов и систем (легкие, плевра, позвоночник, а также расположение внутренних органов).
Сочетание ЭКГ, ФКГ и рентгенография органов грудной клетки позволяет диагностировать большинство изолированных пороков и предположить наличие сложных ВПС.
Наиболее высокоинформативным неинвазивным методом исследования является эхокардиография (ЭХОКГ). С появлением данной методики, особенно двухмерной ЭХОКГ, значительно расширились возможности диагностики ВПС. Этот метод позволяет провести анатомически точную диагностику дефектов перегородок сердца, поражения атриовентрикулярных и полулунных клапанов, размеры и расположение камер сердца и магистральных сосудов, а также оценить сократительную способность миокарда. При определенных пороках (неосложненные ДМПП, ДМЖП, ОАП, частично открытый АВК, коарктация аорты) можно выполнить операцию без проведения катетеризации сердца. Однако в ряде случаев при сложных ВПС и сопутствующей легочной гипертензии необходимо провести катетеризацию сердца и ангиокардиографию, так как эти методы позволяют провести точную анатомическую и гемодинамическую диагностику ВПС. Проведение катетеризации сердца возможно только в условиях специализированной кардиохирургической клиники. В настоящее время при проведении катетеризации сердца в случае необходимости выполняется электрофизиологическое исследование для уточнения механизма аритмий сердца, оценки функции синусового и атриовентрикулярного узлов, а также проводятся различные эндоваскулярные операции: баллонная ангиопластика при стенозах легочной артерии и аорты; эмболизация небольших ОАП, коронаросердечных фистул, аортолегочных коллатералей; баллонная атриосептостомия при простой ТМС и стентирование легочных сосудов при периферических стенозах.
Тактика хирургического лечения
Тактика оказания помощи больным с ВПС строится с учетом течения порока, эффективности консервативного лечения, возможности и риска проведения хирургического лечения. После установления диагноза необходимо решить:
1. Как лечить больного (медикаментозно или хирургически)?
2. Определить сроки выполнения операции.
Ответить на эти вопросы помогает классификация, предложенная J. Kirklin и соавт. (1984).
0-я группа – больные с ВПС, с незначительными нарушениями гемодинамики, которые не нуждаются в операции.
1-я группа – больные, состояние которых позволяет провести операцию в плановом порядке ( через год и более).
2-я группа – больные, которым операция показана в ближайшие 3–6 мес.
3-я группа – больные с тяжелыми проявлениями ВПС, которых необходимо оперировать в течение нескольких недель.
4-я группа – больные, нуждающиеся в экстренной операции (в течение 48 ч после госпитализации).
Наиболее сложная проблема в кардиохирургии – операция у детей первого года жизни с ВПС. Хирургическая летальность в последние годы значительно снижена и отличается от высокой естественной смертности при ВПС. Операция у детей первого года жизни выполняется в том случае, если консервативными методами не удается достичь стабилизации состояния. Большинство неотложных операций выполняются у детей с цианотическими ВПС.
Если у новорожденного с ВПС отсутствуют признаки сердечной недостаточности, цианоз выражен умеренно, то консультация кардиохирурга может быть проведена позднее. Наблюдение за такими детьми осуществляет кардиолог по месту жительства. Такая тактика позволяет провести обследование больного в более благоприятных условиях, снизить риск проведения инвазивных методов исследования и оперативного вмешательства.
В более поздней возрастной группе хирургическая тактика при ВПС зависит от тяжести патологии, предполагаемого прогноза, возраста и массы тела больного. K.Turley и соавт. в 1980 г. предложили разделить ВПС на 3 группы, в зависимости от вида возможной операции.
К 1-й группе относятся такие наиболее часто встречающиеся пороки, как ОАП, ДМЖП, ДМПП, частично открытый АВК, коарктация аорты, стеноз и недостаточность митрального и аортального клапанов. При установлении данных пороков единственным выбором может быть операция. Она может быть отложена, если нарушения гемодинамики нерезко выражены, а возраст ребенка и масса тела слишком малы (более поздний возраст и достаточная масса тела снижают риск выполнения кардиохирургических вмешательств).
Во 2-ю группу входят сложные цианотические пороки, такие, как тетрада Фалло, стеноз легочной артерии, атрезия легочной артерии 1-го типа, транспозиция магистральных сосудов и др. Выбор между радикальной и паллиативной операцией зависит от анатомической тяжести порока, степени гипоксемии и массы тела ребенка.
К 3-й группе относятся ВПС, при которых возможна только паллиативная или гемодинамическая коррекция порока. К ней относятся различные варианты сложных пороков: атрезия трикуспидального и митрального клапанов, двухкамерное сердце, синдром гипоплазии правого и левого сердца, единственный желудочек сердца и др.
Радикальная коррекция простых неосложненных пороков не представляет технических трудностей для специализированной кардиохирургической клиники. При ДМЖП и ДМПП выполняется ушивание или пластика дефектов заплатой, при ОАП – перевязка или пересечение протока. При выраженной гипоксемии первым этапом у больного с ВПС проводится паллиативная операция – наложение различных межсистемных анастомозов. После проведения операции улучшается насыщение крови кислородом, что позволяет ребенку развиваться в более благоприятных условиях. Выполнение двухэтапных операций, по данным различных авторов, не только не увеличивает риск вмешательства, но уменьшает летальность при радикальной коррекции.
При некоторых анатомически сложных ВПС, когда отсутствуют или недоразвиты различные отделы сердца (атрезия трикуспидального и митрального клапанов, единственный желудочек сердца, двухкамерное сердце и т.д.) выполнение радикальной операции не представляется возможным и единственной операцией может быть гемодинамическая коррекция внутрисердечной гемодинамики, которая позволяет разделить артериальные и венозные потоки крови, не устраняя полностью анатомические пороки. К ним относятся различные модификации гемодинамической коррекции по методу Фонтена, Мастарда и Сенинга.
Список литературы Вы можете найти на сайте http://www.rmj.ru
1. Бураковский В.И., Бухарин В.А. Константинов С.А. и др. Врожденные пороки сердца. В кн. Частная хирургия болезней сердца и сосудов / Под ред. В.И. Бураковского и С.А.Колесникова. М.: Медицина, 1967; 315—23.
2. Бураковский В.И., Бухарин В.А., Плотникова Л.Р. Легочная гипертензия при врожденных пороках сердца. М. Медицина, 1975; 247.
3. Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. Киев: Здоровье, 1983; 33—96.
4. Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. Руководство для врачей. В 2 томах. — М. Медицина, 1987; 918.
5. Бураковский В.А., Бухарин В.А., Подзолков В.П. и др. Врожденные пороки сердца. В кн. Сердечно-сосудистая хирургия / Под ред. В.И. Бураковского, Л.А. Бокерия. М. Медицина, 1989; 345—82.
6. Иваницкий А.В., Роль рентгенологического исследования в диагностике пороков сердца у детей. Педиатрия. 1985; 8 (7) 55—7.
7. Н.А.Белоконь, В.П. Подзолков. Врожденные пороки сердца. М. Медицина, 1991; 352.
Неоперабельный порок сердца что это такое
Единственное средство лечения ребенка — оперативный. В зависимости от характера поражения сердца и соматического состояния для проведения хирургического лечения пациентов разделяют на следующие группы:
1. Больные с критической пороком сердца (тетрада Фалло с атрезией легочной артерии, атрезия легочной артерии а интактной межжелудочковой перегородки и др.)., Которых после оказания неотложной помощи необходимо направить на хирургическое лечение.
Оптимальный возраст для хирургического лечения некоторых врожденных пороков сердца, в том числе критических
| Врожденные пороки сердца | Возраст ребенка |
| Открытый артериальный проток с синдромом дыхательных расстройств | 1 мес жизни |
| Резкая коарктация аорты, полная облитерация дуги аорты | Безотлагательное лечение |
| Дефект межжелудочковой перегородки 3 легочной гипертензией | 3-6 мес жизни |
| Тотальный аномальный дренаж легочных вен | 1 мес жизни |
| Врожденные пороки сердца | Возраст ребенка |
| Критический стеноз аорты. Критический стеноз легочной артерии | Безотлагательное лечение |
| Общий артериальный ствол | 1-2 мес жизни |
| Тетрада Фалло | 3 Июнь-месячного возраста |
| Дефект аорто-легочной перегородки | До 6-месячного возраста |
| Открытая атриовентрикулярная пролив с легочной гипертензией | 3-6 мес жизни |
| Полная транспозиция магистральных артерий с интактной межжелудочковой перегородки | Первые 3 мес жизни |
2. Больные с неоперабельными врожденными пороками сердца или неоперабельные за соматическим состоянием (серьезные поражения центральной нервной системы и др.)..
3. Больные, которым ранняя операция не рекомендована в связи с незначительными нарушениями гемодинамики. их наблюдают в оптимальное для оперативного вмешательства возраста. Наиболее благоприятный срок для оперативного лечения врожденных пороков сердца — П фаза течения-компенсация (3-12 лет жизни).
Оптимальный возраст для хирургического лечения врожденных пороков сердца
| Врожденный порок сердца | Возраст |
| Коарктация аорты | 4-6 лет |
| Стеноз аорты | 6-10 лет |
| Дефект межпредсердной перегородки | 5-6 лет |
| Дефект межжелудочковой перегородки | 3-5 лет |
| Открытый артериальный проток | После 6-месячного возраста |
| Стеноз легочной артерии | В грудном возрасте |
| Тетрада Фалло, транспозиция крупных сосудов | В грудном возрасте — паллиативная операция, заключительная — в 5-7-летнем возрасте |
Исключением являются больные с врожденными пороками сердца, которым проводят консервативное лечение индометацином. Препарат является ингибитором синтеза простагландинов Е2 и F2, способствует спазмирование протоки с последующей ее облитерацией. Не проводятся операции также недоношенным детям с массой тела менее 1500 г и расстройствами дыхания в первые 2-3 суток.
В терминальной фазе оперативное лечение не приносит облегчения, поскольку имеет место дистрофия и дегенеративные изменения в миокарде, легких, печени и почках.
Оперативное лечение противопоказано при выраженной гипертензии малого круга кровообращения (если давление в легочной артерии более 70% от артериального, в норме систолическое давление в легочной артерии — до 30 мм рт. Ст.).
Консервативное лечение детей с врожденными пороками сердца направлено прежде всего на оказание неотложной помощи при катастрофических состояниях (острая и подострая сердечная недостаточность, гипоксемични кризиса) и лечения различных осложнений и сопутствующей патологии.
При сердечной недостаточности для устранения альвеолярной гиповентиляции проводят кислородную терапию (при левожелудочковой недостаточности вводят кислород, увлажненный 20% раствором этилового спирта по 15 — 20 мин 3 раза в день). Для уменьшения венозного притока к сердцу вводят мочегонные средства быстрого действия — лазикс (фуросемид) внутривенно из расчета 2-4 мг на 1 кг массы тела, а также назначают периферические вазодилататоры (натрия нитропруссид, молсидомин-корватон) и препараты, снижающие давление в сосудах малого круга кровообращения (например, 2,4% раствор эуфиллина). Улучшение сокращения миокарда достигается путем струйного введения сердечных гликозидов. Рекомендуется применение строфантина или коргликона, которые дают быстрый и непродолжительный эффект. Возможно введение дигоксина в дозе насыщения в течение 2-3 суток, равномерно 3 раза в сутки под строгим контролем за общим состоянием, пульсом перед каждой инъекцией, с последующим переходом на поддерживающую дозу, которая вводится перорально в 2 приема в сутки, длительно ( до 9-12 мес).
Одной из наиболее перспективных схем фармакотерапии сердечной недостаточности является применение ингибиторов АПФ. В педиатрической практике эту группу препаратов чаще всего применяют при хронической сердечной недостаточности.
У детей раннего возраста с врожденными пороками сердца с обеднением малого круга кровообращения часто возникает гипоксемичный приступ. Если приступ возникает без потери сознания, ребенку необходимо предоставить коленно-грудного положения, дать кислород, назначить седативное терапию (промедол, седуксен, димедрол, пипольфен), кордиамин. В случае тяжелого гипоксемичного нападения, сопровождающееся знепрнтомненням, судорогами, апноэ и т.д., кроме вышеназванного лечения внутривенно капельно вводят: декстран (50-100 мл), 5% раствор гидрокарбоната натрия (20-100 мл), плазму из расчета 10 мл на 1 кг массы тела, 2,4% раствор эуфиллина (1-4 мл), витамин С (500 мг), 5% раствор витамина В1 (0,5 мл), витамина В12 (10 мкг), 20% раствор глюкозы (20 — 40 мл ), инсулин (3-4 ЕД). Параллельно дают бета-адреноблокаторы (обзидан, анаприлин) в дозе 0,5 — 1 мг на 1 кг массы тела в сутки. При неэффективности терапии проводят интубацию и переводят на искусственное дыхание. Иногда проводят экстренную операцию — аорто-легочное анастомозування.
Врождённые пороки сердца – это анатомические дефекты сердца, его клапанов или сосудов, которые возникают ещё во время внутриутробного развития ребёнка.
Причины возникновения заболевания
В тот момент, когда родители слышат от врача «У Вашего ребёнка врождённый порок сердца», им в первую очередь кажется, что их мир рушится у них на глаз. Страх, безнадёжность, беспомощность – вот их первая реакция. Но вскоре они узнают, что диагноз «врождённый сердечный порок » вовсе не является смертельным приговором. Благодаря различным медицинско-техническим новшествам и новым эффективным возможностям медикаментозного и хирургического лечения врождённый порок сердца успешно лечат, и около 90% всех пациентов достигают зрелого возраста.
Врождённые пороки могут встречаться отдельно или в комбинации друг с другом. Врождённые пороки могут проявляться непосредственно после рождения ребёнка или развиваться скрыто. Они являются частой причиной смертности новорождённых и младенцев до первого года жизни. С возрастом риск смертности у детей с таким заболеванием уменьшается, но тем не менее составляет значительную долю. Поэтому врождённый порок сердца и его лечение является важной и серьёзной проблемой детской кардиологии.
Врождённые пороки имеют в некоторых случаях генетическую природу возникновения. Чаще всего врождённые пороки возникают однако по причине внешнего воздействия на внутриутробное развитие организма ребёнка. Первые три месяца беременности считаются особо критическими в этом смысле. Так например врождённый порок сердца может возникнуть вследствие вирусного или других заболеваний матери во время беременности, употребления алкоголя, наркотиков, приёма определённых лекарственных препаратов или даже чрезмерного стресса. Особое значение имеет также образ жизни отца до зачатия ребёнка.
В то время как некоторые врождённые пороки могут быть безобидными и со временем спонтанно дегенерироваться, встречают также очень тяжёлые и опасные для жизни формы заболевания.
Виды заболеваний

Врождённые пороки сердца встречаются с различными степенями тяжести и широким спектром возможных симптомов. Иногда врождённый порок с относительно легкой степенью тяжести можно своевременно установить и начать лечение благодаря в короткое время проявившимся симптомам.
Врождённые пороки сердца были квалифицированы на международном уровне в многочисленные группы. В обшей сложности существует более 2000 различных видов врождённых сердечных аномалий. Диагностика и методы их лечения соответственно разнообразны.Наиболее часто встречаются следующие врождённые пороки: дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП), коарктация аорты, стеноз аорты, стеноз легочной артерии и транспозиция крупных магистральных сосудов (ТКС).
Перспективы лечения
На сегодняшний день врождённые пороки сердца можно лечить интервенционным или хирургическим методом. Детская кардиохирургия достигла за последние годы больших успехов, благодаря которым стало возможным оперативное лечение ранее неоперабельных пороков. Хирурги проводят сегодня реконструктивные операции. До недавнего времени оперативное лечение требовало открытой операции на сердце. Сегодня же врождённые проки можно устранить эндоваскулярными операциями, в ходе которых необходимые инструменты вводят к сердцу через сосуды. Успех лечения врождённых сердечных пороков зависит в первую очередь от своевременной диагностики и оказании квалифицированной медицинской помощи, особенно если врождённый порок протекает скрыто.
Амбулатория детской кардиологии в нашей детской клинике проводит комплексное диагностическое обслуживание. Наши врачи-кардиологи способны простыми методами и не обременяя излишне состояние ребёнка установить многочисленные врождённые пороки. Коллектив опытных и внимательных врачей и медсотрудников приложит все усилия для того, чтобы Ваш ребёнок чувствовал себя во время пребывания в клинике как дома. Мы будем рады помочь Вам и Вашему ребёнку побороть врождённый порок сердца.
Неоперабельный ВПС, беременность и роды.
Собираем истории о тех, кто несмотря на врождённый или приобретённый порок сердца, стал взрослым. Истории о тех, кто уже стал взрослым
- Регистрация
- Войти
- Участники
- Поиск
- Обновившиеся
- Обратная связь
 |
Сколько лет живут взрослые с пороком Тетрада Фалло А сейчас где и как часто наблюдают вас? Клапан сохранен? Как в США попали в те г . Елена и Ксюшечка |
 |
Виктор Шамонин_Версенев СТИХИ И СКАЗКИ Про медведя-простачка Сказка в стихах Старым стал медведь совсем, Он тепе . qwe208 |
 |
Сравнение клиник по пластике клапана Добрый день. Моя история началась с 2016 г. когда мне было 32 года и случайно вр . Irina Katrina |
 |
Пульс Добрый вечер! На эхо-кг в ноябре 2018года все было в норме, только врач сказал . Мамакнопки |
 |
Мужья Абсолютно согласна . MarMari |
 |
НПФ и будущая пенсия Не нужно надеется на законы. . Базар555 |
 |
Умоляю помогите пожалуйста! Порок Серда не приговор! Полюбите свою болезнь и она позволит вам прожить долгую . lelya_orlova |
Форум родителей детей и взрослых с врождённым пороком сердца » Истории о тех, кто уже стал взрослым » Неоперабельный ВПС, беременность и роды.
Форум «Доброе Сердце» — это место, где общаются, помогают друг другу, радуются и переживают вместе люди с добрыми сердцами.
Автор: Лана
Огромное спасибо всем, кто помог нашему форуму!
Неоперабельный ВПС, беременность и роды.
Причины возникновения
Этиология врожденных форм представлена различными хромосомными нарушениями. Также определенную роль играют экологические факторы. В том случае, если мама во время беременности болела краснухой, у ребенка выявляется следующая тройка синдромов:
Этиология врожденных пороков достаточно широка. К ней можно отнести употребление беременной женщиной алкоголя и наркотических средств. Доказано тератогенное влияние на плод амфетаминов. Несмотря на то что по наследству пороки не передаются, наличие в семейном анамнезе сердечно-сосудистых патологий повышает риск возникновения клапанных пороков сердца у детей. Также некоторые специалисты говорят о возможном развитии врожденного порока у следующих поколений при близкородственном браке. Причиной приобретенных пороков развития сердца чаще всего является острая ревматическая лихорадка. Помимо этого, этиология включает следующие заболевания:
Основные проявленияПатофизиология врожденных пороков сердца в большей степени заключается в нарушении нормального кровообращения. Чаще всего этому способствует:
Очень часто оба этих патогенетических механизма могут комбинироваться. В связи с этим можно выделить следующие признаки пороков сердца:
Стоит заметить, что компенсированные пороки чаще всего протекают бессимптомно и выявляются при проведении профилактического осмотра. Основные симптомы пороков сердца проявляются тогда, когда организм уже не может своими силами справляться с нарушениями гемодинамики. Диагностика
Чтобы понимать, как определить порок сердца, важно знать основные инструментальные методы, применяемые в диагностике подобных заболеваний. Применяются следующие исследования:
Современная педиатрия особое место в определении врожденных аномалий отводит пренатальному выявлению. Такая диагностика пороков сердца проводится в несколько этапов. Первоначальный этап лежит на плечах обычного гинеколога, а после подозрения на наличие изменений беременная женщина направляется к специалисту по фетальной эхокардиографии. Лечебные мероприятияОсновной метод терапии большинства сердечных пороков — хирургический. Тем не менее с целью снижения интенсивности прогрессирования заболевания, а также нормализации кровообращения, применяются следующие группы препаратов:
Методы хирургического лечения порока сердца у взрослого человека и у детей достаточно разнообразны. Лечение применяется как при приобретенных, так и при врожденных пороках. Показания к проведению оперативного вмешательства напрямую зависят от степени нарушения гемодинамики. При врожденных формах и при наличии препятствия току крови проводятся следующие вмешательства для его устранения:
В том случае, если порок сопровождается переполнением малого круга, необходимо ликвидировать патологический сброс крови. Это достигается за счет проведения следующих мероприятий:
Помимо вышесказанного, при врожденных формах применяются следующие операции пороков сердца:
Реконструкция применяется при сложных патологиях, которые сопровождаются не только нарушением клапанного аппарата, но и неправильным расположением крупных сосудов. Длительное время считалось, что оперативное лечение врожденных пороков сердца должно проводиться в пятилетнем возрасте или даже позже. Однако уровень медицины в настоящее время позволяет производить хирургическую коррекцию в первые годы жизни. При приобретенных патологиях клапанного аппарата основным оперативным вмешательством является протезирование. Больному на место поврежденного клапана устанавливается искусственный. При приобретенных стенозах с целью устранения имеющегося препятствия проводится пластика клапана. ОсложненияЧтобы понимать, чем опасен порок сердца, нужно знать, какие последствия могут проявиться. Основные осложнения связаны с формированием недостаточности кровообращения. Выделяют следующие её виды:
Одним из основных признаков тяжелой левожелудочковой недостаточности является одышка, сопровождающаяся выделением пенистой мокроты кровавого оттенка. Ее цвет объясняется наличием особых клеток. Клетки сердечных пороков представлены альвеолярными макрофагами, содержащими гемосидерин. Наличие данных клеток наблюдается при инфаркте легкого или же застое в малом круге кровообращения. И именно из-за них мокрота при данных патологиях обладает “ржавым” цветом. Сестринский процессСестринский процесс при пороках сердца играет большую роль в повышении качества жизни пациента. Данный процесс преследует следующие цели:
При сердечных пороках данный процесс проводится в несколько этапов. На первом этапе медицинская сестра должна определить основные потребности больного. Второй этап заключается в постановке сестринского диагноза и выявлении основных проблем больного, среди которых нужно выделить следующие:
Профилактические мероприятияПрофилактика пороков сердца — крайне важный комплекс мероприятий, позволяющий снизить риск возникновения нарушений в работе клапанного аппарата сердца. Стоит отметить, что с целью профилактики врожденных пороков будущей маме нужно соблюдать следующие рекомендации:
Также рекомендуется следующее:
После лечения взрослых и подростков от ревматизма рекомендуется проведение бициллинопрофилактики. Также для того, чтобы снизить проявления ревматического процесса, а также предупредить возможные последствия рекомендуется проводить массаж при пороках сердца. Выделяют следующие показания для массажа:
В период активных воспалительных изменений в сердечных оболочках применение массажа не допускается. Лечебная тактика при врожденных пороках сердцаЕдинственное средство лечения ребенка — оперативный. В зависимости от характера поражения сердца и соматического состояния для проведения хирургического лечения пациентов разделяют на следующие группы: 1. Больные с критической пороком сердца (тетрада Фалло с атрезией легочной артерии, атрезия легочной артерии а интактной межжелудочковой перегородки и др.)., Которых после оказания неотложной помощи необходимо направить на хирургическое лечение. Оптимальный возраст для хирургического лечения некоторых врожденных пороков сердца, в том числе критических
2. Больные с неоперабельными врожденными пороками сердца или неоперабельные за соматическим состоянием (серьезные поражения центральной нервной системы и др.).. 3. Больные, которым ранняя операция не рекомендована в связи с незначительными нарушениями гемодинамики. их наблюдают в оптимальное для оперативного вмешательства возраста. Наиболее благоприятный срок для оперативного лечения врожденных пороков сердца — П фаза течения-компенсация (3-12 лет жизни). Оптимальный возраст для хирургического лечения врожденных пороков сердца
Исключением являются больные с врожденными пороками сердца, которым проводят консервативное лечение индометацином. Препарат является ингибитором синтеза простагландинов Е2 и F2, способствует спазмирование протоки с последующей ее облитерацией. Не проводятся операции также недоношенным детям с массой тела менее 1500 г и расстройствами дыхания в первые 2-3 суток. В терминальной фазе оперативное лечение не приносит облегчения, поскольку имеет место дистрофия и дегенеративные изменения в миокарде, легких, печени и почках. Оперативное лечение противопоказано при выраженной гипертензии малого круга кровообращения (если давление в легочной артерии более 70% от артериального, в норме систолическое давление в легочной артерии — до 30 мм рт. Ст.). Консервативное лечение детей с врожденными пороками сердца направлено прежде всего на оказание неотложной помощи при катастрофических состояниях (острая и подострая сердечная недостаточность, гипоксемични кризиса) и лечения различных осложнений и сопутствующей патологии. При сердечной недостаточности для устранения альвеолярной гиповентиляции проводят кислородную терапию (при левожелудочковой недостаточности вводят кислород, увлажненный 20% раствором этилового спирта по 15 — 20 мин 3 раза в день). Для уменьшения венозного притока к сердцу вводят мочегонные средства быстрого действия — лазикс (фуросемид) внутривенно из расчета 2-4 мг на 1 кг массы тела, а также назначают периферические вазодилататоры (натрия нитропруссид, молсидомин-корватон) и препараты, снижающие давление в сосудах малого круга кровообращения (например, 2,4% раствор эуфиллина). Улучшение сокращения миокарда достигается путем струйного введения сердечных гликозидов. Рекомендуется применение строфантина или коргликона, которые дают быстрый и непродолжительный эффект. Возможно введение дигоксина в дозе насыщения в течение 2-3 суток, равномерно 3 раза в сутки под строгим контролем за общим состоянием, пульсом перед каждой инъекцией, с последующим переходом на поддерживающую дозу, которая вводится перорально в 2 приема в сутки, длительно ( до 9-12 мес). Одной из наиболее перспективных схем фармакотерапии сердечной недостаточности является применение ингибиторов АПФ. В педиатрической практике эту группу препаратов чаще всего применяют при хронической сердечной недостаточности. У детей раннего возраста с врожденными пороками сердца с обеднением малого круга кровообращения часто возникает гипоксемичный приступ. Если приступ возникает без потери сознания, ребенку необходимо предоставить коленно-грудного положения, дать кислород, назначить седативное терапию (промедол, седуксен, димедрол, пипольфен), кордиамин. В случае тяжелого гипоксемичного нападения, сопровождающееся знепрнтомненням, судорогами, апноэ и т.д., кроме вышеназванного лечения внутривенно капельно вводят: декстран (50-100 мл), 5% раствор гидрокарбоната натрия (20-100 мл), плазму из расчета 10 мл на 1 кг массы тела, 2,4% раствор эуфиллина (1-4 мл), витамин С (500 мг), 5% раствор витамина В1 (0,5 мл), витамина В12 (10 мкг), 20% раствор глюкозы (20 — 40 мл ), инсулин (3-4 ЕД). Параллельно дают бета-адреноблокаторы (обзидан, анаприлин) в дозе 0,5 — 1 мг на 1 кг массы тела в сутки. При неэффективности терапии проводят интубацию и переводят на искусственное дыхание. Иногда проводят экстренную операцию — аорто-легочное анастомозування.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||






 Пороки сердца — группа заболеваний, характеризующихся нарушением анатомического строения сердечных клапанов или перегородок. Проявляются обычно нарушением гемодинамики.
Пороки сердца — группа заболеваний, характеризующихся нарушением анатомического строения сердечных клапанов или перегородок. Проявляются обычно нарушением гемодинамики.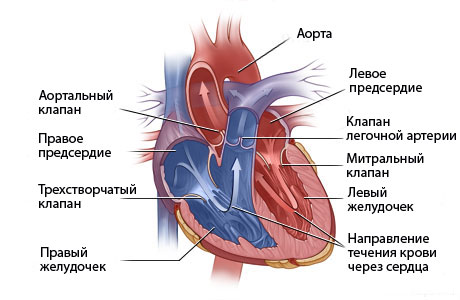

 На основании одних лишь симптомов, выявленных при проведении осмотра, постановка диагноза «порок сердца» невозможна. Для этого врачу необходимо проведение ряда физикальных и инструментальных методов. Непосредственно при первом посещении специалиста играет большую роль пропедевтика внутренних болезней, в частности, аускультация и пальпаторное обследование.
На основании одних лишь симптомов, выявленных при проведении осмотра, постановка диагноза «порок сердца» невозможна. Для этого врачу необходимо проведение ряда физикальных и инструментальных методов. Непосредственно при первом посещении специалиста играет большую роль пропедевтика внутренних болезней, в частности, аускультация и пальпаторное обследование. О том, как лечить порок сердца в каждом конкретном случае, сможет ответить только врач, предварительно проведя диагностику. Крайне важно соблюдать все врачебные рекомендации и употреблять препараты строго в указанной дозировке.
О том, как лечить порок сердца в каждом конкретном случае, сможет ответить только врач, предварительно проведя диагностику. Крайне важно соблюдать все врачебные рекомендации и употреблять препараты строго в указанной дозировке. Третий этап заключается в определении целей, которые должна поставить перед собой медицинская сестра, чтобы облегчить общее состояние больного. В четвертый этап входит реализация всех сестринских вмешательств, которые необходимо провести согласно протоколу лечения и диагностики порока. Последний этап — оценка того, насколько эффективно был проведен сестринский уход, проводится не только медицинской сестрой, но и ее непосредственным начальством, а также самим больным.
Третий этап заключается в определении целей, которые должна поставить перед собой медицинская сестра, чтобы облегчить общее состояние больного. В четвертый этап входит реализация всех сестринских вмешательств, которые необходимо провести согласно протоколу лечения и диагностики порока. Последний этап — оценка того, насколько эффективно был проведен сестринский уход, проводится не только медицинской сестрой, но и ее непосредственным начальством, а также самим больным.