Сердечно-легочная реанимация у взрослых
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при п
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при последующей реабилитации. Самым уязвимым и при этом очень важным звеном является первичный реанимационный комплекс, проводимый на месте происшествия, поскольку через 3–5 мин после остановки кровообращения и дыхания при обычной температуре тела развиваются необратимые изменения головного мозга пострадавшего.
Возможны как первичная остановка дыхания, так и первичная остановка кровообращения. Выявление первичной остановки дыхания (инородные тела дыхательных путей, электротравма, утопление, поражение центральной нервной системы (ЦНС) и др.) маловероятно на догоспитальном этапе, так как к моменту прибытия бригады скорой помощи успевает развиться фибрилляция желудочков или асистолия.
Причиной первичной остановки кровообращения могут быть острый инфаркт миокарда, аритмия различного характера, электролитный дисбаланс, тромбоэмболия легочной артерии, разрыв и расслоение аневризмы аорты и т. д.
Различают три варианта прекращения сердечной деятельности: асистолия, фибрилляция и электромеханическая диссоциация. Асистолия может быть первичной или вторично развиться после фибрилляции желудочков. В первом случае шансов на успех реанимации больше, во втором, при истощении резервов миокарда, — меньше. Иногда изолинию на электрокардиограмме (ЭКГ) воспринимают как асистолию, но она может наблюдаться и при неисправности электрокардиографа, случайном отсоединении электродов, низкоамплитудной ЭКГ и т. п. Электромеханическая диссоциация характеризуется наличием электропродукции сердца, но отсутствием сокращения миокарда.
При фибрилляции возникают разрозненные, беспорядочные, неэффективные сокращения миокарда. И здесь имеют значение применение прекордиального удара и рано выполненная дефибрилляция.
Признаками остановки кровообращения являются: потеря сознания; отсутствие пульса на сонных артериях; остановка дыхания; судороги; расширение зрачков и отсутствие их реакции на свет; изменение цвета кожных покровов.
Для подтверждения остановки сердца достаточно наличие первых трех признаков.
Сердечно-легочная реанимация (СЛР) не показана, и ее можно не начинать в случаях: если установлено, что с момента остановки сердца (при нормальной температуре окружающей среды) прошло свыше 25 мин; больные заранее зафиксировали свой отказ от СЛР.
В иных случаях при оказании помощи на догоспитальном этапе СЛР начинается немедленно.
Поводом для прекращения СЛР является отсутствие признаков восстановления кровообращения и дыхания при использовании всех доступных методов СЛР в течение 30 мин.
СЛР на догоспитальном этапе
Она включает в себя элементарное поддержание жизни (по П. Сафару) или первичный реанимационный комплекс (по А. Зильберу):
- восстановление проходимости дыхательных путей;
- искусственную вентиляцию легких (ИВЛ) и оксигенацию;
- непрямой массаж сердца.
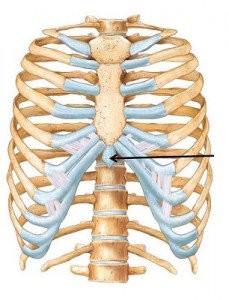
Кроме того, производятся мероприятия (рис. 1) специализированного реанимационного комплекса (по А. Зильберу), включающего:
- электрокардиографию и дефибрилляцию;
- обеспечение венозного доступа и введение медикаментозных средств;
- интубацию трахеи.
Восстановление проходимости дыхательных путей. При возникновении неотложных состояний проходимость дыхательных путей часто нарушается в результате западения языка, аспирации рвотными массами, кровью. Необходимо очистить ротоглотку и выполнить «тройной прием Сафара» — разогнуть голову в шейном отделе позвоночника; выдвинуть нижнюю челюсть вперед и вверх; открыть рот. Если невозможно исключить перелом шейного отдела позвоночника и разгибать голову нельзя, ограничиваются выдвижением челюсти и открытием рта.
Если зубной протез цел, его оставляют в полости рта, так как это сохраняет контур рта и облегчает проведение ИВЛ.
При обструкции дыхательных путей инородным телом пострадавшего укладывают на бок и производят 3–5 резких ударов нижней частью ладони в межлопаточной области, затем пальцем пытаются удалить инородное тело из ротоглотки. Если этот метод неэффективен, то выполняют прием Геймлиха: ладонь реаниматолога укладывается на живот между пупком и мечевидным отростком, вторую руку укладывают на первую и производят толчок снизу вверх по средней линии. После чего также пальцем пытаются удалить инородное тело из ротоглотки.
В связи с опасностью инфицирования реаниматолога при контакте со слизистой рта и носа, а также для повышения эффективности ИВЛ используется ряд приспособлений: устройство «ключ жизни»; пероральный воздуховод; трансназальный воздуховод; фаринго-трахеальный воздуховод; двухпросветный пищеводно-трахеальный воздуховод (комбитьюб); ларингеальная маска.
Большим шагом вперед явилось создание ларингеальной маски. Ларингеальный масочный воздуховод представляет собой интубационную трубку, которая не проходит через голосовую щель в трахею, а имеет на дистальном конце миниатюрную маску, которая надевается на гортань. Манжета, прилегающая к краю маски, раздувается вокруг гортани, обеспечивая герметичность по ларингеальному периметру. Ларенгеальная маска обладает множеством преимуществ, в том числе позволяет обойтись без разгибания головы в шейном отделе, если к этому имеются противопоказания.
Каждый врач скорой помощи должен уметь выполнять интубацию трахеи. Этот метод позволяет обеспечить оптимальную проходимость дыхательных путей, снизить вероятность регургитации при проведении комплекса реанимационных мероприятий, обеспечить более высокое внутрилегочное давление. Кроме того, через интубационную трубку можно вводить некоторые медикаменты.
ИВЛ. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента без или с применением специальных устройств. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, поэтому эффективнее ИВЛ атмосферным воздухом, либо кислородо-воздушной смесью. Каждое вдувание должно занимать 1–2 с, а частота дыхательных движений составлять 12–16 в минуту. Адекватность ИВЛ оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Бригадой скорой помощи обычно используются либо воздуховод, либо лицевая маска и мешок Амбу, либо интубация трахеи и мешок Амбу.
Непрямой массаж сердца. После остановки кровообращения в течение 20–30 мин в сердце сохраняются функции автоматизма и проводимости, что позволяет его «запустить». Основной целью массажа сердца является создание искусственного кровотока. За время проведения непрямого массажа сердца происходит сжатие не только сердца, но и легких, которые содержат большое количество крови. Этот механизм принято называть грудным насосом.
У пациентов с фибрилляцией желудочков и желудочковой тахикардией рекомендуется при отсутствии подготовленного к работе дефибриллятора нанести прекордиальный удар (1–2 резких удара кулаком в область границы средней и нижней трети грудины с расстояния не менее 30 см).
При проведении непрямого массажа сердца пациент должен находиться на твердой поверхности. Одна ладонь реаниматолога располагается на нижней трети грудины по средней линии, вторая упирается в тыльную поверхность первой. Время надавливания и отпускания — 1 с, интервал между компрессиями — 0,5–1 с. Грудина у взрослого должна «продавливаться» на 5–6 см. При выполнении каких-либо лечебных мероприятий перерыв в тракциях не должен превышать 5–10 сек. Критериями эффективности непрямого массажа сердца являются появление пульсовых толчков на сонных артериях, артериальное давление на уровне 60–70 мм рт. ст., изменение цвета кожных покровов.
Если помощь оказывает один реаниматолог, то на два вдувания воздуха выполняются 15 тракций, если работают два реаниматолога, то на одно вдувание воздуха осуществляется 5 тракций.
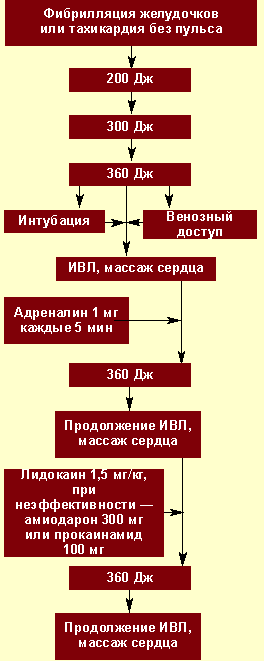 |
| Рисунок 2. Алгоритм неотложной помощи при фибрилляции желудочков |
Электрическая дефибрилляция сердца (ЭДС). Это важнейший компонент СРЛ. ЭДС эффективна только при сохранности энергетического ресурса миокарда, т. е. при регистрации на ЭКГ крупноволновых осцилляций от 0,5 до 1 мВ и более (рис. 2). Если же отмечаются низкие, аритмичные, полиморфные осцилляции, а также асистолия, то начинают с ИВЛ, непрямого массажа и медикаментозной терапии (рис. 3), добиваются перехода асистолии или мелковолновой фибрилляции желудочков в крупноволновую фибрилляцию и применяют ЭДС.
Первый разряд для ЭДС — 200 Дж, при неэффективности второй — 300 Дж, при неэффективности третий — 360 Дж. Перерыв между разрядами минимальный — для контроля ритма. Непрямой массаж сердца и ИВЛ прерываются только на момент разряда. Если первая серия из трех разрядов оказывается неэффективной, то на фоне продолжающейся ИВЛ, непрямого массажа сердца, медикаментозной терапии проводится вторая серия разрядов в той же последовательности.
В настоящее время на догоспитальном этапе применяются автоматические наружные дефибрилляторы, в этом случае ЭКГ регистрируется с электродов дефибриллятора, приложенных к грудной клетке. Дефибриллятор регистрирует ритм сердца и производит его автоматический анализ; при выявлении желудочковой тахикардии или фибрилляции желудочков конденсаторы автоматически заряжаются, и прибор дает разряд. Эффективность автоматических дефибрилляторов очень высока. Кроме автоматических, используются полуавтоматические наружные дефибрилляторы.
Медикаментозная терапия при сердечно-легочной реанимации. Медикаменты при СЛР могут вводиться: в периферическую вену; в центральную вену; в трахею.
По понятным причинам внутримышечный путь введения не показан. При наличии возможности катетеризируется периферическая вена. Если реаниматолог опытный и хорошо владеет методикой пункции центральной вены, можно использовать этот способ. Проблема в том, что в этом случае приходится прерывать реанимационные мероприятия, а перерыв больше, чем на 5–10 с нежелателен. Внутритрахеальный путь удобен, если выполнена интубация трахеи, в крайнем случае можно ввести препараты в трахею через перстнещитовидную мембрану. Эндотрахеально допустимо вводить адреналин, атропин, лидокаин. Препараты лучше развести в 10–20 мл 0,9% раствора натрия хлорида.
Адреналин остается средством выбора при остановке кровообращения. При асистолии и электромеханической диссоциации он «тонизирует» миокард и помогает «запустить» сердце, мелковолновую фибрилляцию переводит в крупноволновую, что облегчает ЭДС. Дозы: по 1–2 мг внутривенно струйно с интервалом 5 мин, суммарно обычно — до 10-15 мг.
М-холинолитик атропин снижает тормозящее влияние ацетилхолина на синусовый узел и атриовентрикулярную проводимость и, возможно, способствует высвобождению катехоламинов из мозгового слоя надпочечников. Он показан при брадисистолии и асистолии. Дозы — 1 мг, можно повторить через 5 мин, но не более 3 мг за время реанимации.
Все антиаритмические препараты оказывают депрессивное действие на миокард и небезвредны для организма пациента. При развившейся фибрилляции желудочков их следует вводить лишь в случае нескольких неудачных попыток ЭДС, поскольку они, подавляя желудочковую эктопию затрудняют восстановление самостоятельного ритма. Лидокаин считается одним из наиболее эффективных средств при рефрактерной фибрилляции желудочков, устойчивой желудочковой тахикардии и тахикардиях неясной этиологии с широким комплексом QRS. Доза для насыщающего внутривенного введения — 1,5 мг/кг струйно (обычно — 75–100 мг). Одновременно начинается введение поддерживающей дозы 2–4 мг в мин. Для этого 1 г лидокаина разводится в 250 мл 5% раствора глюкозы.
Показанием к введению гидрокарбоната натрия можно считать затянувшуюся более чем на 15 мин реанимацию, если остановке сердца предшествовали выраженный метаболический ацидоз или гиперкалиемия. Доза — 1 ммоль/кг, внутривенно однократно, при повторном введении она уменьшается вдвое. Некоторые авторы считают, что при адекватных реанимационных мероприятиях гидрокарбонат натрия следует вводить только под контролем кислотно-основного состояния, поскольку организм значительно хуже адаптируется к алкалозу, чем к ацидозу.
В качестве инфузионных растворов целесообразно использовать 0, 9% раствор хлорида натрия, но наиболее эффективен раствор лактата Рингера по Хартману, а из коллоидов — растворы со средней молекулярной массой, содержащие гидроксиэтилкрахмал — волювен или венофундин.
Во всех случаях показана экстренная госпитализация по витальным показаниям в отделение реанимации и интенсивной терапии.
И. Г. Труханова, доктор медицинских наук, доцент
Е. В. Двойникова, кандидат медицинских наук, доцент
Самарский государственный медицинский университет, Самара
Медикаментозная терапия при остановке сердца
Медикаментозная стимуляция должна начинаться как можно быстрее и повторяться через каждые 5 мин. Распространенное мнение, что оптимальным методом введения лекарственных препаратов при проведении сердечной реанимации является внутрисер-дечный путь, за последние годы претерпело изменения. Исследования последних лет убедительно доказали, что внутривенное или внутрилегочное введение лекарственных препаратов через интуба-ционную трубку обладает таким же практическим эффектом. Более того, внутрисердечные пункции всегда несут в себе риск повреждения проводящей системы сердца и коронарных сосудов или ин-трамурального введения хлористого кальция (при его использовании). Если интубация трахеи выполнена раньше, чем установлен венозный катетер, то адреналин, лидокаин и атропин можно вводить эндотрахеально, при этом дозу для взрослых увеличивают в 2-2,5 раза (по сравнению с начальной дозой для в/в введения), а для детей — в 10 раз. Эндотрахеальное введение лекарственных средств выполняется по следующей методике:
• развести препарат в 10 мл физиологического раствора;
• провести катетер за конец эндотрахеальной трубки;
• быстро ввести раствор в катетер (на это время прекратить непрямой массаж сердца), после чего несколько раз быстро нагнетают воздух в эндотрахеальную трубку; превращение раствора в аэрозоль ускоряет всасывание. После этого продолжают проведение реанимационных мероприятий. При проведении медикаментозной стимуляции сердца, как правило, используют небольшую группу препаратов: адреномиметики, антиаритмические, буферные растворы, холинолитики и некоторые другие.

1. Адреномиметики. Из этой группы наиболее предпочтителен адреналин. Он улучшает коронарный и мозговой кровоток благодаря спазму периферии, повышает возбудимость и сократимость миокарда, однако данный положительный эффект воздействия на сердце может перекрыться отрицательным эффектом адреналина — при его передозировке резко возрастает потребность сердца в кислороде, что само по себе может спровоцировать фибрилляцию. Стандартная доза — 1 мл 0,1% р-ра, разведенного в 10 мл физраствора. Кратность введения — каждые 3—5 мин., до получения клинического эффекта.
2. Антиаритмические препараты. Препаратом выбора является ли-докаин. Он наиболее эффективен для предупреждения или купирования частой желудочковой экстрасистолии — грозного предвестника возникновения фибрилляции желудочков. Рекомендуемая первоначальная доза — 80—120 мг.
3. Гидрокарбонат натрия. Правильно проведенная ИВЛ оказывает более действенное воздействие на КЩС, чем использование буферных растворов, поэтому особо торопиться с введением соды не следует и ее применение нужно начинать после проведения реанимационных мероприятий: ИВЛ, дефибрилляции, непрямого массажа сердца и более чем однократного введения адреналина. Начальная доза бикарбоната натрия — 1 ммоль/кг (2 мл 4% р-ра соды на 1 кг), в последующем через каждые 10 мин. вводят половину расчетной дозы под контролем газов крови.
4. Сульфат магния. Гипомагниемия вызывает рефрактерную фибрилляцию желудочков и препятствует восполнению запасов внутриклеточного калия. При проведении реанимационных мероприятий 1 —2г сульфата магния, разведенного в 100 мл 5% глюкозы вводят в/в за 1—2 мин.
5. Для подавления повышенного тонуса n. vagi используется атропин в виде 1,0 мл 0,1% раствора.
6. Хлористый кальций. Раньше считалось, что данный препарат при проведении кардиореанимации увеличивает амплитуду сердечных сокращений и оказывает стимулирующий эффект на сердце, однако исследования последних лет это не подтвердили.
7. Физиологический раствор или р-р Рингера является оптимальным для инфузионной терапии при остановке кровообращения. Использовать 5% р-р глюкозы можно, но нежелательно из-за неблагоприятного влияния гипергликемии на ЦНС (Gonzalez, 1993).
Медикаментозная терапия при остановке сердца
Киевская медицинская академия последипломного образования им.П.Л.Шупика
Кафедра терапии и ревматологии
Реанимация при остановке сердца
В последние годы организации, такие как Европейский Совет по Реанимации, Американская Кардиологическая Ассоциация и Интернациональный Объединенный Совет по Реанимации выпустили руководства в попытке улучшить качество проводимой сердечно-легочной реанимации (СЛР). Они опирались на мнения интернациональных консенсусов и самые новые из них, связанные с врачебным этапом реанимации.Техника проведения СЛР, основанная на этих рекомендациях, сейчас стала стандартом в подготовке медицинского персонала во многих частях света.
Цель а – рассмотреть технику проведения электрической дефибриляции,методы медикаментозной терапии для снижения порога чувствительности миокарда к электрическому разряду,методы»медикаментозной дефибриляции»при отсутствии дефибрилятора на основе указанных выше рекомендаций.
При большинстве остановок сердца у взрослых имеет место фибриляция желудочков, которая может быть купирована электрической дефибриляцией. Вероятность удачной дефибриляции снижается со временем (примерно на 2-7% на каждую минуту остановки сердца), но меры первичной реанимации замедляют этот процесс, отодвигая развитие асистолии.
При дефибриляции осуществляется воздействие электрическим током на сердце, деполяризируя критическую массу миокарда и вызывая координированный период абсолютной рефрактерности – период, при котором потенциал действия не может быть вызван стимулом любой интенсивности. В случае успеха дефибриляция прерывает хаотическую электрическую активность сердца. При этом клетки пейсмейкера синоатриального узла имеют возможность снова обеспечивать синусовый ритм, так как они являются первыми клетками миокарда, способными деполяризоваться спонтанно.
Все дефибриляторы состоят из блока питания, переключателя уровня энергии, выпрямителя тока, конденсатора и набора электродов. Современные устройства позволяют регистрировать ЭКГ с собственных пластинок или электродов, соединенных с дефибрилятором. Энергия разряда обозначается в Джоулях (Дж) и соответствует энергии, которая воздействовала через электроды на грудную клетку.
Во время разряда только незначительная часть энергии воздействует на сердце вследствие наличия различного уровня сопротивления (импеданса) грудной клетки. Величина требуемой энергии во время дефибриляции (порог дефибриляции) возрастает со временем после остановки сердца. Для реанимации взрослых используются эмпирически подобранные разряды в 200 Дж для первых двух разрядов и 360 Дж для последующих. Разряды постоянного тока должны наноситься при правильной постановке электродов и хорошем контакте с кожей. Полярность электродов не является решающим моментом, т.к. при их верной позиции «грудина» и «верхушка» на экране дефибрилятора проецируется правильная ориентация комплекса. Электрод, накладываемый на грудину, помещается на верхнюю часть правой половины грудной клетки под ключицей. Электрод, накладываемый на верхушку сердца, располагается немного латеральнее точки нормальной проекции верхушечного толчка,но не на молочную железу у женщин. В случае неудачи могут применяться другие положения электродов, например, на верхушке и задней поверхности грудной клетки.
За последние годы появились полу- и автоматические дефибриляторы. При соединении с пациентом такие устройства способны самостоятельно оценивать сердечный ритм и производить необходимые разряды.
Некоторые из них также позволяют оценивать сопротивление грудной клетки для подбора необходимой силы тока разряда. Последние поколения дефибриляторов используют двух- и трехфазные формы волны энергии для достижения успешной дефибриляции при меньшей силе энергии.
В соответствии с типом используемого дефибрилятора важно, чтобы персонал был знаком с инструкцией по эксплуатации и регулярно проходил учебу учебу по его использованию.
Для проведения дефибриляции необходимо убедиться в необходимости ее проведения по подтвержденному на ЭКГ ритму. Первые три разряда должны быть нанесены за первые 90 секунд СЛР. При отсутствии изменений ритма на ЭКГ необходимость контролировать пульс между.
Адреналин (эпинефрин) – основной препарат, используемый во время реанимации при остановке сердца. В каждые 3 минуты должен вводиться 1 мг адреналина. Внутривенное введение адреналина усиливает мозговой и коронарный кровоток за счет повышения сопротивления периферических сосудов и диастолического давления в аорте. Эти эффекты обусловлены воздействием на ?1 и ?2 адренорецепторы. Несмотря на их наличие, не было доказано участия ?1 и ?2–эффектов в восстановлении спонтанного ритма при фибриляции желудочков, асистолии и ЭМД. Напротив, ?1-эффекты способны увеличить потребление кислорода и повысить риск возникновения аритмии. Использовавшиеся одномоментно высокие дозы адреналина (5 мг) не улучшили исходы реанимации при остановке сердца.
Алгоритм СЛР предполагает использование антиаритмических препаратов, соды, атропина и кардиостимуляции. Антиаритмические препараты перечислены ниже.
Атропин в дозе 3 мг вполне достаточен для полной блокады вагуса и должен использоваться однократно при асистолии. Он также показан при симптоматической брадикардии в дозе 0,5-1 мг.
Бикарбонат натрия. При продолжительной остановке сердца начинает играть значительную роль нарастающий ацидоз. Мнения о использовании бикарбоната натрия противоречивы, что связано с гиперосмолярностью, выбросом СО2, усугублением внутриклеточного ацидоза. Были разработаны буферы, поглощающие СО2, такие как Карбикарб и THAM, но ни один из них не показал улучшения исходов. Несмотря на это, бикарбонат натрия продолжает рекомендоваться (50 мл 8,4% раствора) к введению после 15 минут остановки сердца или когда рН ниже 7,1, или при дефиците оснований более –10. Он должен использоваться с самого начала при остановках сердца, развившихся на фоне ацидоза, гиперкалиемии, отравления трициклическими антидепрессантами, но не должен вводиться эндотрахеально или в смеси с кальцием или адреналином.
Путь введения медикаментов
Оптимальным является путь введения через катетеризированную центральную вену. Однако на практике зачастую используется периферический доступ, при котором следом за вводимыми препаратами для их доставки до центрального кровообращения должны вводиться 20-50 мл физиологического раствора.
СЛР не должна прерываться более чем на 10 секунд для постановки в/в доступа. Следует подумать о необходимости внутритрахеального введения препаратов, если отсутствует венозный доступ. Интубация трахеи зачастую выполняется раньше, чем канюлируется вена, таким образом возможно введение двойных доз адреналина, атропина и лидокаина эндотрахеально, разведенных в 10 мл 0,9% NaCl. Для катетеризации следует выбирать самую проксимальную крупную вену, которая может быть легко катетеризирована. Зачастую это наружная яремная вена. Катетеризация центральной вены должна осуществляться только опытным оператором.
Непредсказуемое введение препаратов и риск повреждения левой нисходящей коронарной артерии делает внутрисердечное введение нецелесообразным и небезопасным.
Фибриляция желудочков или желудочковая тахикардия без пульса
При диагностировании ФЖ или ЖТ как можно раньше должна проводиться дефибриляция тремя разрядами 200, 200 и 360 Дж. Если на ЭКГ отсутствует изменение ритма, не следует проверять наличие пульса, так как это откладывает следующую попытку дефибриляции. Пальпация магистральных артерий проводится, если для этого имеются данные ЭКГ или была попытка движения пациентом. При отсутствии эффекта от первых трех разрядов следует продолжить последовательность СЛР втечение одной минуты для обеспечения проходимости ВДП и постановки венозного доступа. После в/в введения адреналина (1 мг) необходимо заподозрить одну из причин ФЖ, поддающихся специфическому лечению – гипотермию или интоксикацию. ЭКГ рекомендуется оценивать после каждых 10 циклов СЛР. Персистирующая ФЖ требует проведения дополнительных трех разрядов мощностью 360 Дж. Дефибриляции отдается приоритет перед манипуляциями на дыхательных путях или постановкой в/в доступа. Рекомендуется использовать антиаритмические препараты только после проведения 9-12 разрядов на фоне введения адреналина каждые 2-3 минуты реанимации.
При отсутствии кардиомонитора, но наличии дефибрилятора реанимацию следует проводить по схеме фибриляции желудочков, как наиболее прогнозируемой.
Асистолия или электрическая активность без пульса
Асистолия это полное отсутствие регистрируемой электрической активности сердца, имеет очень плохой прогноз. Электрическая активность без пульса (или электромеханическая диссоциация – ЭМД) имеет место при наличии на ЭКГ ритма, в норме ассоциирующегося с адекватным кровообращением, но без определяемого пульса на центральных артериях. В любом случае алгоритм СЛР с использованием дефибриляции не является адекватной мерой терапии данного типа остановки сердца.
При асистолии или ЭМД возможности терапии ограничены. Следует использовать правую часть алгоритма СЛР, представленного на схеме. Как можно раньше проводятся стандартные манипуляции для поддержания проходимости ВДП и обеспечения вентиляции, устанавливается в/в доступ, СЛР продолжается на фоне вводимых каждые три минуты доз адреналина. Атропин (3 мг) вводится однократно. Шансы положительного исхода повышаются, если имеется обратимая причина асистолии или ЭМД, поддающаяся лечению. Основные из них перечислены в алгоритме. Острая гиповолемия – наиболее хорошо поддающееся лечению состояние, приводящее к остановке кровообращения при кровопотере (> 50% объема крови). Такие пациенты требует срочного оперативного лечения и возмещения объема крови. При любом изменении ЭКГ с появлением ФЖ следует незамедлительно перейти к другому алгоритму СЛР.
Решение о прекращении реанимации принимается бригадой, проводящей реанимацию. Часто принятие решения – дело наиболее опытного присутствующего доктора. Пациенты с асистолией или ЭМД без выясненной причины трагедии, без положительной реакции на меры первичной реанимации и адреналин имеют очень плохой прогноз и по нашему опыту реанимация у них должна завершаться через 10-15 минут. Лечение должно продолжаться, пока на ЭКГ регистрируется фибриляция желудочков. Однако вероятность успешной реанимации снижается после 12 дефибриляций.
Успешная реанимации является редкой по прошествии 15-20 минут с момента остановки кровообращения.Наиболее перспективный прогноз имеется у зарегистрированной остановки вследствие фибриляции желудочков, при рано начатых мерах первичной реанимации и дефибриляции. Исследования, проведенные в госпиталях в 1990-х показывают, что частота успешных реанимаций составляет до 50%, тогда как отношение выживаемости/выписки из стационара всего 20% в той же популяционной группе.
Терапия остановки сердца без дефибрилятора
Очевидно, что при отсутствии возможности проведения дефибриляции, терапия остановки менее успешна, однако лечение причины, приведшей к ней, обеспечивает большие шансы на выживание пациента. До установления причины остановки сердца (например, гиповолемии) и ее терапии должна быть начата СЛР и вводиться адреналин.
Другая антиаритмическая терапия
Тогда как дефибриляция остается основной мерой терапии, может также использоваться широкий спектр антиаритмических препаратов. Их применение возможно при наличии персистирующей, угрожающей жизни аритмии для снижения порога чувствительности к успешной дефибриляции или как мера профилактики дальнейших нарушений ритма.
Каждый препарат обладает специфическими показаниями, но большинство из них имеют отрицательный инотропный эффект – очевидный негативный эффект при реанимации. Наиболее часто используемыми из них являются бретилий, амиодарон и сульфат магния. Их эффективность не подтверждена клиническими исследованиями.
Лидокаин. Обладает антиаритмическими свойствами вследствие вызываемой им блокады натриевых каналов и стабилизации клеточной мембраны. Подавляется синусный автоматизм и проводимость в левом желудочке. Имеется также незначительное действие на атриовентрикулярный узел. Миокардиодепрессивное и проаритмическое действия минимальны.
Лидокаин применяется для лечения желудочковой тахикардии. Способность лидокаина увеличивать шансы успешной дефибриляции при персистирующей фибриляции желудочков неоднозначна, однако препарат применяется, если неоднократная дефибриляция безуспешна. Лидокаин может использоваться при гемодинамически стабильной желудочковой тахикардии.
Доза лидокаина при рефрактерной фибриляции желудочков – 100 мг в/в, а при гемодинамически стабильной желудочковой тахикардии – 1 мг/кг в/в – доза, которая при необходимости вводится однократно повторно. В дальнейшем начинается постоянная инфузия лидокаина 4мг/мин втечение получаса, 2 мг/мин втечение 2 часов, а затем 1 мг/мин.
Амиодарон вызывает блокаду калиевых каналов с незначительным замедлением натрий-зависимой деполяризации, удлинением потенциала действия и некоторой блокадой бета-адренорецепторов. Это объясняет антиаритмическое действие и снижение порога чувствительности к дефибриляции при минимальном влиянии на сократимость миокарда.
Амиодарон используется рутинно и является препаратом второй линии для лечения тахиаритмий, возникающих при остановке сердца. Его предпочтительно медленно вводить в центральную вену. Обычно применяется нагрузочная доза 300 мг в/в с последующей постоянной инфузией 900 мг в 1000 мл 5% глюкоза втечение 24 часов. При необходимости первая доза 300 мг может вводиться втечение 5-15 минут с последующими 300 мг за 1 час.
Бретилия тозилат стабилизирует продолжительность потенциала действия во всем миокарде. Это повышает резистентность к желудочковой тахикардии и снижает порог чувствительности к дефибриляции. Однако действие его наступает медленно (15-20 мин), а также имеется тенденция к возникновению непродуктивной электрической активности и более выраженной гипотензии после восстановления ритма.
Сульфат магния является важным фактором для стабилизации кардиомиоцитов. Пониженная его внутриклеточная концентрация стимулирует возбуждение кардиомиоцита, однако, при его нормальной концентрации болюсное введение сульфата магния подавляет эктопические очаги в миокарде желудочков. Исследований по использованию сульфата магния при остановке сердца не проводилось, однако он может применяться в дозе 10 мл 50% р-ра при остановке, развившейся на фоне гипокалиемии.
Кальций имеет специфические показания для неотложной помощи при гиперкалиемии или при таком редком состоянии, как передозировка блокаторов Са2+ каналов (например, верапамила). Несмотря на важную роль кальция в механизме возникновения потенциала действия, а также сокращения миокарда, его введение по различным причинам может быть неэффективным, а иногда и опасным, так как его высокая внутриклеточная концентрация обладает разрушающим действием на поврежденные миокардиоциты и нейроны. Однако при концентрации калия в крови более 6 ммоль/л следует ввести 10 мл 10% хлорида кальция.
В практике, вследствие незначительного действия отдельных препаратов на сократимость миокарда применяется широкий спектр антиаритмических средств, однако их сочетанное применение может обладать опасным кумулятивным эффектом даже при условии восстановления эффективного ритма.
Нарушения ритма, в случае успешной реанимации, остаются вероятным ее последствием.
Терапия постреанимационного периода
После восстановления спонтанного кровообращения метаболические изменения и вероятность поражения миокарда с развитием аритмий делают необходимым проведение последующего мониторинга и интенсивной терапии. Может также потребоваться период церебропротекции для увеличения шансов восстановления мозга, поэтому наиболее подходящее место для таких пациентов – отделения интенсивного наблюдения, интенсивной терапии или кардиореанимации. Даже при кратковременной успешной реанимации сердце может быть значительно повреждено и имеет риск развития аритмий.
Если пациент в сознании, дыхание спонтанное и адекватное, пациент может быть переведен под наблюдение в кардиореанимацию. Поддержание сердечного выброса может потребовать мониторинга центральной гемодинамики и постановки катетера в центральную вену. Требуется также мониторинг различных функций, например, контроль диуреза. Стандартом обследования после остановки сердца является ЭКГ в 12 отведениях, обзорная рентгенография грудной клетки, основные биохимические тесты, включая электролиты, гемограмму, магний, сердечные ферменты.
1. ABC of Resuscitation.British Medical Association UK
2. Advanced Life Support Course Provider Manual (3 rd edition)Resuscitation Council UK1998.
Лекарственная терапия при остановке сердца
Сердечно-легочная реанимация включает в себя немедленную интубацию трахеи, налаживание ИВЛ и проведение непрямого массажа сердца. Одновременно производят канюляцию периферической вены и вводят лекарственные средства.
По существующим правилам СЛР во время катетеризации вен не должна прерываться. Поэтому в отсутствие катетеризации центральной вены производят катетеризацию периферической вены (обычно вены локтевого сгиба или предплечья), через которую поступает лекарственное средство. Конечно, время перфузии через периферическую вену по сравнению с инъекцией препарата в центральную вену несколько увеличивается и терапевтический эффект наступает не сразу. Лекарственный агент во время СЛР достигает центрального отдела кровообращения через 1— 2 мин, в то время как введение препарата в подключичную или яремную вену оказывает немедленное действие. Если же первая доза препарата не дала результата, требуется катетеризация одной из центральных вен. Обычно используют подключичную вену, но доступ к ней, чтобы не прерывать реанимацию, осуществляется через надключичную область. Более предпочтительно использовать внутреннюю яремную вену. Иногда катетеризируют наружную яремную вену. Катетеризация центральных вен при СЛР имеет решающее значение, так как позволяет в любой момент с максимальной эффективностью применять фармакологическую терапию, являющуюся важнейшим звеном СЛР. Все лекарственные вещества в начале реанимации вводят болюсным способом после предварительного разведения в 20 мл инфузионного раствора.
В тех случаях, когда произведена интубация трахеи и не налажена ин-фузия в вену, лекарственные препараты (адреналин, атропин, лидокаин) могут быть введены эндотрахеально через интубационную трубку с помощью аспирационного катетера. ИВЛ при этом не прекращают. Препарат должен быть обязательно разведен в 10 мл изотонического раствора хлорида натрия и его доза в 2—2,5 раза больше интравенозной. Нельзя применять водные растворы для интратрахеального введения, поскольку вода в отличие от изотонического раствора хлорида натрия может оказать негативное влияние на функцию легких и вызвать снижение РаОз.
При проведении ИВЛ во время СЛР необходимо применять 100 % О;
для коррекции тяжелой гипоксии, которая сопровождает остановку сердца.
Инфузионная терапия показана во всех случаях сниженного ОЦК (травма, кровотечение, гиповолемический шок, разрыв аорты). Для этого вводят коллоидные и кристаллоидные растворы и по показаниям кровь. Особая осторожность необходима при инфузии растворов у больных гипо-волемией на фоне острого инфаркта миокарда. При остановке сердца нельзя использовать 5 % раствор глюкозы из-за опасности отека мозга и его увеличения. Глюкоза может применяться только на изотоническом растворе хлорида натрия.
Адреналин. Обладает выраженным кардиостимулирующим действием, эффективен при резком снижении возбудимости миокарда, в том числе при остановке сердца. Все попытки заменить его другими средствами (альфа-2-агонистами) не дали положительного результата. Исследования показали более высокую частоту восстановления спонтанного кровообращения при использовании его высоких доз (0,07—0,02 мг/кг), однако эти данные статистически не подтверждены. Выраженный адренергический эффект препарата имеет положительные и отрицательные стороны. Стимуляция альфа-адренорецепторов увеличивает сопротивление периферических сосудов (без сужения мозговых и коронарных артерий), способствует улучшению мозгового и коронарного кровотока и повышению коронарного перфузионного давления. Бета-адренергическое действие адреналина подтверждается положительным инотропным и хронотропным эффектом. Однако активация бета-адренорецепторов сопровождается накоплением кальция в миокарде, повышением его потребности в Од и снижением суб-эндокардиальной перфузии.
Адреналин показан при всех формах остановки сердца, особенно при асистолии и электромеханической диссоциации. При ФЖ он может быть использован в сочетании с лидокаином.
Рекомендуемые дозы: начальная доза адреналина гидрохлорида 1 мг (10 мл раствора в разведении 1 : 10 000) — внутривенно в течение 3—5 мин, при отсутствии эффекта — повторная доза — 20 мл этого же раствора вводится струйно в систему для внутривенных вливаний и центральную вену.
В тех случаях, когда условий для внутривенного вливания нет, а произведена интубация, следует использовать эндотрахеальный путь введения адреналина, но доза последнего по сравнению с его внутривенным введением должна быть увеличена в 2—2,5 раза. Внугрисердечные инъекции адреналина не рекомендуются, поскольку могут привести к серьезным осложнениям: повреждению коронарных сосудов, тампонаде сердца, пневмотораксу. При внутрисердечном введении прерывается СЛР. Внутрисер^ дечный путь введения адреналина может быть использован при открытой грудной клетке, например во время внутригрудных операций.
Норадреналин. Оказывает мощное альфа- и бета-стимулирующее действие. Вазоконстрикция в отличие от таковой при введении адреналина более выражена и распространяется на мезентериальные и почечные сосуды. Увеличение или снижение СВ зависит от чувствительности к нему. Изменяя сосудистое сопротивление, норадреналин влияет на функциональное состояние левого желудочка — повышает рефлекторную чувствительность каротидных барорецепторов.
Норадреналин показан при лечении тяжелых форм артериальной ги-потензии, сочетающейся с низким периферическим сопротивлением. Вызывая отчетливый вазоконстрикторный эффект, он способствует повышению систолического и диастолического АД и усилению силы сердечных сокращений. При назначении норадреналина следует иметь в виду, что экстравазаты, содержащие норадреналин, могут вести к некрозу тканей. Поэтому требуется их обкалывание фентоламином (в 10—15 мл изотонического раствора натрия хлорида разводят 10 мл фентоламина). Не следует назначать норадреналин при гиповолемии, некорригируемой инфузионной терапией.
Норадреналин назначают в дозе 4 мг на 250 мл 5 % раствора декстрозы или глюкозы. Полученная концентрация норадреналина составляет 16 мкг/мл. Первоначальная скорость вливания 0,5—1 мкг/мин методом титрования до получения эффекта. Для больных с рефракторным шоком скорость инфузии увеличивается до 8—30 мкг/мин. ^
Атропина сульфат применяется при брадикардии, асистолии и слабой электрической активности сердца. Разовая доза 0,5—1 мг. Вводят внутривенно. Если пульса нет, то введение повторяют каждые 3—5 мин в этой же дозе. При брадикардии доза 0,5—1 мг. Введение атропина при отсутствии эффекта продолжают через каждые 3—5 мин, но общая доза не должна быть более 3 мг. Атропин увеличивает ЧСС и повышает потребность миокарда в Ог, что может способствовать распространению зоны ишемии при остром инфаркте миокарда. При полной атриовентрикулярной блокаде атропин неэффективен (необходимы изадрин или чрескожная электрическая
Лидокаин. Оказывает антиаритмическое действие. Во время СЛг применяется главным образом при ФЖ и ЖТ, до и после дефибрилляции и назначения адреналина. При введении лидокаина постоянно контролируют АД, пульс, регистрируют ЭКГ.
При ФЖ начальная доза лидокаина, которая может вызвать быстрый терапевтический эффект, составляет 0,5—1,5 мг/кг. Дополнительно одномоментно вводят от 0,5 до 1,5 мг/кг каждые 10 мин до максимальной дозы 3 мг/кг. Если дефибрилляция запаздывает, то сразу вводят до 1,5 мг/кг препарата. В дальнейшем проводят непрерывную инфузию лидокаина со скоростью 2—4 мг/мин. Следует помнить, что лидокаин применяется одновременно с дефибрилляцией сердца и адреналином, но не может заменить дефибрилляцию.
По показаниям лидокаин назначают превентивно для предупреждения ФЖ при выраженной ЖТ. Период полувыведения колеблется от 24 до 48 ч и зависит от длительности инфузии, состояния сердечно-сосудистой системы. При сердечной недостаточности скорость инактивации лидокаина замедлена и возможны его токсические проявления.
Прокаинамида гидрохлорид используется главным образом при неэффективности лидокаина или преждевременных желудочковых сокращениях и повторных эпизодах ЖТ. Вводится путем постоянной инфузии со скоростью 20 мг/мин до нормализации ритма или развития гипотензии, уши-рения комплекса, а также при достижении общей дозы 17 мг/кг. В экстренных случаях его можно вводить со скоростью 30 мг/мин, но общая доза не должна превышать 17 мг/кг.
Бретилиум применяется при ЖТ и ФЖ, неэффективности попыток де-фибрилляции в сочетании с лидокаином и адреналином. Оказывает антиаритмическое действие и вызывает постганглионарную и адренергическую блокаду, что сопровождается артериальной гипотензией. Показан особенно в тех случаях ФЖ, когда неэффективны лидокаин и прокаинамид, при повторной ФЖ, не снимаемой введением адреналина и лидокаина.
Глюконат и хлорид кальция. Введение в центральную вену или полость сердца 1 г глюконата кальция может способствовать восстановлению механической функции сердца. 10 % раствор кальция хлорида может быть введен внутривенно в дозе 5—7 мг/кг. Показанием к назначению глюконата или хлорида кальция является электромеханическая диссоциация.
Остановка сердца с успешным восстановлением сердечной деятельности (I46.0)
Версия: Справочник заболеваний MedElement

27-я международная выставка “Здравоохранение”
13-15 мая, Алматы, Атакент
Получить бесплатный билет

Выставка “Здравоохранение”
13-15 мая, Алматы, Атакент
Получить бесплатный билет
Общая информация
Краткое описание
Остановка сердца – полное прекращение эффективной деятельности сердца с наличием или отсутствием биоэлектрической активности. Синдром остановки сердца включает фибрилляцию желудочков и асистолию, которые имеют общую клиническую картину.
Различают 3 вида состояний, развивающихся после прекращения деятельности сердца:
1. Обратимое – клиническая смерть: отсутствуют необратимые изменения в жизненно важных органах и системах, в частности в центральной нервной системе.
2. Частично обратимое – социальная смерть: при нежизнеспособности коры головного мозга изменения в других тканях еще носят обратимый характер.
3. Необратимое – биологическая смерть: все ткани оказываются нежизнеспособными и в них развиваются необратимые изменения.
Реанимация в терминальной стадии любой неизлечимой болезни не имеет перспектив и не должна применяться.
Абсолютное противопоказание к оживлению – выраженные гипостатические пятна в отлогих частях тела, являющиеся достоверным признаком биологической смерти.
Клиническая смерть диагностируется на основании признаков смерти.
Основные признаки:
– отсутствие сознания;
– отсутствие дыхания;
– отсутствие пульса на сонной артерии – у взрослых, на бедренной или плечевой артерии – у младенцев;
– ЭКГ-признаки асистолии, фибрилляции желудочков на мониторе.
Дополнительные признаки:
– изменение цвета кожных покровов (очень бледный или цианотичный);
– расширение зрачков.
Наличие любых трех из четырех основных признаков в любой комбинации дает право поставить диагноз “клиническая смерть” и начать проведение с ердечно-легочной и церебральной реанимации ( СЛЦР ).

– Профессиональные медицинские справочники. Стандарты лечения
– Коммуникация с пациентами: вопросы, отзывы, запись на прием
Скачать приложение для ANDROID

– Профессиональные медицинские справочники
– Коммуникация с пациентами: вопросы, отзывы, запись на прием
Скачать приложение для ANDROID
Классификация
Виды прекращения сердечной деятельности:
1. Фибриллляция желудочков – некоординированные сокращения мышечных волокон сердца. Энергичные фибриллярные сокращения отмечаются при сохранившемся тонусе миокарда, вялые фибриллярные сокращения – при атонии.
2. Асистолия – полное прекращение сокращений желудочков. Она может произойти как внезапно (рефлекторно), при сохранившемся тонусе миокарда, так и постепенно – при развитии его атонии. Наиболее часто остановка сердца происходит в диастоле и очень редко – в систоле.
На основе учета степени и характера нарушения проводимости может быть построена рациональная классификация видов остановки сердца.
Первая группа нарушений проводимости сердца включает нарушения проведения возбуждений между различными отделами сердца, при этом возбудимость и сократимость миокарда внутри каждого отдела сердца сохраняются.
К данной группе относятся:
– асистолия всего сердца вследствие нарушений и полной блокады проводимости между синусовым узлом и предсердиями;
– асистолия желудочков в результате полной поперечной блокады;
– резко выраженная желудочковая брадикардия (меньше 30 сокращений в минуту) при неполной блокаде проводимости между предсердиями и желудочками или при наличии редкого автоматизма идиовентрикулярного происхождения.
Вторая группа нарушений проводимости сердца включает нарушения проведения возбуждения внутри проводящей системы желудочков, из-за чего координированность сокращений миокарда желудочков нарушается.
К данной группе относятся:
– фибрилляция и трепетание желудочков;
– пароксизмальная тахикардия, связанная с нарушением внутрижелудочковой или внутрипредсердной проводимости.
Третья группа нарушений проводимости сердца представляет собой наиболее глубокое нарушение проводимости, распространение которого охватывает все конечные разветвления проводящей системы внутри миокарда. При таком состоянии сердца полностью теряются возбудимость и сократимость, оно характеризуется потерей мышечного тонуса – атонией миокарда.
Этиология и патогенез
Привести к остановке сердца могут как кардиальные, так и некардиальные причины.
Заболевания сердца, способные привести к остановке сердца
I. Ишемическая болезнь сердца
Возможные причины электрической нестабильности миокарда:
– острая или хроническая ишемия миокарда;
– постинфарктное ремоделирование сердца с развитием хронической сердечной недостаточности.
II. Другие кардиальные причины:
1. Травма (часто с развитием тампонады).
2. Тяжелый стеноз устья аорты.
3. Прямая кардиостимуляция, катетеризация полостей сердца, коронарография (асистолия является одним из возможных осложнений).
4. Инфекционный эндокардит.
5. Кардиомиопатии (гипертрофическая кардиомиопатия, дилатационная кардиомиопатия, алкогольная кардиопатия, “сердце спортсмена”).
6. Синдром низкого выброса.
7. Миокардит (например, при дифтерии, гриппе).
8. Экссудативный перикардит (тампонада сердца с развитием электромеханической диссоциации и асистолии возникает при скоплении большого количества жидкости).
9. Препятствие притоку или оттоку крови от сердца – внутрисердечный тромбоз, миксома или дисфункция протезированного клапана.
III. Экстракардиальные причины, способные привести к остановке сердца.
1. Циркуляторные:
– гиповолемия (в особенности в результате кровопотери);
– анафилактический, бактериальный или геморрагический шок;
– напряженный пневмоторакс, особенно у пациентов с легочными заболеваниями, травмой грудной клетки или находящихся на искусственной вентиляции легких;
– вазо-вагальный рефлекс (остановка сердца при ударе по передней брюшной стенке);
– тромбоэмболия крупных ветвей легочной артерии.
2. Респираторные:
3. Метаболические:
– острая гиперкальциемия (гиперкальциемический криз при первичном гиперпаратиреозе);
– переохлаждение (снижение температуры тела ниже 28 о С);
– тампонада сердца при уремии;
– гиперадреналинемия (гиперпродукция и усиленный выброс в кровь катехоламинов на высоте сильного психоэмоционального стресса).
4. Побочные эффекты при приеме следующих препаратов:
– средства для наркоза;
– недигидропиридиновые антагонисты кальция;
– препараты, удлиняющие интервал Q–T (дизопирамид, хинидин);
– передозировка сердечных гликозидов.
5. Разные причины:
– электротравма (поражение током, ударом молнии, осложнение электроимпульсной терапии при неадекватном использовании);
– асфиксия (в том числе утопление);
– сепсис, тяжелая бактериальная интоксикация;
– цереброваскулярные осложнения, в частности кровотечения;
– модифицированные диетические программы борьбы с излишней массой тела, основанные на приеме жидкости и белка.
Патогенез остановки сердца
Факторами, вызывающими электрическую нестабильность миокарда, могут выступать его острая или хроническая ишемия, повреждение, постинфарктное ремоделирование сердца с развитием хронической сердечной недостаточности.
Экспериментально выявлены следующие механизмы развития электрической нестабильности миокарда:
1.На клеточно-тканевом уровне появляется гетерогенность сократительного миокарда в результате чередования кардиомиоцитов с различной активностью оксиредуктаз, их диссеминированные повреждения, гипертрофия, атрофия и апоптоз. Наблюдается развитие интерстициального отека и явлений кардиосклероза, нарушающих консолидацию клеток миокарда в функциональный синцитий.
2. На уровне субклеточных структур:
– нарушения Са 2+ -связывающей способности и очаговая диссоциация гликокаликса;
– снижение и зональное насыщение плазмолеммы холестерином;
– изменение плотности бета-адренорецепторов и соотношения активности сопряженных с ними аденилатциклазы и фосфодиэстеразы;
– снижение объемной плотности Т-системы и нарушение ее контактов с цистернами саркоплазматического ретикулума;
– модификация вставочных дисков с разобщением некрусов;
– пролиферация митохондрий и их функциональное ассоциирование на значительной территории наиболее адаптированных кардиомиоцитов.
Выраженность выявленных изменений положительно коррелирует с достоверными нарушениями проведения электрических импульсов в миокарде.
Основные факторы, приводящие к остановке сердца – локальное очаговое замедление и фрагментация волны возбуждения, которая распространяется в электрически неоднородной среде, чьи отдельные участки отличаются различной длительностью потенциалов действия и рефрактерных периодов, скоростью спонтанной диастолической деполяризации и т.п.
Весомое значение имеют также механическое растяжение волокон миокарда вследствие дилатации камер сердца; гипертрофия сердечной мышцы и нарушения нейрогуморальной регуляции сердечного ритма, электролитного обмена, кислотно-основного состояния; гиперкатехоламинемия.
Возможно чередование периодов асистолии и резкой брадикардии с эпизодами фибрилляции желудочков или желудочковой тахикардии.
При заболеваниях сердца асистолия может возникать также как исход брадиаритмий и блокад проведения, главным образом – дисфункции синосового узла и предсердно-желудочковой блокады. Особую опасность представляет дистальная (трифасцикулярная) форма АВ-блокады III степени, которая чаще развивается при обширном переднем инфаркте миокарда с поражением межжелудочковой перегородки и имеет крайне неблагоприятный прогноз (при отсутствии соответствующего лечения летальные исходы могут достигать 80%). Блокада способствует резкому снижению сердечного выброса и развитию отека легких и кардиогенного шока.
При экстракардиальных причинах патогенез умирания различен: при большой кровопотере деятельность сердца угасает постепенно; при гипоксии, асфиксии и раздражении блуждающих нервов возможна мгновенная остановка сердца.
Массивная эмболия сосудов легкого приводит к циркуляторному коллапсу и смерти в течение нескольких минут приблизительно в 10% случаев; некоторые пациенты умирают спустя какое-то время при прогрессирующей правожелудочковой недостаточности и гипоксии.
Использование модифицированных диетических программ, направленных на снижение массы тела с применением белков и жидкости, может приводить к развитию первичной дегенерации атриовентрикулярной проводящей системы с внезапной смертью при отсутствии тяжелого коронарного атеросклероза; часто при этом обнаруживается трифасцикулярная атриовентрикулярная блокада.
При ряде состояний (гипотермия, гиперкалиемия, острый миокардит, неадекватное применение ряда лекарственных препаратов) развитие асистолии может быть опосредовано остановкой или блокадой синусно-предсердного узла с последующим угнетением нижерасположенных пейсмекеров или синдромом слабости синусового узла, сопровождаемым обычно нарушением функции проводящей системы.
Фибромы и воспалительные процессы в области синусно-предсердного или предсердно-желудочкового узлов иногда могут привести к внезапной смерти у людей, не имевших ранее признаков болезни сердца.
При цереброваскулярных расстройствах внезапная остановка сердца чаще опосредована субарахноидальным кровоизлиянием, внезапным изменением внутричерепного давления или поражением ствола мозга.
Патогенез остановки сердца может варьировать в пределах действия одного этиологического фактора. Например, рефлекторная остановка дыхания может возникать при механической асфиксии, как результат непосредственного сдавления каротидных синусов. В иной ситуации могут сдавливаться крупные сосуды шеи, трахеи, может наблюдаться перелом шейных позвонков, что обуславливает несколько другой патогенетический оттенок непосредственного механизма остановки сердца. При утоплении вода может быстро залить трахеобронхиальное дерево, выключив альвеолы из функции оксигенации крови; в другом варианте механизм смерти определяют первичный спазм голосовой щели и критический уровень гипоксии.
Наиболее разнообразны причины “наркозной смерти”:
– рефлекторная остановка сердца в результате недостаточной атропинизации больного;
– асистолия как следствие кардиотоксического действия барбитуратов;
– выраженные симпатомиметические свойства некоторых ингаляционных анестетиков (фторотан, хлороформ, трихлорэтилен, циклопропан).
В ходе анестезии первичная катастрофа может возникнуть в сфере газообмена (“гипоксическая смерть”).
При травматическом шоке главным патогенетическим фактором является кровопотеря. Однако в ряде наблюдений при травматическом шоке на первый план выступают первичные расстройства газообмена (травмы и ранения груди); интоксикация организма продуктами клеточного распада (обширные раны и размозжения), бактериальными токсинами (инфекция); жировая эмболия; выключение жизненно важной функции сердца, головного мозга в результате их прямой травмы.
Медикаментозная терапия сердца

Для ликвидации метаболического ацидоза требуется в/в введение 150—200 мл раствора натрия гидрокарбоната и в/в инфузия смеси 100 мл 4%-ного раствора калия хлорида и 100 мл изотонического раствора глюкозы.
Смесь вводится в течение 1—1,5 ч. Инфузионная терапия во время реанимационных мероприятий обычно не проводится, за исключением случаев, когда имеет место инфаркт правого желудочка или кровотечение.
При фибрилляции желудочков и желудочковой тахикардии вводят в/в струйно 1 мг адреналина (1 мл раствора 1 : 1000), лидокаин, оказывающий антиаритмическое действие. Адреналин в настоящее время является основным медикаментозным препаратом, применяемым в ходе реанимационных мероприятий при остановке сердца. Каждые 3 мин пациенту вводят 1 мг адреналина. Когда адреналин вводится в/в, то за счет повышения сопротивления периферических сосудов, а также диастолического артериального давления в аорте он усиливает мозговой и коронарный кровоток. Используемые одномоментно более высокие (до 5 мг) дозы адреналина не приводят к улучшению исходов реанимации. Также вводят атропин (3 мг), который блокирует блуждающий нерв и применяется при асистолии (однократно) и симптоматической брадикардии (в этом случае доза меньше — 1—0,5 мг).
Наиболее оптимальным является введение лекарственных средств во время реанимационных мероприятий через катетер, установленный в центральной вене, но фактически нередко применяется и периферический венозный доступ. Особенность введения лекарственных препаратов в периферические кровеносные сосуды заключается в том, что после введения каждого препарата следует дополнительно ввести 20—50 мл физраствора для облегчения и ускорения доставки лекарственного вещества до центрального кровотока. Процесс сердечно-легочной реанимации не должен прерываться более чем на 10 с для обеспечения в/в доступа.
Необходимо заранее учитывать возможность внутритрахеального введения лекарственных средств на случай, если в/в доступ окажется невозможным. Поскольку при оказании грамотной медицинской помощи введение дыхательной трубки в трахею (интубация) зачастую проводится раньше, нежели обеспечение в/в доступа, вполне допустимо введение двойных доз атропина, адреналина и лидокаина в трахею. Препараты предварительно разводят в 10 мл 0,9%-ного раствора натрия хлорида.
Для постановки катетера следует выбирать самую близко расположенную к сердцу крупную вену. Зачастую такой является наружная яремная вена. Данная манипуляция должна проводиться только опытным медработником. Внутрисердечное введение лекарственных препаратов небезопасно, поскольку высок риск повреждения левой нисходящей коронарной артерии.
Антиаритмические препараты применяют для снижения чувствительности сердца к электрическому разряду при проведении дефибрилляции, а также для профилактики нарушения сердечного ритма в дальнейшем.
У каждого из применяемых при реанимации лекарственных препаратов имеются свои показания. У большинства из них есть одна общая негативная черта — отрицательный инотропный эффект (снижение силы сердечных сокращений). Наиболее часто из аритмических препаратов применяют бретилий тозилат, амиодарон и магния сульфат, тем не менее эффективность перечисленных лекарственных средств не подтверждена клиническими исследованиями.
Лидокаин оказывает выраженное антиаритмическое действие, поскольку блокирует натриевые каналы и стабилизирует клеточную мембрану. Вследствие этого происходит подавление синусного автоматизма и проводимости в левом желудочке. Проаритмическое действие лидокаина минимально. Данный препарат с успехом применяют для устранения желудочковой тахикардии, но его позитивный эффект при проведении дефибрилляции сердца на фоне персистирующей фибрилляции -— вопрос неоднозначный. Но если неоднократные попытки запустить сердце в новом ритме не приносят ожидаемого эффекта, его применение считается вполне оправданным.
При рефрактерной фибриляции желудочков вводят 100 мг лидокаина в/в, а в случае гемодинамически стабильной желудочковой тахикардии — 1 мг/кг массы тела в/в
Кардиохирургия и реанимация (возможно однократное повторное введение той же дозы). Впоследствии приступают к постоянной инфузии лидокаина.
Амиодарон блокирует калиевые каналы и несколько замедляет натрий-зависимую деполяризацию желудочков, параллельно удлиняя потенциал действия. Таким образом достигается снижение порога чувствительности сердца к электрическому разряду в ходе проведения дефибрилляции. Амиодарон является так называемым «препаратом второй линии» при борьбе с тахиаритмиями на фоне остановки сердца. Введение данного средства желательно проводить медленно через центральную вену.
Как правило, сначала вводят «нагрузочную дозу» (300 мг) в/в, с последующей постоянной инфузией 900 мг в 1000 мл 5%-ного раствора глюкозы на протяжении суток. При наличии показаний, нагрузочная доза амиодарона может вводиться в течение 5—15 мин, а в дальнейшем — еще 300 мг за 1 ч.
Бретилия тозилат стабилизирует продолжительность потенциала действия во всей ткани сердечной мышцы, что увеличивает устойчивость к желудочковой тахикардии и уменьшает порог чувствительности сердца к электрическому разряду при проведении дефибрилляции. Минусом данного препарата является то, что действие его наступает медленно (через 15—20 мин), и существует тенденция к развитию непродуктивной электрической активности сердца. Поэтому после восстановления сердечного ритма артериальное давление может быть очень низким.
Сульфат магния эффективен для стабилизации кардиомиоцитов, но исследований по его использованию при остановке сердца не проводилось. Данное средство вводится в дозе 10 мл 50%-ного раствора при остановке сердца на фоне сниженного уровня калия в крови.
Препараты кальция имеют ряд специфических показаний при оказании неотложной помощи на фоне повышенного содержания калия в крови. Кальция хлорид также применяют при таком достаточно редком состоянии, как передозировка блокаторов кальциевых каналов (может наблюдаться при введении верапамила).
Следует отметить, что сочетанное применение антиаритмических средств представляет определенную опасность вследствие кумулятивного эффекта, т.е. их накапливания в организме. Это может привести к весьма нежелательным последствиям даже при восстановлении нормального сердечного ритма.