Розенталя вена не визуализируется что это значит
Воротная вена: функции, строение системы портального кровообращения, заболевания и диагностика

Многие годы безуспешно боретесь с ГИПЕРТОНИЕЙ?
Глава Института: «Вы будете поражены, насколько просто можно вылечить гипертонию принимая каждый день.
Воротная вена (ВВ, портальная вена) представляет собой один из наиболее крупных сосудистых стволов в теле человека. Без нее невозможно нормальное функционирование пищеварительной системы и адекватная детоксикация крови. Патология этого сосуда не остается незамеченной, вызывая тяжелые последствия.
Система воротной вены печени собирает кровь, идущую от органов живота. Сосуд образуется путем соединения верхней и нижней брыжеечных и селезеночной вены. У некоторых людей нижняя брыжеечная вена впадает в селезеночную, а затем соединение верхней брыжеечной и селезеночной образуют ствол ВВ.
Для лечения гипертонии наши читатели успешно используют ReCardio. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Анатомические особенности кровообращения в системе воротной вены
Анатомия системы воротной вены (портальной системы) сложна. Это своего рода дополнительный круг венозного кровообращения, необходимый для очищения плазмы от токсинов и ненужных метаболитов, без чего они попадали бы сразу в нижнюю полую, затем в сердце и далее в легочный круг и артериальную часть большого.
Последнее явление наблюдается при поражении печеночной паренхимы, например, у больных циррозом. Именно отсутствие дополнительного «фильтра» на пути венозной крови от пищеварительной системы и создает предпосылки для сильной интоксикации продуктами обмена.
Изучив основы анатомии в школе, многие помнят, что в большинство органов нашего тела входит артерия, несущая кровь, богатую кислородом и питательными компонентами, а выходит вена, уносящая «отработанную» кровь к правой половине сердца и легким.
Система воротной вены устроена несколько иначе, особенностью ее можно считать то обстоятельство, что в печень, помимо артерии, входит венозный сосуд, кровь из которого поступает опять же в вены – печеночные, пройдя через паренхиму органа. Создается как бы дополнительный кровоток, от работы которого зависит состояние всего организма.

Образование портальной системы происходит за счет крупных венозных стволов, сливающихся между собой близ печени. Брыжеечные вены транспортируют кровь от петель кишечника, селезеночная вена выходит из селезенки и принимает в себя кровь из вен желудка и поджелудочной железы. Позади головки поджелудочной железы происходит соединение венозных «магистралей», дающих начало портальной системе.
Между листками панкреатодуоденальной связки в ВВ впадают желудочные, околопупочные и препилорические вены. В этой области ВВ расположена позади от печеночной артерии и общего желчного протока, совместно с которыми она следует к воротам печени.
В воротах печени либо не доходя до них один-полтора сантиметра происходит деление на правую и левую ветви воротной вены, которые заходят в обе печеночные доли и там распадаются на более мелкие венозные сосуды. Достигая печеночной дольки, венулы оплетают ее снаружи, входят внутрь, а после того, как кровь обезвредится при контакте с гепатоцитами, она поступает в центральные вены, выходящие из центра каждой дольки. Центральные вены собираются в более крупные и образуют печеночные, выносящие кровь из печени и впадающие в нижнюю полую.
Изменение размера ВВ несет большое диагностическое значение и может говорить о различной патологии – цирроз, венозный тромбоз, патология селезенки и поджелудочной железы и др. Длина воротной вены печени в норме составляет примерно 6-8 см, а диаметр просвета – до полутора сантиметров.
Система воротной вены не существует изолированно от других сосудистых бассейнов. Природой предусмотрена возможность сброса «лишней» крови в другие вены, если произойдет нарушение гемодинамики в данном отделе. Понятно, что возможности такого сброса ограничены и не могут длиться бесконечно долго, но они позволяют хотя бы частично компенсировать состояние больного при тяжелых болезнях печеночной паренхимы или тромбозе самой вены, хотя подчас и становятся сами причиной опасных состояний (кровотечение).
Связь между портальной веной и другими венозными коллекторами организма осуществляется благодаря анастомозам, локализация которых хорошо известна хирургам, которые довольно часто сталкиваются с острыми кровотечениями из зон анастомозирования.
Анастомозы воротной и полых вен в здоровом теле не выражены, поскольку не несут на себе никакой нагрузки. При патологии, когда затрудняется поступление крови внутрь печени, происходит расширение воротной вены, давление в ней нарастает, и кровь вынуждена искать себе другие пути оттока, которыми становятся анастомозы.
Эти анастомозы называют портокавальными, то есть кровь, которая должна была направиться в ВВ, идет в полую вену посредством других сосудов, объединяющих оба бассейна кровотока.
К самым значимым анастомозам воротной вены относят:
- Соединение желудочных и пищеводных вен;
- Анастомозы между венами прямой кишки;
- Соустья вен передней стенки живота;
- Анастомозы между венами органов пищеварения с венами забрюшинного пространства.
В клинике наибольшее значение имеет анастомоз между желудочными и пищеводными сосудами. Если продвижение крови по ВВ нарушено, она расширена, нарастает портальная гипертензия, то кровь устремляется во впадающие сосуды – желудочные вены. Последние имеют систему коллатералей с пищеводными, куда и перенаправляется венозная кровь, не ушедшая в печень.
Поскольку возможности сброса крови в полую вену через пищеводные ограничены, то перегрузка их лишним объемом приводит к варикозному расширению с вероятностью кровотечения, зачастую – смертельно опасного. Продольно расположенные вены нижней и средней третей пищевода не имеют возможности спадаться, но подвержены риску травмирования при приеме пищи, рвотном рефлексе, рефлюксе из желудка. Кровотечение из варикозно измененных вен пищевода и начального отдела желудка – не редкость при циррозе печени.
От прямой кишки венозный отток происходит как в систему ВВ (верхняя треть), так и непосредственно в нижнюю полую, в обход печени. При увеличении давления в портальной системе неминуемо развивается застой в венах верхней части органа, откуда она сбрасывается посредством коллатералей в среднюю вену ректума. Клинически это выражается в варикозном расширении геморроидальных узлов – развивается геморрой.
Третьим местом соединения двух венозных бассейнов является брюшная стенка, где вены околопупочной области принимают на себя «излишки» крови и расширяются в направлении к периферии. Образно это явление именуют «головой медузы» из-за некоторого внешнего сходства с головой мифической Медузы Горгоны, имевшей вместо волос на голове извивающихся змей.
Анастомозы между венами забрюшинного пространства и ВВ не столь выражены, как описанные выше, проследить их по внешним признакам невозможно, к кровоточивости они не склонны.
Видео: лекция по венам большого круга кровообращения
Видео: основные сведения о воротной вене из конспекта
Патология портальной системы
Среди патологических состояний, в которых задействована система ВВ, встречаются:
- Тромбообразование (вне- и внутрипеченочное);
- Синдром портальной гипертензии (СПГ), связанный с патологией печени;
- Кавернозная трансформация;
- Гнойный воспалительный процесс.
Тромбоз воротной вены
Тромбоз воротной вены (ТВВ) – это опасное состояние, при котором в ВВ появляются свертки крови, препятствующие ее движению в направлении печени. Эта патология сопровождается нарастанием давления в сосудах – портальная гипертензия.
По статистике, у жителей развивающихся регионов СПГ сопровождается тромбообразованием в ВВ в трети случаев. У более чем половины больных, умерших от цирроза, тромботические сгустки могут быть обнаружены посмертно.
Причинами тромбоза считают:
- Цирроз печени;
- Злокачественные опухоли кишечника;
- Воспаление пупочной вены при катетеризации у младенцев;
- Воспалительные процессы в органах пищеварения – холецистит, панкреатит, язвы кишечника, колиты и др.;
- Травмы; хирургические вмешательства (шунтирование, удаление селезенки, желчного пузыря, пересадка печени);
- Нарушения свертываемости крови, в том числе, при некоторых неоплазиях (полицитемия, рак поджелудочной железы);
- Некоторые инфекции (туберкулез портальных лимфоузлов, цитомегаловирусное воспаление).
Среди очень редких причин ТВВ указывают беременность и длительное употребление оральных контрацептивных препаратов, особенно, если женщина перешагнула 35-40-летний рубеж.
Симптоматика ТВВ складывается из сильной боли в животе, тошноты, диспепсических расстройств, рвоты. Возможно повышение температуры тела, кровотечение из геморроидальных узлов.
Хронический прогрессирующий тромбоз, когда кровообращение по сосуду частично сохранено, будет сопровождаться нарастанием типичной картины СПГ – в животе скопится жидкость, увеличится селезенка, дав характерную тяжесть либо болезненность в левом подреберье, расширятся вены пищевода с высоким риском опасного кровотечения.
Основным способом диагностики ТВВ служит ультразвуковое исследование, при этом тромб в воротной вене выглядит как плотное (гиперэхогенное) образование, заполняющее и просвет самой вены, и ее ветви. Если УЗИ дополнить допплерометрией, то кровоток в зоне поражения будет отсутствовать. Характерным также считается кавернозное перерождение сосудов вследствие расширения вен мелкого калибра.
Небольшие тромбы портальной системы можно обнаружить посредством эндоскопического ультразвукового исследования, а КТ и МРТ дают возможность определить точные причины и найти вероятные осложнения тромбообразования.
Видео: неполный тромбоз воротной вены на УЗИ
Синдром портальной гипертензии
Портальная гипертензия – это увеличение давления в системе воротной вены, которое может сопутствовать местному тромбообразованию и тяжелой патологии внутренних органов, в первую очередь – печени.

В норме давление в ВВ не больше десяти мм рт. ст, при превышении этого показателя на 2 единицы уже можно говорить о СПГ. В таких случаях постепенно включаются портокавальные анастомозы, и происходит варикозное расширение коллатеральный путей оттока.
Причинами СПГ являются:
- Цирроз печени;
- Синдром Бадда-Киари (тромбоз вен печени);
- Гепатиты;
- Тяжелые пороки сердца;
- Обменные нарушения – гемохроматоз, амилоидоз с необратимым поражением печеночной ткани;
- Тромбоз вены селезенки;
- Тромбоз воротной вены.
Клиническими признаками СПГ считают диспепсические нарушения, ощущение тяжести в правом подреберье, желтуху, падение массы тела, слабость. Классическими проявлениями повышенного давления в ВВ становятся спленомегалия, то есть увеличение селезенки, которая испытывает на себе венозный застой, поскольку кровь не способна покинуть селезеночную вену, а также асцит (жидкость в животе) и варикозное расширение вен нижнего сегмента пищевода (как следствие шунтирования венозной крови).
УЗИ брюшной полости при СПГ покажет увеличение объемов печени, селезенки, наличие жидкости. Ширину просвета сосудов и характер движения крови оценивают при УЗИ с допплером: ВВ увеличена в диаметре, просветы верхней брыжеечной и вены селезенки расширены.
Кавернозная трансформация
При СПГ, ТВВ, врожденных пороках формирования вен печени (сужение, частичное или полное отсутствие) в области ствола воротной вены нередко можно обнаружить так называемую каверному. Эта зона кавернозной трансформации представлена множеством небольших по диаметру переплетающихся сосудов, которые частично компенсируют недостаток кровообращения в портальной системе. Кавернозная трансформация имеет внешнее сходство с опухолевидным процессом, поэтому и называют ее каверномой.
Обнаружение каверномы у детей может быть косвенным признаком врожденных аномалий сосудистой системы печени, у взрослых она чаще говорит о развившейся портальной гипертензии на фоне цирроза, гепатита.
Воспалительные процессы
К числу редких поражений воротной вены вены относят острое гнойное воспаление – пилефлебит, имеющее отчетливую склонность «перерасти» в тромбоз. Главным виновником пилефлебита выступает острый аппендицит, а следствием заболевания – абсдедирование в печеночной ткани и гибель больного.
Симптоматика воспаления в ВВ крайне неспецифична, поэтому заподозрить этот процесс очень сложно. Еще недавно диагноз ставился в основном посмертно, но возможность применения МРТ несколько изменила качество диагностики в лучшую сторону, и пилефлебит может быть обнаружен при жизни.
К признакам пилефлебита можно отнести лихорадку, озноб, сильнейшую интоксикацию, боли в животе. Гнойное воспаление ВВ может вызвать увеличение давления в сосуде и, соответственно, кровотечения из пищеводных и желудочных вен. При занесении инфекции в паренхиму печени и развитии в ней гнойных полостей появится желтуха.
Лабораторные обследования при пилефлебите покажут наличие острого воспалительного процесса (повысится СОЭ, возрастут лейкоциты), но достоверно судить о наличии пилефлебита помогают УЗИ, допплерометрия, КТ и МРТ.
Диагностика патологии воротной вены
Основным методом диагностики изменений воротной вены является УЗИ, достоинствами которого можно считать безопасность, дешевизну и высокую доступность для широкого круга лиц. Исследование безболезненно, не занимает много времени, может применяться детям, беременным женщинам и людям преклонного возраста.
Современным дополнением к рутинному УЗИ считается допплерометрия, позволяющая оценить скорость и направление тока крови. ВВ на УЗИ просматривается в воротах печени, где она раздваивается на горизонтально расположенные правую и левую ветви. Так крови при допплерометрии направлен в сторону печени. Нормой на УЗИ считается диаметр сосуда в пределах 13 мм.
Для лечения гипертонии наши читатели успешно используют ReCardio. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…

При тромбообразовании в вене будет обнаружено гиперэхогенное содержимое, неоднородное, заполняющее часть диаметра сосуда или полностью весь просвет, приводя к тотальному прекращению движения крови. Цветное допплеровское картирование покажет отсутствие кровотока при полной обструкции тромбом или пристеночный его характер около кровяного свертка.
При СПГ на УЗИ врач обнаружит расширение просветов сосудов, увеличение объема печени, скопление жидкости в полости живота, уменьшение скорости кровотока на цветном допплере. Косвенным признаком СПГ будет наличие кавернозных изменений, которые могут быть подтверждены посредством допплерометрии.
Помимо УЗИ, для диагностики патологии воротной вены применяют КТ с контрастированием. Достоинствами МРТ можно считать возможность определения причин изменений в портальной системе, осмотра паренхимы печени, лимфоузлов и других рядом расположенных образований. Недостаток – дороговизна и малая доступность, особенно, в небольших населенных пунктах.
Ангиография – один из самых точных методов диагностики портального тромбоза. При портальной гипертензии обследование обязательно включает ФГДС для оценки состояния портокавальных анастомозов в пищеводе, эзофагоскопию, возможно рентгеноконтрастное исследование пищевода и желудка.
Данные инструментальных методов обследований дополняются анализами крови, в которых обнаруживаются отклонения от нормы (лейкоцитоз, увеличение печеночных ферментов, билирубина и т. д.), и жалобами больного, после чего врач может поставить точный диагноз поражение портальной системы.
Способ визуализации сосудов головного мозга



















Владельцы патента RU 2454936:
Изобретение относится к медицине, а именно ультразвуковой диагностике, и предназначено для визуализации сосудов головного мозга. Проводят ультразвуковое исследование сосудов. Устанавливают датчик у переднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне угла нижней челюсти. Направляют ультразвуковой луч к противоположной глазнице. Методом дуплексного сканирования на глубине сканирования 4-5 см визуализируют цистернальный сегмент и сифон кавернозного сегмента внутренней сонной артерии, кавернозный синус, глазные артерию и вены на стороне исследования. Устанавливают датчик у заднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне нижнего края сосцевидного отростка. Направляют луч к глазнице на стороне исследования и, меняя угол наклона датчика, методом дуплексного сканирования на глубине сканирования 4-5 см визуализируют остальные сегменты интракраниального отдела внутренней сонной артерии на стороне исследования. Способ позволяет оценить гемодинамику каротидно-кавернозного комплекса, выявить патологические изменения кровотока в глазничной артерии и венах. 1 з.п. ф-лы, 2 пр., 18 ил., 2 табл.
Изобретение относится к медицине, а именно к ультразвуковой диагностике. Может быть использовано при обследовании пациентов с различной сосудистой патологией, с неврологическими, офтальмологическими и другими жалобами для выявления структурно-функциональных изменений со стороны интракраниального сегмента внутренней сонной артерии и глубоких вен мозга. Метод может применяться в отделениях ультразвуковой диагностики, занимающихся исследованием сосудистой системы у детей и взрослых.
Методика неинвазивного ультразвукового исследования интракраниальных артерий непосредственно через кожу головы была предложена Р.Аслидом в 1982 году и открыла большие возможности клинического исследования интракраниальных артерий.
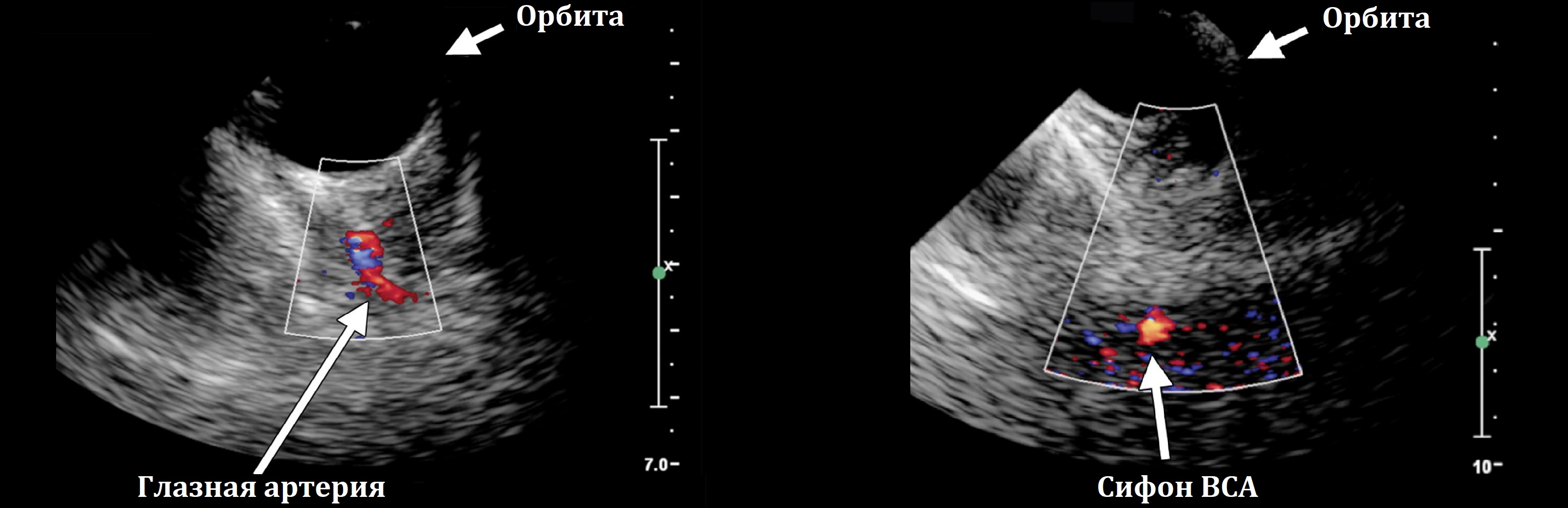
Использование трансорбитального окна для визуализации сифона внутренней сонной артерии и глазной артерии применяется редко из-за сложной конфигурации и большой глубины залегания сифона внутренней сонной артерии, невозможности оценки параметров кровотока из-за некорректности угла (визуализация сифона происходит в поперечном сечении). Снижение мощности сканирования при трансорбитальном доступе (из-за возможного развития отслойки сетчатки) усложняет визуализацию. Применение трансорбитального доступа у детей до 8-9 лет практически невозможно, т.к. вызывает у ребенка страх и другие негативные реакции.
Прототипом изобретения является исследование интракраниальных сосудов головного мозга методом дуплексного сканирования (Лелюк С.Э., Лелюк В.Г. «Ультразвуковая ангиология», 1-е изд. – М.: Реальное Время, 1999. – 288 с.: ил.). Для визуализации основных церебральных сосудов в прототипе используют секторные датчики с частотой 1-2,5 МГц и стандартные доступы через височные и орбитальные окна.
Самые тонкие кости височных и глазничных областей черепа имеют так называемые «окна», позволяющие проводить транскраниальное ультразвуковое обследование. При сканировании через височные окна по известному способу датчик помещают на чешую височной кости кпереди от ушной раковины, над ней и кзади от ушной раковины, плоскость сканирования проходит параллельно основанию черепа. В этой проекции, как описывают авторы, визуализируют средние, передние, задние мозговые артерии, прямой синус, вена Розенталя, вена Галена, средняя мозговая вена, при изменении плоскости сканирования визуализируют сигмовидный, сагиттальный, поперечный синусы и область сифона внутренней сонной артерии.
Каротидным сифоном называют несколько изгибов внутренней сонной артерии по выходу из костного канала сбоку от тела клиновидной кости в пещеристой пазухе. (Атлас артерий и вен головного мозга, М.: Медицина, 1979; Куликов В.П. Ультразвуковая диагностика сосудистых заболеваний. 2007 г. М.: ООО Фирма «СТРОМ», стр.125).
Но на практике описанной методикой достаточно сложно визуализировать венозные синусы и глубокие вены мозга. Необходим большой опыт, достаточное время, терпение исследователя, высокий класс ультразвуковой аппаратуры (высокая разрешающая способность сканера) для качественной визуализации анатомических ориентиров при визуализации сосудов в В-режиме. Сами авторы указывают на ограничения при исследовании структур и сосудов головного мозга через височные окна, наличие и выраженность которых неодинаковы. У пациентов старшего возраста и у детей монголоидной расы ультразвуковые темпоральные окна могут отсутствовать.
Задачей изобретения является разработка способа более полного, доступного и недорогого метода исследования церебральных сосудов.
Технический результат заключается в расширении диагностических возможностей метода ультразвукового исследования церебральных сосудов за счет нового, простого в применении способа визуализации интракраниального сегмента внутренней сонной артерии, кавернозного синуса и глазных сосудов, что способствует решению дифференциально-диагностических и лечебных задач.
Нами установлены области установки датчика, определенные плоскости и глубина сканирования, которые в сочетании друг с другом позволяют четко визуализировать интракраниальные сегменты внутренней сонной артерии, кавернозный синус, глазные артерию и вены.
Новый доступ позволяет не только визуализировать, но и определить тип строения кавернозного синуса, оценить кавернозно-каротидный комплекс в целом, что важно при развитии некоторой патологии слуха и зрения.
Подобранные нами режимы сканирования, зоны установки датчика определены эмпирически, не соответствуют проекции исследуемых сосудов на кожный покров, однако позволяют достоверно визуализировать и проводить количественную оценку показателей кровотока.
При сохраняющейся неинвазивности, простоте и доступности метода, новый способ позволяет более детально оценить церебральную гемодинамику, включая состояние венозного оттока и выявление структурных аномалий.
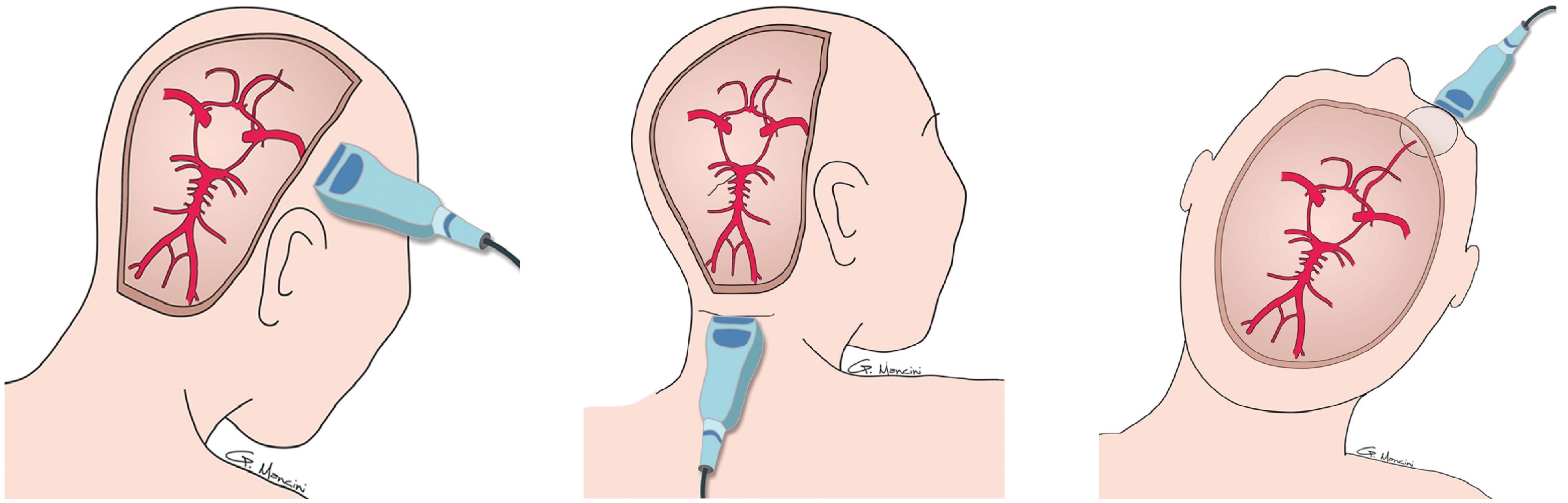
Сущность изобретения состоит в следующем: способ визуализации сосудов головного мозга включает проведение ультразвукового исследования с установкой датчика на кожные покровы исследуемого в области височных окон. Дополнительно устанавливают датчик у переднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне угла нижней челюсти. Используют датчики 2,5 МГц или мультичастотный датчик 2,5-5 МГц. Ультразвуковой луч направляют к противоположной глазнице. Методом дуплексного сканирования на глубине сканирования 4-5 см визуализируют цистернальный сегмент и сифон кавернозного сегмента внутренней сонной артерии, кавернозный синус, глазные артерию и вены на стороне исследования. Устанавливают датчик у заднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне нижнего края сосцевидного отростка, направляют луч к глазнице на стороне исследования и, меняя угол наклона датчика, методом дуплексного сканирования на глубине сканирования 4-5 см визуализируют остальные сегменты интракраниального отдела внутренней сонной артерии на стороне исследования. Аналогично визуализируют внутреннюю сонную артерию, кавернозный синус, глазные артерию и вены с другой стороны.
Частным случаем является проведение исследования в триплексном режиме.
Способ осуществляется следующим образом: положение пациента лежа на спине. Голова расположена ровно или может быть слегка повернута в сторону, противоположную исследуемой. Подбородок немного поднят вверх. Пальпаторно определяют положение височных окон сразу над скуловым отростком височной кости.
Используют три височных окна: переднее, расположенное кпереди от ушной раковины; среднее, расположенное несколько выше, сразу над ушной раковиной и заднее, расположенное кзади от ушной раковины (выбирая окна лучшей визуализации индивидуально).
На кожу пациента в этой области наносят гель для лучшего контакта датчика с кожей и лучшей проводимости ультразвука. Проводят дуплексное сканирование датчиком 2,5 МГц в плоскости, параллельной основанию черепа. Визуализируют среднюю, переднюю и заднюю мозговые артерии. В триплексном режиме сканирования проводят качественную и количественную оценку кровотока.
Далее устанавливают датчик у переднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне угла нижней челюсти. Ультразвуковой луч направляют к противоположной глазнице. Методом дуплексного сканирования на глубине сканирования 4-5 см визуализируют цистернальный сегмент и сифон кавернозного сегмента внутренней сонной артерии, кавернозный синус, глазные артерию и вены на стороне исследования. Далее устанавливают датчик у заднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне нижнего края сосцевидного отростка, направляют луч к глазнице на стороне исследования и, меняя угол наклона датчика, методом дуплексного сканирования на глубине сканирования 4-5 см визуализируют остальные сегменты интракраниального отдела внутренней сонной артерии на стороне исследования.
Аналогично визуализируют внутреннюю сонную артерию, кавернозный синус, глазные артерию и вены с другой стороны.
Для количественной оценки кровотока в артериях и венах исследование проводят в триплексном режиме.
Для доказательств возможности реализации заявленного назначения и достижения указанного технического результата приводим следующие данные.
Обследовано 230 человек с жалобами на головные боли, головокружения, носовые кровотечения, повышенную утомляемость, метеозависимость, нарушение сна, снижение слуха и зрения. Из них – 72 взрослых (в возрасте от 20 до 55 лет) и 158 детей разных возрастных групп (от 2 до 16 лет). Группу сравнения составили 47 практически здоровых лиц (детей и взрослых).
Кавернозный синус визуализирован в 100% случаев при обследовании детей и взрослых. В 65% случаев выявлялись изменения венозного оттока по кавернозным синусам с одной или двух сторон.
Кавернозный синус, являясь одним из основных коллекторов церебральной венозной крови, играет важную роль в механизме венозного церебрального кровообращения. Во всех случаях визуализации удалось интерпретировать тип строения кавернозного синуса: 31% – лакунарный тип строения, в 11% – пещеристый, в 58% – смешанный. Необходимо отметить, что в группе практически здоровых лиц разных возрастных групп в 51% преобладал лакунарный тип строении, в 40% – смешанный, в 9% – пещеристый. Такая информация не могла быть получена с помощью прототипа.
Визуализировать область сифона внутренней сонной артерии удалось в 100% всех случаев. Другие интракраниальные сегменты внутренней сонной артерии визуализировались от 49% (у взрослых) до 90% (у детей). Извитость интракраниального отдела внутренней сонной артерии была выявлена в 47% случаев, что не могло быть установлено прототипом.
Глазные артерии и вены визуализировались у 100% обследованных. Усиление линейной скорости кровотока в глазных венах выявлялась в 53% случаев, чаще сочеталось с усилением линейной скорости кровотока в кавернозном синусе и наблюдалось у детей с патологией зрения.
Таким образом, мы получили возможность оценить церебральную гемодинамику в структурах, которые не могли быть визуализированы с помощью прототипа.
Благодаря новой методике мы смогли не только выявить функциональные изменения, но и предположить структурные аномалии, что в дальнейшем было подтверждено при магнитно-резонансной томографии. «Маркером» структурной цереброваскулярной патологии явились выявленные изменения в кавернозном синусе.
Так, группе детей из 88 человек с клиническими жалобами на головные боли, головокружения, носовые кровотечения было проведено исследование церебральных сосудов новым способом визуализации с дальнейшим МРТ-исследованием. Данные, полученные с помощью нового способа визуализации сосудов в виде усиления линейных скоростей кровотока в кавернозном синусе (в 77%), позволили предположить наличие структурных изменений. В венозном режиме МРТ в 53% были выявлены гипоплазии поперечного и сигмовидных синусов, в структурном режиме МРТ в 47% были выявлены аномалии краниовертебрального перехода Арнольда-Киари. Пациентам была назначена терапия, направленная на улучшение венозного оттока, что привело к хорошим клиническим результатам. В 86% случаев у пациентов снизились частота и выраженность головных болей, регрессировали носовые кровотечения и головокружения.
Предложенный нами метод, оставаясь простым и доступным, не требующим дополнительных затрат, расширяет диагностические возможности ультразвуковых методов исследования, позволяет достоверно и более детально исследовать сосуды головного мозга и венозные синусы, выявлять структурные и функциональные изменения церебрального кровотока, проводить дифференциальную диагностику, определять тактику и своевременно назначать необходимую медикаментозную коррекцию, рекомендовать ограничения по физической нагрузке, что особенно актуально в детском возрасте. Безопасность и неинвазивность методики предполагает контроль за лечением и наблюдение в динамике. А высокая информативность способа визуализации церебральных сосудов позволяет определить тактику ведения пациентов с назначением патогенетически обоснованной терапии без привлечения дополнительных, дорогостоящих методик, таких как МРТ.
№1. Пациент А., 12 лет, направлен на исследование церебральных сосудов с жалобами на головные боли, носовые кровотечения, повышенную утомляемость.
Проведено исследование церебрального кровотока. Исследование проводилось на аппарате Lodgiq Р5. Секторным мультичастотным датчиком 2,5-5 МГц из положения лежа на спине через переднее височное окно проведено дуплексное сканирование артерий Виллизиева круга. В триплексном режиме с использованием энергетического картирования получены спектральные характеристики передней, средней и задней мозговых артерий (рис.1). На рис.2 и рис.3 режимы дуплексного и триплексного сканирования с указанием линейных скоростей кровотока.
Направление кровотока в визуализируемых сосудах и компрессионные пробы с пережатием общей сонной артерии позволили правильно интерпретировать полученные изображения сосудов. Направление кровотока в средней мозговой артерии ориентировано к датчику, кратковременное (3-5 с) пережатие гомолатеральной общей сонной артерии в области шеи вызывает редукцию кровотока. Кровоток в передней мозговой артерии направлен от датчика, при компрессии гомолатеральной сонной артерии снижается или меняется на противоположный (при функционировании передней соединительной артерии). Кровоток по задней мозговой артерии направлен к датчику, при компрессии общей сонной артерии с одноименной стороны не меняется или увеличивается.
Далее датчик устанавливали у переднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне угла нижней челюсти. Ультразвуковой луч направляли к противоположной глазнице. Методом дуплексного сканирования на глубине сканирования 5 см визуализировали цистернальный сегмент и сифон кавернозного сегмента внутренней сонной артерии, кавернозный синус. Из этого положения датчика визуализировали глазные артерию и вены на стороне исследования. Далее устанавливали датчик у заднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне нижнего края сосцевидного отростка. Направляли луч к глазнице на стороне исследования и, меняя угол наклона датчика, методом дуплексного сканирования на глубине сканирования 5 см визуализировали остальные сегменты интракраниального отдела внутренней сонной артерии на стороне исследования. Аналогично визуализировали внутреннюю сонную артерию, кавернозный синус, глазные артерию и вены с другой стороны.
В триплексном режиме оценивали количественные характеристики кровотока. Было отмечено усиление линейной скорости кровотока в кавернозном синусе справа до 80 см/с. На рис.4 – визуализация правой глазной вены с усиленным кровотоком: линейная скорость кровотока в глазной вене 50 см/с. На рис.5 – эхограмма сифона внутренней сонной артерии и кавернозного синуса из нового доступа в триплексном режиме. После визуализации кавернозного синуса определяли тип его строения. На рис.6 – кавернозный синус, тип строения лакунарный. На рис.7 представлены эхограммы визуализированных новым способом кавернозного синуса, сифона внутренней сонной артерии, фрагмента глазной артерии.
Далее устанавливали датчик у заднего края грудинно-ключично-сосцевидной мышцы и параллельно ему, на уровне нижнего края сосцевидного отростка. Ультразвуковой луч направляли к глазнице на стороне исследования. Меняя угол наклона датчика, методом дуплексного сканирования на глубине сканирования 5 см визуализировали другие сегменты интракраниального отдела внутренней сонной артерии и глазную артерию на стороне исследования (рис.8, рис.9).
Аналогично проводили исследование с другой стороны.
Для исследования артерий вертебрально-базилярного бассейна использовали субокципитальное окно. Положение пациента лежа на животе с прямым положением головы. После пальпации края большого затылочного отверстия, наносили гель на кожу пациента, располагали датчик ниже края большого затылочного отверстия по средней линии. Ультразвуковой луч из срединного положения направляли к надбровью, а из парамедианной локации – к противоположной глазнице, плоскость сканирования по прототипу не превышала 60° по отношению к поверхности шеи. Для определения скорости кровотока проводили исследование в триплексном режиме.
В таблице 1 представлены результаты обследования церебральных сосудов.
Венозная дисциркуляция в детском и подростковом возрасте

Введение
Сосудистые поражения нервной системы являются важной проблемой современной клинической неврологии. Изучение нарушений венозного кровообращения головного мозга при этом остается одной из актуальных задач современной медицины.
Совершенствование ультразвуковой аппаратуры, а также ее программного обеспечения привело к тому, что при исследовании кровотока в артериях головного мозга удается оценить состояние венозного кровотока на достаточно хорошем уровне.
Однако основная проблема при этом заключается в том, что данные о нормативных значениях скоростей в венозной системе головного мозга крайне разрозненные, обрывочные и не всегда однозначные. В связи с этим часто приходится полагаться на собственный опыт, принимая за основу данные ряда литературных источников (табл. 1), в большей степени соответствующие особенностям данного прибора, качеству получаемого изображения и возрасту больного. Небольшое число ультразвуковых исследований, где содержались бы данные о состоянии венозного кровотока на экстра- и тем более на интракраниальном уровнях, объясняется в первую очередь аппаратными особенностями, и уже только после этого недостаточным объемом информации по данной проблематике в периодической литературе, сложностью пространственно-анатомического трехмерного восприятия интракраниальной венозной системы врачами-диагностами, низкой потребностью в подобных исследованиях со стороны невропатологов.
| Автор | Внутренняя яремная вена | Средняя мозговая вена | Вена Розенталя | Вена Галена | Прямой синус | Внутренняя мозговая вена | Позвоночные вены |
|---|---|---|---|---|---|---|---|
| В.Г. Лелюк, С.Э. Лелюк, 2003 [1] | 7-45 правая 12-33 левая |
9 | 11 | 15 | |||
| J. Valdueza и соавт., 1996 [2] | 6-18 | 4-17 | |||||
| B.G. Schoser, 1999 [3] | 5-12 | ||||||
| E. Stolz и соавт., 1997 [4] | 13,8 ± 8,9 | 13,7 ± 4,7 | 31,7 ±15,6 | ||||
| R. Baumgartner и соавт., 1997 [5] | 4-15 | 7-19 | 12-39 | 10-18 | |||
| R. Aaslid, 1991 [6] | 23 ± 3 | ||||||
| В.А. Шахнович, 1998 [7] | 14-28 | ||||||
| М.Л. Дическул и соавт., 2008 [8] | 9,8-20,9 | ||||||
| Г.А. Иваничев, Г.Б. Долгих, 2007 [9] | 22,0 ± 4,6* 20,1 ± 3,2** |
17,7 ± 3,3* 16,2 ± 2,2** |
|||||
| Г.Б. Долгих, Г.А. Иваничев, 2008 [10] | 13,6 ± 0,3 | 23,4 ± 0,9 | 18,7 ± 0,9 |
Целью настоящего исследования явилась оценка корреляционных зависимостей у пациентов с признаками венозной дисциркуляции на интра- и экстракраниальном уровнях, церебральной венозной гемодинамики у детей и подростков с клиникой “краниалгии”, с уточнением причинно-следственных связей, обуславливающих формирование венозной дисциркуляции.
Материал и методы
В исследование включено 106 детей в возрасте от 2 до 18 лет, средний возраст 9,87 ± 3,9 года (от 2 до 6 лет – 18 человек, средний возраст 3,8 ± 1,43 года; от 7 до 18 лет – 88 человек, средний возраст 11,1 ± 2,99 года), направленных на обследование в диагностический центр г. Калининграда с клиникой головной боли, либо явлениями вертебробазилярной недостаточности. В процессе выполнения обследования у всех были выявлены признаки дисгемии на интра- и экстракраниальном уровнях. Ультразвуковые допплерографические исследования артериального и венозного кровотока на уровне шеи и основания головного мозга выполнялись на приборе Medison Accuvix V10 (Ю. Корея), в В-, С-, PW-режимах, линейным (L5-12 МГц) и секторным фазированным (Р2-4 МГц) датчиками. Оценка корреляционных зависимостей проводилась между 94 клинико-инструментальными показателями.
Результаты
В результате проведенного исследования было установлено, что дисциркуляция в системе позвоночных вен (ПВ), как правило, является следствием выраженных экстравазальных влияний (компрессия сосудов) на кровоток во внутренней яремной вене (ВЯВ) на стороне регистрации дисгемии (r = + 0,67; р 0,05).
Дисгемии в вене Галена справа чаще сопутствует повышение тонуса ПА, ВСА и СМА на ипсилатеральной стороне (как следствие рефлекторных изменений), равно как и первая оказывается связанной с перегибами и S-образной извитостью ВСА справа. Влияние извитости ВСА на венозный отток может быть обусловлено экстравазальной компрессией извитыми артериальными стволами венозных сосудов со значительно большим внутрисосудистым давлением в местах их максимально тесного прилегания.
Связь “синдрома головной боли” с ускоренным венозным кровотоком по венам Галена оказалась крайне низкой (r = +0,22; p 15 см/с, вене Галена > 20 см/с и прямом синусе > 30 см/с)
[1]. Предполагают, что при хронически текущих процессах в поло сти черепа венозное кровообращение страдает значительнее.
Отмечено, что резкое усиление венозного сигнала, изменение физиоло гического направления кровотока по внутренней глазной вене на ретроградное выявляют на стороне “очага” поражения мозга при нарушениях мозгового кровообращения черепно-мозговой травме, сопровождаемых повышением внутричерепного давления [13].

Рис. 2. Средняя мозговая артерия (СМА). Транстемпоральный доступ. Режим ЦДК (цветового допплеровского картирования) на уровне передней мозговой артерии (ПМА) (3), СМА (5), первого (7) и второго (8) сегментов ЗМА, вены Розенталя (9), вены Галена (10), средней мозговой вены (4), нижней желудочковой вены (приток вены Розенталя) (6). Ножки мозга (pedunculi cerebri) (1; 2).

Рис. 3. Средняя мозговая вена (глубокая). Там же. ЦДК, PW-режим. Сканирование потока в вене Розенталя. Vmax 15,88 см/с.

Рис. 4. Задняя мозговая артерия (сегмент Р1) (ЗМА). Транстемпоральный доступ. ЦДК, PW-режим. Сканирование патологического ускоренного потока в вене Розенталя. Vmax 28,59 см/с.

Рис. 5. Базилярное венозное сплетение. Транстемпоральный доступ. ЦДК, PW-режим. СМА (1), ЗМА сегмент Р1 (4), ножки мозга (6; 7), средняя мозговая вена (2), вена Розенталя (5). Сканирование потока в нижней желудочковой вене (приток вены Розенталя) (3).

Рис. 6. Базилярная (основная) артерия. Транстемпоральный доступ. Режим ЦДК на уровне ПМА (1), СМА (2), первого сегмента ЗМА (4), средней мозговой вены (3). Ножки мозга (pedunculi cerebri) (5; 6).

Рис. 7. Вена Розенталя (правая) и ветвь задней мозговой артерии (правая). Там же. ЦДК, PW-режим. Сканирование потока в средней мозговой вене (проксимальный сегмент).

Рис. 8. Позвоночная артерия (сегмент V1). Транстемпоральный доступ. ЦДК, PW-режим. Сканирование патологического ускоренного потока в средней мозговой вене (проксимальный сегмент). Vmax 24,62 см/с

Рис. 9. Краевой венозный синус. Транстемпоральный доступ. Режим ЦДК на уровне первого сегмента ЗМА (3), вены Розенталя (4), вены Галена (5). Ножки мозга (pedunculi cerebri) (1; 2).

Рис. 10. Вена Галена (большая вена мозга). Там же. ЦДК, PW-режим. Сканирование потока в вене Галлена. Vmax 21,18 см/с

Рис. 11. Прямой синус. Транстемпоральный доступ. ЦДК, PW-режим. Сканирование патологического ускоренного потока в вене Гален. Vmax 50 см/с

Рис. 12. Ветвь задней мозговой артерии (левая). Продольное сканирование в проекции сегмента V2 позвоночной артерии (1) и позвоночной вены (2). ЦДК и PW-режим. Vmax в позвоночной вене 34,69 см/с.

Рис. 13. Вена Розенталя (левая). Продольное сканирование в проекции сегмента V1 позвоночной артерии (1). ЦДК и PW-режим. Патологический ускоренный поток в позвоночной вене (2). Vmax 83,73 см/с.

Рис. 14. Нижняя желудочковая вена. Поперечное сканирование в проекции внутренней сонной артерии (3), наружной сонной артерии (2) и внутренней яремной вены (1). ЦДК и PW-режим. Vmax во внутренней яремной вене 41,49 см/с.

Рис. 15. Поперечное сканирование в проекции внутренней сонной артерии (1) и извитой внутренней яремной вены (2). ЦДК и PW-режим. Патологически ускоренный турбулентный поток во внутренней яремной вене до 80 см/с.

Рис. 16. Поперечное сканирование в проекции внутренней (1) и наружной (2) сонных артерий, наружной яремной вены (3). ЦДК и PW-режим. Vmax в наружной яремной вене 22,88 см/с.

Рис. 17. Транстемпоральный доступ. Режим ЦДК на уровне СМА (2), и клиновидно-теменного венозного синуса (1). Ножки мозга (pedunculi cerebri) (3).

Рис. 18. Там же (рис. 17). ЦДК, PW-режим. Сканирование потока в клиновидно-теменном венозном синусе (1). Vmax 19,19 см/с.
Другой проблемой, стоящей перед исследователем, даже в случае когда удается оценить характер венозного кровотока на интра- и экстракраниальном уровне, является правильная трактовка полученных результатов. Поскольку имеющиеся в распоряжении литературные данные не дают целостного представления о причинах венозной дисциркуляции, а в ряде случаев в качестве основной причины ее появления указывается повышение ВЧД, либо соединительнотканная дисплазия, без указания на возможные механизмы формирования венозной дисциркуляции, польза от подобных заключений крайне мала. На тактику дальнейшего лечения также нет возможности оказать влияние, поскольку неизвестны, либо не указаны, точки возможного приложения усилий врачами разных специальностей.
О повышении ВЧД как вероятной причине венозной дисциркуляции не следует забывать, что в силу своей небольшой распространенности в популяции (0,025-0,05% среди детей и подростков) данная патология не может рассматриваться в качестве ведущей этиологической причины дисгемии и скорее всего является диагнозом исключения.
Необоснованно редко диагностируются и функциональные нарушения опорнодвигательного аппарата с формированием блоков в мелких суставах позвоночника с появлением рефлекторных болевых мышечно-скелетных синдромов, а также недооценивается роль миофасциальных болевых синдромов, при которых мышца страдает первично. Не последнюю роль в этом у детей играют те или иные повреждения шейного отдела позвоночника в анамнезе (главным образом во время родов). В литературе описывается мозаичность возникающих патогенетических факторов в затруднении оттока венозной крови из черепа. При этом ведущее место в генезе динамических расстройств венозного кровообращения принадлежит миофасциальному болевому синдрому шейной локализации. При локализации миофасциального болевого синдрома в мускулатуре краниовертебрального перехода застойные венозные расстройства обусловлены общими алгическими процессами этой зоны, включая функциональные блокады перехода, тогда как туннельно-компрессионные механизмы в этой зоне не играют определяющую роль венозной дисциркуляции. Туннельно-компрессионные механизмы затруднения венозного кровотока наиболее актуальны при средне- и нижне-шейной локализации миофасциальной боли.
Заключение
С учетом полученных нами данных о сильной корреляционной зависимости ускоренного венозного кровотока и извитости ВСА, ПА (как косвенных проявлениях нарушений в шейном отделе позвоночника, в том числе и проявлениях натальной травмы шейного отдела позвоночника), мы считаем, что у детей и подростков ключевую роль в появлении дисгемии (нарушении венозного оттока) играет “патология/особенности строения” шейного отдела позвоночника и врожденные особенности строения ВСА на экстракраниальном уровне. В качестве основных причин дисгемии в детском возрасте следует рассматривать “врожденную соединительнотканную дисплазию” [19], проявляющуюся в виде патологии шейного отдела позвоночника, с искривлением и извитостью костного канала, либо “родовые травмы с подвывихом 1-2 шейного позвонков” (наличие в анамнезе у большинства обследованных лиц), с нарушением венозного оттока на экстракраниальном уровне.
Учитывая все изложенное выше, также следует сделать вывод о том, что в случае выявления картины венозной дисциркуляции, особенно у молодых лиц, лечение должно быть направлено в первую очередь на восстановление функциональной целостности опорно-двигательного аппарата шейного отдела позвоночника, исправление осанки, мануальные практики, а также соблюдение режимно-ограничительных мероприятий [20].
Литература
- Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология. М.: Реальное Время, 2003. 322 с.
- Valdueza J.M., Schmierer K., Mehraein S., Einhдupl K.M. Assessment of normal flow velocity in basal cerebral veins. A transcranial Doppler ultrasound study. 1996. Stroke 27. Р. 1221-1225.
- Schoser B.G., Riemenschneider N., Hansen H.C. The impact of raised intracranial pressure on cerebral venous hemodynamics: a prospective venous transcranial Doppler ultrasonography study // J. Neurosurg. 1999. V. 91, N 5. P. 744-749.
- Stolz E., Jauss M., Horning C. Cerebral venous anatomy in color-coded duplex sonography. What is possible in non-contrast enhanced TCCD? // New trends in cerebral haemodynamics and neurosonology / Eds. Kligelhofer J., Bartels E., Riglenshtein B. 1997. P. 312-319.
- Baumgartner R.W., Gonner F., Muri R. Normal haemodynamics in cerebral veins and sinuses: a transcranial color-coded duplex sonography study // New trends in cerebral haemodynamics and neurosonology / Eds. Kligelhofer J., Bartels E., Riglenshtein B. 1997. P. 312-319.
- Aaslid R. Cerebral hemodynamics // Transcranial Doppler / Eds. Newell D.W., Aaslid R.: – N.Y.: Raven, 1992. Р. 500.
- Шахнович В.А. Нарушение венозного кровообращения головного мозга по данным транскраниальной допплерографии // Ультразвуковая допплеровская диагностика сосудистых заболевания / Под. ред. Никитина Ю.М., Труханова А.И. М.: Видар, 1998. С. 355-400.
- Дическул М.Л., Куликов В.П., Маслова И.В. Ультразвуковая характеристика венозного оттока по позвоночным венам / Ультразвуковая и функциональная диагностика, 2008, N 4. С. 33-40.
- Иваничев Г.А., Долгих Г.Б. Нарушения артериального и венозного кровотока у детей с вертебрально-базилярной недостаточностью // Журнал неврологии и психиатрии, 2007, N 3.
- Долгих Г.Б., Иваничев Г.А. Церебральные сосудистые нарушения у детей с детским церебральным параличем и судорожным синдромом // Казанский медицинский журнал, 2008, N 3.
- Пуцилло М.В., Винокуров А.Г., Белов А.И. Атлас “Нейрохирургическая анатомия” / Под ред. Коновалова А.Н. М.: Антидор, 2002.
- Бурцев Е.М., Андреев А.В., Дьяконова Е.Н., Кутин В.А. Функциональная допплерография в детской ангионеврологии // Тезисы доклада на VIII Международной конференции: Современное состояние методов неинвазивной диагностики в медицине. Сочи, 2001. С. 151-160.
- Никитин Ю.М., Труханов А.И. Ультразвуковая допплеровская диагностика в клинике. МИК, 2004. 496 с.
- Adelson P.D., Bratton S.L., Carney N.A. et al. Guidelines for the acute medical management of severe traumatic brain injury in infants, children, and adolescents. Pediatr. Crit. Care Med. 2003; (4) 3.
- Samuel M., Burge D.M., Marchbanks R.J. Tympanic membrane displacement testing in regular assessment of intracranial pressure in eight children with shunted hydrocephalus // J. Neurosurg. 1998. V. 88. Р. 983-995.
- Bode H. Pediatric application of transcranial Doppler sonography / Wien; N.y.: Springer Verlag, 1988. P. 108.
- Росин Ю.А. Допплерография сосудов головного мозга у детей / СПбМАПО, 2006. 114 с.
- Белкин А.А., Алашеев А.М., Инюшкин С.Н. Транскраниальная допплерография в интенсивной терапии. Методическое пособие для врачей. Екатеринбург: Издание Клинического института Мозга СУНЦ РАМН; 2004.
- Андреев А.В., Лобанова Л.В., Ермолин И.Е. Транскраниальная допплерография и вариационная пульсометрия в диагностике церебральных ангиодистоний у детей // Журнал невропатологии и психиатрии. 1994. N 3. С. 22-23.
- Tsokolov A.V., Tsokolova V.A., Tsokolova M.A., Senchilo V.G., Egorov A.U. Venous discirculation // Journal of the Neurological Sciences. 333 (2013). e518. Abstract – WCN 2013, No102, Topic:8 – Headache. Vienne, Austria. 2013. Neurology in the age of globalization. XXI World Congress of Neurology.

УЗИ сканер H60
Точность, легкость, быстрота!
Универсальная система – современный дизайн, высокая функциональность и простота в использовании.
Вена розенталя не визуализируется
Что такое компьютерная томография печени и как проводится исследование

Многие годы безуспешно боретесь с ГИПЕРТОНИЕЙ?
Глава Института: «Вы будете поражены, насколько просто можно вылечить гипертонию принимая каждый день.
Использование КТ печени в качестве диагностического метода позволяет оценить состояние этого органа. На основании заключения намечается дальнейшее лечение. Заболевания печени в большинстве случаев не сопровождаются болезненными симптомами. Однако на протяжении всего периода болезни в ней происходят разрушительные изменения, от которых страдает весь организм в целом. Приостановить патологические процессы и помочь этому важному органу восстановить свои функции способны современные диагностические процедуры.
Когда возникает необходимость в компьютерной диагностике печени

Для лечения гипертонии наши читатели успешно используют ReCardio. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Томография печени нередко проводится по показаниям анализов, которые выявили отклонения в её состоянии. Характерной особенностью этого органа является почти полное отсутствие нервных окончаний, в связи с чем больной может долго не ощущать болевых симптомов и не подозревать о поражении печени, а на незначительные проявления неполадок в органе просто не обращать внимания.
Важность момента заключается в ранней диагностике заболевания, пациенты должны уметь отличить признаки болезненного состояния печени и сразу обратиться за медицинской помощью.
Первые симптомы проявляются в следующем:
- чувство тяжести и периодическая боль в правом подреберье;
- повторяющееся вздутие кишечника, сопровождающееся позывами рвоты или тошнотой;
- неприятный привкус во рту и тяжёлое дыхание;
- при пальпации в нижней части подреберья обнаруживается увеличение размеров печени;
- кожный покров становится желтоватым, моча приобретает тёмный цвет, а кал светлеет.
Компьютерная диагностика позволяет подтвердить имеющуюся патологию или убедиться в её отсутствии.
Однако в большинстве случаев даже несколько из перечисленных симптомов являются показателем следующих заболеваний этого органа:
- онкологические процессы;
- образование доброкачественной опухоли, гемангиома, поликистоз;
- проявление желтухи, вызванной различными причинами;
- нанесение травмы с разрывами, сопровождающейся кровотечением;
- болезни органов кроветворения;
- цирроз или дистрофия, вызванная ожирением печени;
- повреждение питающих сосудов.
При помощи томографии есть возможность послеоперационного наблюдения за состоянием органа, что позволяет заметить начальную степень осложнений и предпринять соответствующие меры.
В чём заключается подготовка к исследованию
Подготовка к проведению компьютерной томографии печени не требует больших затрат времени. Врачу, который будет проводить диагностику, нужно будет предоставить свою медицинскую карту, а также дополнительно сообщить ему о хронических заболеваниях, беременности, а также периода грудного вскармливания. Если больной продолжает переживать по поводу исследования, врач рекомендует принять седативный препарат.
В качестве основного условия для успешного сканирования рекомендуется полный отказ от пищи за 6-7 часов до исследования.
 В отличие от классического способа, компьютерная томография печени с использованным контрастом, за два дня до обследования полностью исключает употребление в пищу продуктов, способствующих повышенному газообразованию.
В отличие от классического способа, компьютерная томография печени с использованным контрастом, за два дня до обследования полностью исключает употребление в пищу продуктов, способствующих повышенному газообразованию.
К ним относятся:
- молочные продукты и сахар;
- яйца и рыба;
- все мучные изделия;
- растительные масла;
- бобовые;
- капуста, картофель и лук;
- сладкие напитки с газом.
Противопоказания к проведению диагностики
Обследование печени с помощью компьютерной томографии может иметь ограничения в проведении, знать и следовать которым необходимо в обязательном порядке.
К таким состояниям относят:
- Период беременности, особенно её первый триместр.
- Возраст пациента, не достигшего 16 лет. В исключительных случаях может быть проведена, но только при жизненной необходимости.
- Рак кожи.
- Индивидуальная непереносимость контрастного средства или рентгеновского излучения.
- Излишний вес пациента, превышающий 170 кг.
- Тяжёлые патологические процессы, затрагивающие почечные и сердечные функции, проблемы в состоянии щитовидной железы, последние стадии диабета, миелома.
Диагностику с КТ проводят при наличии чётких показаний в её необходимости и с письменного согласия пациента. По причине использования рентгенологического излучения, детям до 16 лет её не проводят, за исключение экстренных случаев, требующих принятия срочных мер.
Диагностику с применением контраста не применяют к пациентам с тяжёлым поражением мочеполовой системы и при аллергической реакции на йод.
Обследование по сегментам печени
 Деление печени по сегментам делает процедуру проще и доступнее.
Деление печени по сегментам делает процедуру проще и доступнее.
Подобное разделение позволяет оценить все части органа, где возможно развитие воспалительного очага и подобных патологических нарушений в её структуре.
Печень имеет всего пять сегментов, соединённых с помощью протоков, отчётливо прослеживающихся на фото монитора.
Благодаря обследованию по сегментам можно с точностью определить в каком из них располагается очаг патологии.
В дальнейшем это во многом облегчит контроль за состоянием органа после лечения.
Чем лучше КТ в сравнении с УЗИ
Преимущество томографии с использованием компьютера в способности показывать наиболее отчётливое изображение. При помощи высокой проходимости рентгеновских лучей появилась возможность провести осмотр глубокорасположённых органов у пациентов с излишним весом, то есть там, куда ультразвуковые волны не могут проникнуть из-за обширной жировой прослойки.
Процедура КТ имеет более высокую стоимость, в связи с этим многие пациенты, несмотря на меньшую её информативность, всё же чаще обращаются к УЗИ.
Расшифровка результата
После обследования пациенту выдаётся заключение, составленное врачом-рентгенологом, в котором фиксируются имеющиеся отклонения в функциях печени, желчевыводящих протоках, жёлчном пузыре, а также полученные снимки или запись на видеодиске.
Печень в норме должна иметь гомогенную структуру, достаточную плотность с участками меньшей плотности в расположении сосудов. Воротная вена визуализируется в отличие от печёночной артерии и внутрипеченочных протоков, которые остаются невидимыми.
 Новообразования обладают меньшей плотностью, поэтому с лёгкостью обнаруживаются. Первичная опухоль и её метастазы выглядят в виде круглого образования, имеющего чёткие или размытые границы.
Новообразования обладают меньшей плотностью, поэтому с лёгкостью обнаруживаются. Первичная опухоль и её метастазы выглядят в виде круглого образования, имеющего чёткие или размытые границы.
Большие по размеру образования вызывают деформацию контуров органа, что чётко прослеживается на снимках. Абсцессы принимают видимость гомогенных очагов с чёткими границами, а обнаруженная киста имеет вид круглого или овального образования и меньшую плотность структуры.
Для чего проводят контрастную КТ
Контрастное вещество, являющее своеобразным индикатором, позволяет сделать снимки с более чёткими изображениями, по которым без труда можно определить в каком состоянии находятся сосуды, лимфатическая система, а также обнаружить зарождение опухолевых процессов. При проведении диагностики с помощью контраста это вещество выпивают или его вводят в кровеносную систему с помощью инъекции.
После завершения процедуры введённое вещество выводится из организма естественным образом, более быстрому высвобождению от него будет способствовать обильное питьё. При проведении инъекции необходимо быть готовым к приступам жара, лёгких головокружений, тошноты и головной боли.
Контрастное вещество позволяет получить более подробные сведения о состоянии печени, нарушениях функций жёлчного пузыря, об их строении и степени функционирования.
Когда возникает необходимость в назначении МСКТ печени
 В некоторых случаях врачи рекомендуют пациентам воспользоваться МСКТ печени – современным методом, являющимся разновидностью КТ, который также использует рентгеновские лучи для получения изображений.
В некоторых случаях врачи рекомендуют пациентам воспользоваться МСКТ печени – современным методом, являющимся разновидностью КТ, который также использует рентгеновские лучи для получения изображений.
Метод основывается на разности, с которой ткани с разной плотностью поглощают излучение. Этот вид диагностики позволяет получить трёхмерное изображение печени и её протоков. На полученных изображениях можно выявить самые мельчайшие изменения, отличающие её от нормы.
Диагностику МСКТ печени назначают в следующих случаях:
- оценка состояния органа, её форма, плотность, оценка окружающих её тканей;
- способность функционирования кровеносных сосудов;
- имеющиеся метастазы;
- воспалительные процессы в поджелудочной железе;
- наличие цирроза;
- развитие воспалений и камни в желчевыводящих путях.
Помимо всего перечисленного, проводимое трёхмерное обследование позволяет обнаружить повреждение сосудов в печени в месте их сужения. А также закупоривание её протоков, что почти невозможно выявить другими диагностическими методами.
Так как лучевое воздействие томографа обладает тератогенным эффектом, метод КТ к детям начинаю применять с 14 лет. Более ранее использование возможно, но только в случае крайней необходимости и при условии, что ребёнок все это время сможет оставаться неподвижным. В иных ситуациях, не угрожающих жизни, КТ лучше заменить на УЗИ.
Заболевания печени
Основными симптомами, заставляющими подозревать болезни печени и вызывать необходимость её обследования, являются непривычные ранее проявления, ощущаемые в правом боку, привкус горечи после употребления жирной пищи.
 Наиболее распространёнными заболеваниями печени являются:
Наиболее распространёнными заболеваниями печени являются:
- Цирроз, в результате воспалительных процессов на печени образуются рубцовые ткани, которые препятствует её нормальной работе.
- Вирусный гепатит, представляющий собой целую группу вирусных инфекций, вызывающих поражение печени. Все группы этого заболевания объединяет то, что клетки печени поражаются вирусом.
- Гепатома или первичный рак, может возникать в следствии протекающего цирроза печени.
- Абсцессы, являющиеся гнойными процессами, разрушающими сегменты органа.
Заболевания печени могут иметь бактериальную природу, а также быть вызваны паразитарными возбудителями. Благодаря КТ можно определить количество гнойных очагов и стадию поражения органа.
Альтернативные способы диагностики
Методик, представляющих альтернативу КТ в качестве диагностического способа, немало. Все они взаимозаменяемы и нередко проводятся в качестве комплексного обследования. К лучевому сканированию прибегают, когда остальные методы не показали точного результата.
Самую подробную картину обследования печени можно получить в результате использования ПЭТ КТ, являющейся результатом последних разработок ядерной медицины. Эта аппаратура позволяет исследовать патологические изменения, происходящие в печени в режиме реального времени.
К сожалению, доступность диагностики продолжает оставаться не на высоте. Несмотря на возможности медицины, провести обследование в условиях городских клиник можно лишь на УЗИ, но зато это теперь можно сделать чуть ли не в кабинете каждого специалиста.
Другие альтернативные способы доступны только в специализированных диагностических центрах и в областной поликлинике, и то там существует предварительная запись на несколько дней вперёд.
Несмотря на наличие разнообразных альтернатив, по отзывам наиболее популярным остаётся привычное УЗИ, которое совершенно безопасно для организма и может проводиться столько раз, сколько требует ситуация.
Транскраниальный доплер (лекция на Диагностере)
Статья находится в разработке.
Транскраниальная доплерография полезна для диагностики эмболии, стеноза, вазоспазма после субарахноидального кровоизлияния, деформации сосудов и др.
Чтобы УЗ-луч прошел кость черепа, используют секторный датчик 1-2,5 МГц. Стенку и просвет сосудов в В-режиме не видно, исследуют «цветной» слепок и скорости потока.
Для височного и орбитального доступа пациент в положении лежа на спине; доступ через большое затылочное отверстие со стороны затылка.
Орбитальный доступ через верхнее веко при закрытых глазах пациента; можно видеть глазную артерию и поперечный срез сифона ВСА.
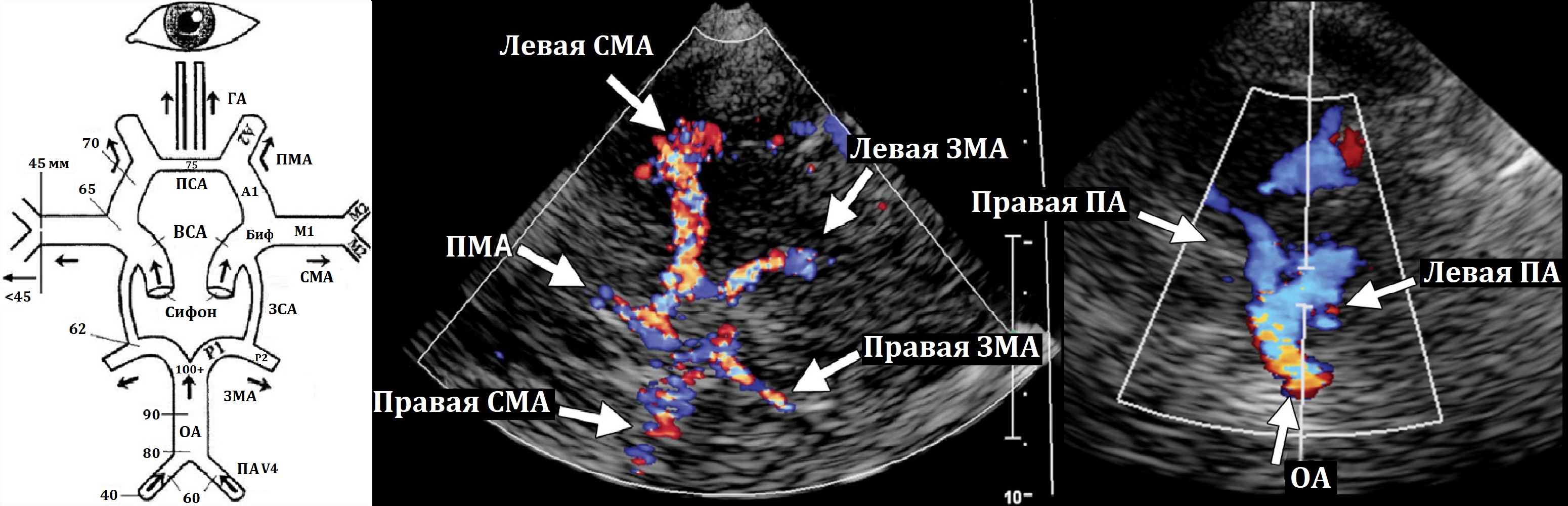
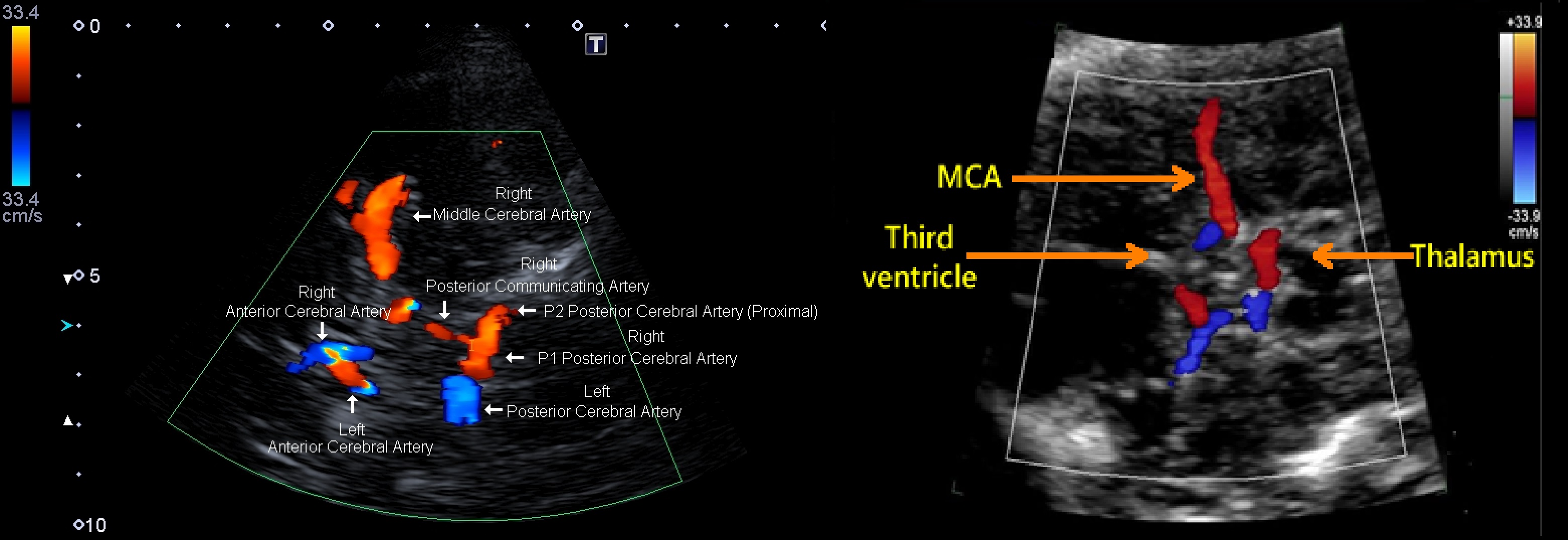
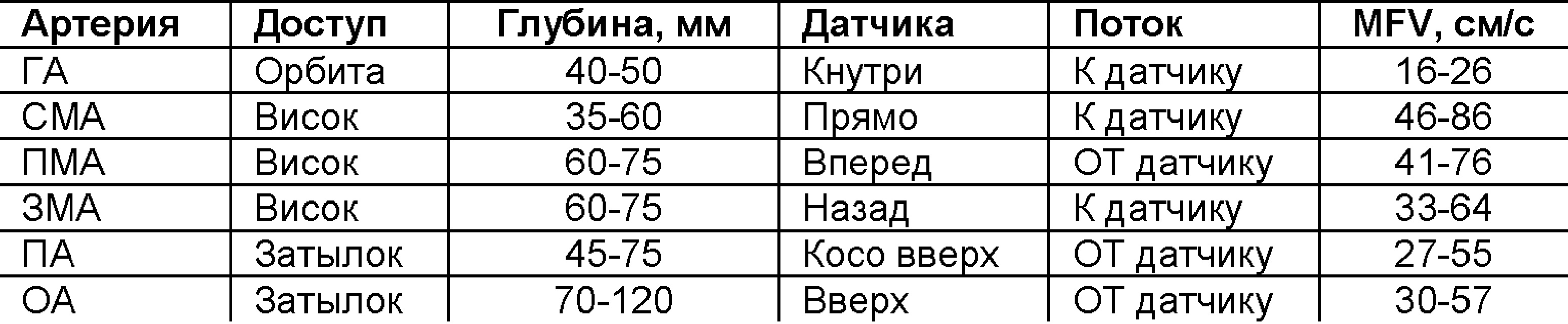
Доступ через висок кпереди, над и кзади от ушной раковиной: можно видеть СМА, ПМА, ЗМА, ПСА, ЗСА, поперечный срез, СМВ, вены Розенталя и Галена, прямой синус.
Доступ через большое затылочное отверстие: можно видеть ПА и ОА, Р1 и Р2 сегменты ЗМА, мозжечковые артерии; прямой синус, венозные сплетения основания черепа.
ТКДС начинают с общего осмотра структур головного мозга в В-режиме, оценивают наличие патологических образований в них. Средний мозг — «бабочка» средней эхогенности. «Бабочку» огибает пульсирующая структура — ЗМА.
Височные рога бокового желудочка определяются в височной доле как гипоэхогенные структуры продолговатой формы, содержащие гиперэхогенное сосудистые сплетение.
Основание черепа имеет высокую эхоплотность. Гиперэхогенные малые крылья каменистой и клиновидной костей, формирующих границу средней черепной ямки, являются ее главными ориентирами.
Параллельно им в гипоэхогенной сильвиевой щели находится пульсирующая структура, соответствующая стволу (сегмент M1) средней мозговой артерии (СМА).
При легком наклоне датчика краниально визуализируется таламус овоидной формы. Шишковидная железа имеет повышенную эхоплотность.
Третий желудочек и межполушарная щель визуализируются как среднелинейные структуры повышенной эхоплотности. В области межполушарной щели определяется пульсация передней мозговой артерии (ПМА), по бокам от межполушарной щели несколько асимметрично, продолговатой формы рога боковых желудочков.
Анатомическим ориентиром при сканировании СМА, сифона ВСА, ПМА, СМВ является гиперэхогенная пирамида височной кости; сегмент А1 ПМА в проекции межполушарной щели; ЗМА, вена Розенталя, поперечника ОА рядом с ножками мозга; вена Галена, прямой синус и зоны синусовый сток в районе таламуса и III желудочка.
Все артерии питающие головной мозг имеют низкое периферическое сопротивление: высокая скорость в диастолу и низкий ИР. В парных артериях разница скорости потока до 30%, ИР до 10%.
Количественные показатели кровотока у здоровых лиц вариабельны и зависят от АД, времени суток, эмоционального фона, времени от момента выкуривания последней сигареты, фазы менструального цикла.
В СМА поступает около 55% общего объема крови, в ПМА 20% и в ЗМА 25%. У взрослых в норме линейная скорость кровотока в СМА 75±15 см/сек, ПМА 49±11 см/сек, ЗМА 38±11 см/сек.
СМА красная, спектр выше базовой линии, так как поток направлен к датчику, TAMX 122 см / с. Передняя мозговая артерия сегмента A1 синяя, спектр ниже базовой линии, поскольку поток от датчика направлен к средней линии мозга.
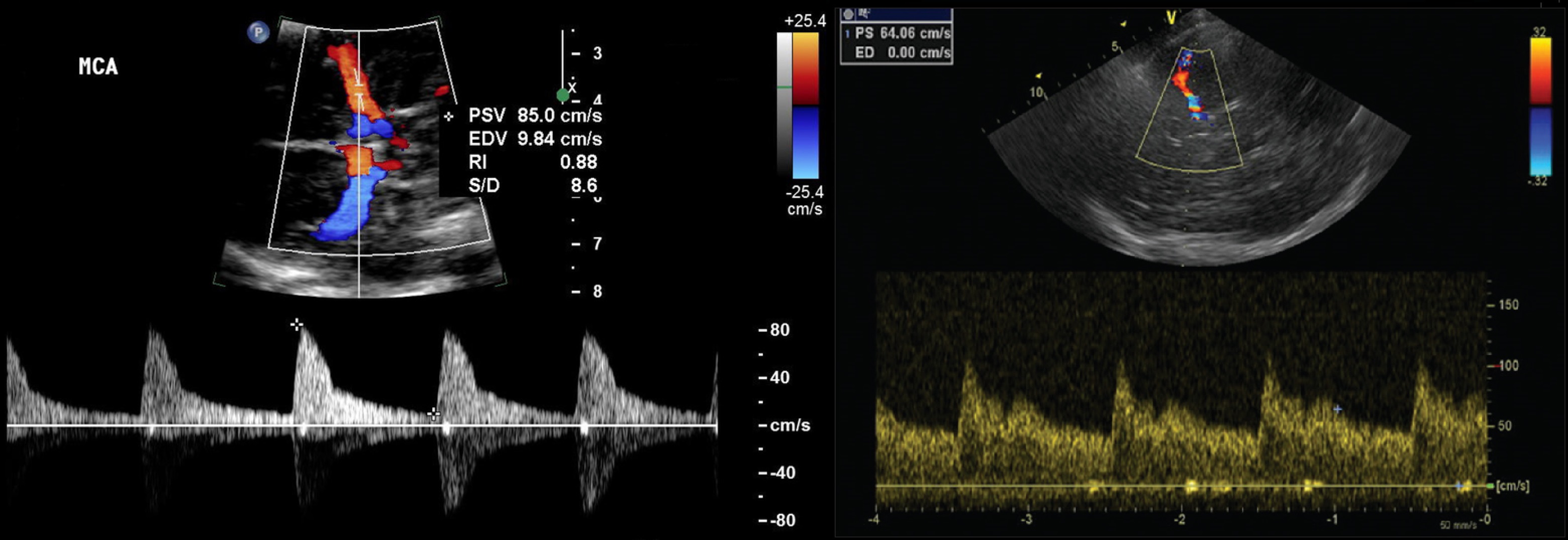
Наиболее часто используют среднюю по времени максимальную скорость (TAMX), также называемое средней скоростью. Пиковая систолическая скорость (VS) и конечная диастолическая скорость (VD) также могут быть измерены.
При локальном сужение артерии или спазме TAMX повышается в сегменте 5-10 мм на 30 см/с по сравнению с противной стороной.
Высокий TAMX при стенозе, спазме сосудов, гипердинамическом потоке, пониженном гематокрите; низкий TAMX при артериальной гипотензии, смерти ствола мозга.
Таблица. Средняя по времени максимальная скорость (TAMX) в сосудах основания мозга (Aaslid, 1982)
Можно рассчитать два показателя, отражающие сосудистое периферическое сопротивление. Индекс пульсации PI в норме 0,7-1,1. Резистивный индекс RI после периода новорожденности составляет 0,5 ± 15% (0,43-0,58).
Эти два индекса всегда меняются в одном направлении. При низком сопротивлении потоку во время диастолы скорость потока выше, RI и PI снижаются.
Например, ниже по течению от тяжелого стеноза из-за ишемии повышается PCO2, наступает вазодиляция.
Внутричерепная гипертензия из-за диффузного увеличения сопротивления приводит к повышению индексов.
Скорость на внутричерепных артериях повышается при высоком объемном потоке или стенозе. Стеноз менее 50% не приводит к значимым нарушениям гемодинамики. Состояние экстракраниальных сосудов влияет на результат.
В сифоне ВСА из-за физиологического изгиба трудно установить датчик под правильным углом; косвенными признаками стеноза в этой зоне считают однотипные изменения спектра в СМА и ПМА.
В ПСА, ЗСА, супраклиновидной части ВСА, СМА и ОА встречаются аневризмы; к основному сосуду прилежит цветное пятно округлой формы; из-за слепых участков с тромбами трудно оценить размер.
При ТКДС видно венозные структуры головного мозга: верхний сагиттальный синус 0-54%. поперечный синус 20-73%, сток синусов 17-53%. При скорости кровотока менее 4 см/сек сосуд не определяется на ТКДС.
Исследование глубокой венозной системы проводят через висок на аксиальном срезе через промежуточный мозг, где видно дорсальные части таламуса и затылочные доли конечного мозга. Параллельно средней мозговой артерии располагается глубокая средняя мозговая вена.
Прямой синус представляет собой окрашенную в синий цвет точечную структуру, расположенную в дорсальной части серединной линии, в ряде случаев возможно визуализировать впадение его в синусный сток. Синусный сток определяется каудальнее прямого синуса и проецируется несколько асимметрично на контралатеральную затылочную кость. Кпереди от прямого синуса, в среднедорсальной части промежуточного мозга, определяется окрашенная синим цветом тубулярная структура — большая вена мозга, или вена Галена, в которую впадают внутренние и базальные вены мозга.
Через затылок визуализируют прямой синус; также возможно получение изображения верхнего и нижнего сагиттальных синусов. В норме спектр допплеровского сдвига частот в венах мозга имеет слабовыраженную фазность.
Вариантная анатомия вены Розенталя у трупов с разной формой черепа
Сосудистые заболевания головного мозга остаются одной из главных проблем современной медицины, вносящие существенный вклад в общую структуру смертности и инвалидности населения всего земного шара [12].
В этой связи остаётся актуальным более детальное и при этом комплексное исследование сосудов головного мозга, ведь нет оснований отвергать положение о том, что даже незначительные морфологические особенности строения сосудов головного мозга могут оказать решающую роль в развитии патологии.
Если ознакомиться с результатами морфологических исследований сосудов головного мозга, то легко обнаружить, что со значительным перевесом превалируют работы по строению артериальной системы, в то время как вены, количество которых превышает количество артерий, несколько обделены вниманием исследователей. При этом очевидно, что система «притока» крови не может являться всеобъемлющей и основной мишенью при развитии цереброваскулярной патологии, а система «оттока» оставаться интактной.
В настоящее время, наиболее часто встречаемое строение глубоких вен головного мозга представлено во многих отечественных и зарубежных руководствах [1-3,8,10,11,16,18], в то время как варианты строения (в том числе и крайние варианты) и конституциональные особенности изучены недостаточно полно.
Стоит также отметить, что большинство из глубоких вен головного мозга в настоящее время может быть выявлено прижизненно при проведении церебральной ангиографии, многослойной компьютерной томографии (МСКТ), магнитно-резонансной томографии (МРТ). Однако ряд притоков, участвующих в формировании глубоких мозговых вен визуализируются только в отдельных случаях (при их крупном размере), либо не визуализируются вовсе. В этой связи актуальными по-прежнему остаются анатомические исследования, с наливками сосудов и микропрепаровкой, для более целостного представления о строении сосудов головного мозга и глубоких вен в частности.
Материалы и методы исследования. Работа выполнена на базе кафедры топографической анатомии и оперативной хирургии КрасГМУ им. В.Ф. Войно-Ясенецкого за период 2010–2012 г. Исследовано 112 препаратов головного мозга, изъятых у лиц, умерших от причин не связанных с поражением центральной нервной системы, поступивших в бюро судебной экспертизы трупов Красноярского краевого бюро судебно-медицинской экспертизы.
Перед изъятием головного мозга на трупах проводилось краниометрическое исследование по методике В.Н. Шевкуненко [15,16] с измерением продольного и поперечного размеров черепа и последующим вычислением краниального индекса (КИ) по формуле: КИ = Поперечный диаметр/Продольный диаметр х 100. В соответствии с полученными цифрами, определялась форма черепа с выделением брахи, долихо и мезоцефалов.
В изъятом мозге катетеризировалась и промывалась тёплой водой вена Галена. Затем по катетеру вводился раствор метиленовой сини до того момента, как окрашивались передняя и глубокая средняя мозговые вены. Для лучшей визуализации глубоких вен основания мозга препарировались и удалялись артерии Виллизиевого круга и выполнялась частичная резекция базальных отделов височных долей. В некоторых случаях заливка красителя в вену Галена не позволяла полностью прокрасить все глубокие мозговые вены (такие как глубокая средняя мозговая вена, передняя мозговая вена), тогда пунктировалась непосредственно вена Розенталя (в её среднем отделе) и через неё водился раствор метиленовой сини.
Полученные цифровые значения по длине, диаметру вены, количеству и расположению притоков заносились в базу данных. Полученные цифровые данные статистически обработаны с помощью пакета анализа Microsoft Excel 2007.
Результаты и обсуждение. На протяжении вены Розенталя выделяют 3 отдела: 1. передний – предталамический (вены формируются на уровне переднего продырявленного вещества). 2. средний – соответствует положению таламуса. 3. задний – вдоль стенки нижнего рога бокового желудочка. Рассмотрим отдельно особенности строения каждого отдела вены Розенталя.
Классически предталамический отдел вены формируется на уровне переднего продырявленного вещества путём слияния передней мозговой и глубокой средней мозговой вен. Такой тип образования предталамического отдела базальной вены Розенталя с двух сторон встречался в 48,2% случаев, только с левой стороны – в 10,7% случаев, только с правой стороны – в 11,6% случаев. Соответственно в 10,7% случаев справа базальная вена начиналась непосредственно от глубокой средней мозговой вены, а передняя мозговая вена не прослеживалась вовсе и таким же образом в 11,6% случаев слева. В 7,4% случаев (8 наблюдений) базальная вена Розенталя не имела предталамической части, а начиналась от сосудистого сплетения бокового желудочка (от нижней вены бокового желудочка).
Наиболее постоянными притоками среднего отдела базальной вены Розенталя были межножковые вены и нижние вены бокового желудочка. С двух сторон межножковые вены встречались в 80,3% случаев, только с левой стороны в 8,9% случаев, с правой стороны в 10,7% случаев). Нижние вены бокового желудочка встречались с двух сторон в 100% случаев.
В исследуемых препаратах отмечалось неодинаковое расположение среднего отдела вены Розенталя по отношению к зрительному тракту.
Было выявлено два положения:
1. Вена лежит медиальнее зрительного тракта.
2. Вена лежит на зрительном тракте.
В 76,7% случаев слева вена Розенталя располагалась медиальнее зрительного тракта, в 23,3%случаев – располагалась на зрительном тракте. В 84,8% случаев справа вена Розенталя располагалась медиальнее зрительного тракта, в 15,2%случаев – на зрительном тракте.
Наиболее часто встречающимся притоком нижнего отдела базальной вены Розенталя являлась медиальная затылочная вена, которая обнаруживалась с двух сторон в 37,5% случаев, только с левой стороны в 14,2% случаев, только справа – в 8% случаев. В остальных случаях медиальная затылочная вена впадала непосредственно в вену Галена.
Из крайних вариантов строения представляет интерес удвоение вены Розенталя с одной стороны, которое встречалось в 4 случаев из 112 наблюдений (3,5% случаев). Во всех случаях такой тип строения наблюдался только с одной стороны. При этом одна вена была продолжением глубокой средней мозговой вены (при её слиянии с передней мозговой веной), а вторая вена начиналась от нижней вены бокового желудочка.
Длина вены Розенталя колебалась от 23 мм до 46 мм. Такой большой размах в длине обусловлен местом образования вены Розенталя. Если она начиналась от нижней вены бокового желудочка, то длина её колебалась от 23 до 29 мм, если же она имела классический тип строения и начиналась в месте слияния глубокой средней и передней мозговой вены, длина её колебалась от 37 до 46 мм.
Данные по длине вены Розенталя у трупов с разной формой черепа представлены в табл. 1.
Таблица 1. Длина вены Розенталя у трупов с разной формой черепа М±ϭ
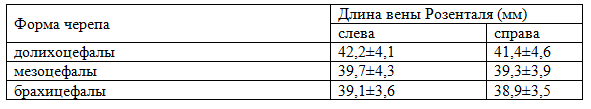
Из данных, представленных в табл. 1 видно, что у трупов с долихоцефальной формой черепа наблюдались несколько большие значения длины вены Розенталя, в сравнении с брахи и мезоцефалами.
Диаметр вены Розенталя был неодинаковым в начальном, среднем и нижнем отделах (в месте впадения в вену Галена).Диаметр начального отдела колебался от 1,3 до 1,9мм, среднего отдела от 2,7 до 3,5 мм, нижнего отдела от 2,8 до 4,6 мм.
Диаметры разных отделов вены Розенталя у трупов с разной формой черепа представлены в табл. 2.
Таблица 2. Диаметр вены Розенталя у трупов с разной формой черепа М±ϭ
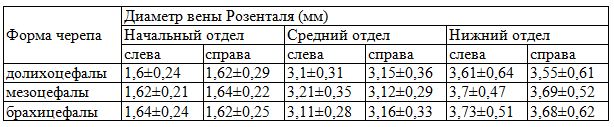
Из данных табл. 2 видно, что диаметр вены Розенталя увеличивается от начального до нижнего отдела в среднем на 2 мм.
Таким образом, проведённое исследование выявило конституциональные особенности строения вены Розенталя. Полученные результаты могут представлять интерес при изучении этиопатогенеза цереброваскулярных заболеваний.
Список использованных источников:
1. Беков Д.Б. Хирургическая анатомия большой галеновой вены// Вопр. нейрохир. – 1959. – №4. – С.6-9.
2. Беков Д.Б. Атлас венозной системы головного мозга человека. – М.: Медицина, 1965. – 360 с.
3. Атлас артерий и вен головного мозга человека/ Д.Б. Беков, С.С. Михайлов. – М.: Медицина, 1979. – 288 с.
4. Мозг человека в цифрах и таблицах / С.М. Блинков, И.И. Глезер. – Л.: Медицина, 1964. – 314 с.
5. Богуславская Т.В. Изготовление топографо-анатомических препаратов и методика некоторых анатомических исследований. – М.: Медицина, 1959. – 151с.
6. Бунак В.В. Антропометрия. – М.: Учпедгиз Наркомпроса РСФСР, 1941. – 368 с.
7. Клиническая анатомия мозгового отдела головы/ М.П. Бурых, И.А. Григорова. – Харьков, 2002. – 138 с.
8. Герасимов Е.М. Вены головы и пути оттока крови из полости черепа: Автореф. дис. … д-ра мед. наук. – Оренбург, 1975. – 36 с.
9. Общая, частная и локальная конституция/ Н.С. Горбунов, В.Г. Николаев// Актуальные вопросы биомедицинской и клинической антропологии: Матер. науч. конф. – Красноярск, 2001. – С. 18–21.
10. Каган И.И. Венозная система глубоких отделов головного мозга в норме и при патологии: Автореф. дис. … д-ра мед. наук. – Оренбург, 1968. – 34 с.
11. Каган И.И. Анатомическое исследование топографии глубоких магистральных вен мозга при опухолях основания головного мозга и черепа// Вопр. нейрохир. – 1968. – №2. – С.28 – 35.
12. Геморрагический инсульт/ В.И. Скворцова, В.В. Крылов. – М.: ГЭОТАР-Медиа, 2007. – 361 с
13. Форма и конструкция черепа/ В.С. Сперанский, А.И. Зайченко. –М., 1980. – 280 с.
14. Шевкуненко В.Н. Типовая и возрастная анатомия. – Л.: Биомедгиз, 1925. – 45с.
15.Типовая анатомия человека/ В.Н. Шевкуненко, А.М. Геселевич. – Л., 1935 – 232 с.
16. Hasler O. Deep cerebral venous system in man: microangiographic study of its areals of drainage and its anastomoses with superficial cerebral vein// Neurology. – 1966. – V.16. – P. 505–511.
17. The ontogenetic and phylogenetic basis of cerebrovascular anomalies and variants/ P.L. Mayer, E.L. Kier// Brain surgery: complication avoidance and management / Ed.Apuzzo M.L.J. – New York: Churchill Livingstone, 1993. – Vol.1. – P.691–792.
18. Rhoton А. Cranial Anatomy and Surgical Approaches. – Lippincott Williams & Wilkins, 2007. – 746 р.
19. Weingarten M. Form, Structur und Function// Aufsatze und Reden SencKeberg naturforsch Ges. – 1995. – №43. – S. 7–14.